Аминокислоты, белки
Аминокислоты, белки
Содержание.
1. Классификация аминокислот.
2. Синтезы 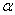 ,
, 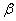 ,
, 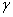 - аминокислот.
- аминокислот.
3. Свойства аминокислот: амфотерность, реакция по аминогруппе и карбоксилу.
4. 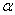 - аминокислоты, их роль в природе.
- аминокислоты, их роль в природе.
5. Синтез пептидов.
Белковые вещества:
1. Классификация.
2. Строение. Первичная структура, понятие о вторичной, третичной и четвертичной структурах.
3. Понятие о ферментах.
Классификация аминокислот.
Аминокислотами называются органические кислоты, содержащие одну или несколько аминогрупп. В зависимости от природы кислотной функции аминокислоты подразделяют на аминокарбоновые, например H2N(CH2)5COOH, аминосульфоновые, например H2N(CH2)2SO3H, аминофосфоновые, H2NCH[P(O)(OH)2]2, аминоарсиновые, например, H2NC6H4AsO3H2.
Согласно правилам ИЮПАК название аминокислот производят от названия соответствующей кислоты; взаимное расположение в углеродной цепи карбоксильной и аминной групп обозначают обычно цифрами, в некоторых случаях - греческими буквами. Однако, как правило, пользуются тривиальными названиями аминокислот. ( см. таблицу 1.) .
В зависимости от положения аминогруппы по отношению к карбоксилу различают 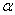 ,
, 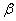 и
и 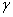 - аминокислоты:
- аминокислоты:
| | | | | |
| |
CH3CH2CHCOOH
ç
NH2
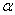 -аминомасляная -аминомасляная
кислота | | | |
CH2CH2COOH
ç
NH2
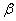 -аминопропионовая -аминопропионовая
кислота | | | |
CH2CH2CH2COOH
ç
NH2
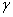 -аминомасляная -аминомасляная
кислота | |
Все 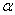 - аминокислоты, кроме аминоуксусной (глицина), имеют асимметрический
- аминокислоты, кроме аминоуксусной (глицина), имеют асимметрический 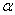 - углеродный атом и существуют в виде двух энантиомеров. За редким исключением, природные
- углеродный атом и существуют в виде двух энантиомеров. За редким исключением, природные 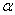 -аминокислоты относятся к L- ряду (S-конфигурация) и имеют следующее пространственное строение:
-аминокислоты относятся к L- ряду (S-конфигурация) и имеют следующее пространственное строение:
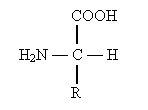 По физическим и ряду химических свойств аминокислоты резко отличаются от соответствующих кислот и оснований. Они лучше растворяются в воде, чем в органических растворителях; хорошо кристаллизуются; имеют высокую плотность и исключительно высокие температуры плавления. Эти свойства указывают на взаимодействие аминных и кислотных групп, вследствие чего аминокислоты в твёрдом состоянии и в растворе (в широком интервале pH) находятся в цвиттер-ионной форме (т.е. как внутренние соли). Взаимное влияние групп особенно ярко проявляется у
По физическим и ряду химических свойств аминокислоты резко отличаются от соответствующих кислот и оснований. Они лучше растворяются в воде, чем в органических растворителях; хорошо кристаллизуются; имеют высокую плотность и исключительно высокие температуры плавления. Эти свойства указывают на взаимодействие аминных и кислотных групп, вследствие чего аминокислоты в твёрдом состоянии и в растворе (в широком интервале pH) находятся в цвиттер-ионной форме (т.е. как внутренние соли). Взаимное влияние групп особенно ярко проявляется у 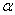 -аминокислот, где обе группы находятся в непосредственной близости.
-аминокислот, где обе группы находятся в непосредственной близости.
Цвиттер-ионная структура аминокислот подтверждается их большим дипольным моментом (не менее 50×10-30 Кл × м), а также полосой поглощения в ИК- спектре твердой аминокислоты или её раствора.
Таблица 1. Важнейшие аминокислоты. |
Тривиальное название |
Сокр.название ос- татка ами нок-ты |
Формула |
Температура плавления, 0С. |
Растворимость в воде при 250С, г/100г. |
|
Моноаминомонокарбоновые кислоты |
|
Гликокол или глицин |
Gly |
H2NCH2COOH |
262 |
25 |
|
Аланин |
Ala |
H2NCH(CH3) COOH |
297 |
16,6 |
|
Валин |
Val |
H2NCHCOOH
ï
CH(CH3)2 |
315 |
8,85 |
|
Лейцин |
Leu |
H2NCHCOOH
ï
CH2CH(CH3)2 |
337 |
2,2 |
|
Изолейцин |
He |
H2NCHCOOH
ï
CH3 ─ CH ─ C2H5 |
284 |
4,12 |
|
Фенилаланин |
Phe |
H2NCHCOOH
ï
CH2C6H5 |
283 (разл.) |
― |
|
Моноаминодикарбоновые кислоты и их амиды |
|
Аспарагиновая кислота |
Asp(D) |
H2NCHCOOH
ï
CH2COOH |
270 |
0,5 |
|
Аспарагин |
Asn(N) |
H2NCHCOOH
ï
CH2CONH2 |
236 |
2,5 |
|
Глутаминовая кислота |
Glu(E) |
H2NCHCOOH
ï
CH2CH2COOH |
249 |
0,84 |
|
Глутамин |
Gln(Q) |
H2NCHCOOH
ï
CH2CH2CONH2 |
185 |
4,2 |
|
Диаминомонокарбоновые кислоты |
|
Орнитин(+) |
Orn |
H2NCHCOOH
ï
CH2CH2CH2 NH2 |
140 |
― |
|
Лизин |
Lys(K) |
H2NCHCOOH
ï
CH2CH2CH2 CH2NH2 |
224 |
Хорошо растворим |
|
Аминокислоты |
|
Аргинин |
Arg® |
H2NCHCOOH
ï
CH2
ï
CH2CH2 NH ─ C ─ NH2
║
NH |
238 |
15 |
|
Гидроксиаминокислоты |
|
Серин |
Ser(S) |
H2NCHCOOH
ï
CH2OH |
228 |
5 |
|
Треонин |
Tre(T) |
H2NCHCOOH
ï
CH2 (OH)CH3 |
253 |
20,5 |
|
Тирозин |
Tyr(Y) |
H2NCHCOOH
ï
CH2C6H4OH-n |
344 |
― |
|
Тиоаминокислоты |
|
Метионин |
Met(M) |
H2NCHCOOH
ï
CH2CH2SCH3 |
283 |
3,5 |
|
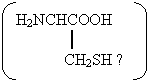 Цистин Цистин
|
(Cys)2 |
2
|
260 |
0,011 |
|
Цистеин |
Cys© |
H2NCHCOOH
ï
CH2SH |
178 |
Хорошо растворим |
|
Гетероциклические аминокислоты |
|
         Триптофан Триптофан
|
Try(W) |
H2NCHCOOH
ï
H2C
NH
|
382 |
1,14 |
|
   Пролин Пролин
|
Pro(P) |
H2C CH2
ï ï
H2C CHCOOH
NH
|
299 |
16,2 |
|
   Оксипролин Оксипролин
|
Opr |
HOHC CH2
ï ï
H2C CHCOOH
NH
|
270 |
36,1 |
|
     Гистидин Гистидин
|
His(H) |
NH2CHCOOH
ï
H2C ―C ―― CH
ï ï
N NH
CH
|
277 |
4,3 |