Анализ и технологическая оценка химического производства
Анализ и технологическая оценка химического производства
План
1. Технология производства соляной кислоты
2. Производство азотной кислоты
3. Производство серной кислоты
4. Производство полимеров
5. Производство химических волокон
6. Производство пластмасс
7. Синтезы на основе ацетилена
8. Подготовка угля к коксованию
9. Получение синтезированного газа
1. Технология производства соляной кислоты
Соляная кислота—бесцветная жидкость, представляющая собой раствор хлористого водорода в воде. Она энергично растворяет многие металлы и их окислы. В технике применяется как соляная кислота, так и хлористый водород.
Хлористый водород используют для производства хлорорганических продуктов путем гидрохлорировании органических соединений, например этилена , ацетилена.
 (Соляную кислоту применяют для получения хлоридов Zn, Ba. Mg, Са, Fe, A1 и т. д., для травления при пайке и лужении, и цветной металлургии (извлечение Pt, An), при гидролизе древесины, в производетве красителей, для гидрохлорировании органических соединении и т. д.
(Соляную кислоту применяют для получения хлоридов Zn, Ba. Mg, Са, Fe, A1 и т. д., для травления при пайке и лужении, и цветной металлургии (извлечение Pt, An), при гидролизе древесины, в производетве красителей, для гидрохлорировании органических соединении и т. д.
Процесс получения соляной кислоты имеет две стадии;
1) получение хлористого водорода;
2) абсорбция xлористого водорода водой.
Существуют два способа получения хлористого водорода: сульфатной и синтетический. Кроме того, в производстве; соляной кислоты используют хлористый водород, являющийся отходом при хлорировании насыщенных углеводородов
Сульфатный способ получения хлористого водорода основан на взаимодействии твердой поваренной соли с серной кислотой
2NaCl + H2SO4 = Na2SO4 + 2НС1 — Q.
Процесс синтеза проводят в муфельных печах при температуре 500—550° С, обогреваемых через стенку топочными газами. Концентрация хлористого водорода н газе от 30 до 50% НС1. Способ находит применение,но новых производств не организуют.
При синтетическом способе синтез хлористого водорода проводится по реакции
Н2 + С12—» 2НС1 + 184,33 кдж
Cyxoй хлор и водород при нормальных условиях и в темноте не реагируют между собой, но на свету или при нагревании в присутствии паров воды реакция взаимодействия их сопровождается взрывом.
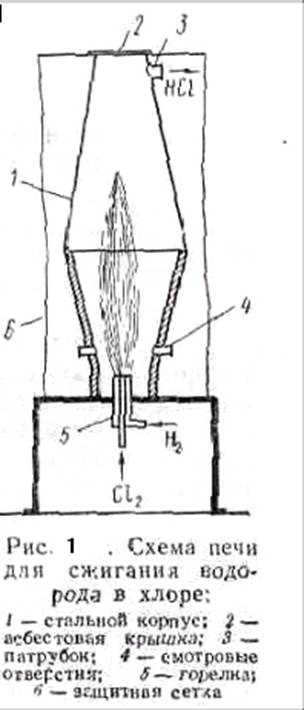
Синтез проводят при избытке 5—10% водорода и высокой температуре в печи, корпус которой изготовляют из углеродистой или легированной стали, а крышку из асбеста. Нижняя часть печи (рис.1) выложена огнеупорным материалом. В ней помещена горелка, состоящая из двух концентрически расположенных стальных трубок. По наружной трубке в печь подается водород, а по внутренней — хлор. Которые на выходе из горелки смешиваются и спокойно реагируют; образуя факел горения с температурой 2000—2400° С.
Абсорбция хлористого водорода в воде идет с выделением большого количества тепла (образование гидратов), которого достаточно для нагревания кислоты до кипения. Для получения более концентрированной соляной кислоты необходим отвод тепла, так как растворимость хлористого водорода в воде с повышением температуры уменьшается.
Поглощение НС1 проводят в абсорберах с отводом тепла. Через стенку (изотермическая абсорбция) или с отводом тепла в результате испарения части воды (адиабатическая абсорбция).
Соляная кислота выпускается следующих сортов: техническая (27,5% НС1); синтетическая (31% НС1), ингибиторная (20% НС1) и реактивная (35—38% НС1, плотность при 20°С равняется 1,17— 1,19 г/см3).
Кислоту перевозят и хранят в гуммироваявых стальных цистернах и контейнерах, в фаолитовых баках и контейнерах и в емкостях, изготовленных из керамики и стекла При введении в кислоту 1—3% ингибитора активность НС1 к стали снижается в 150—200 раз, поэтому ингибиторную кислоту перевозят в стальных нефутерованных цистернах.
2.Производство азотной кислоты
Безводная азотная кислота HNO3—тяжелая бесцветная жидкость плотностью 1520 кг/м3 (при 15° С). Она замерзает при температуре —47° С и кипит при 85°С, При кипении HNO3 частично разлагается с выделением двуокиси азота. С водой HNO3 смешивается в любых соотношениях, выделяя тепло, а с двуокисью азота образует нитроолеум.
Концентрированная кислота не реагирует с алюминием, хромом и даже железом, поэтому аппаратуру для получения азотной кислоты готовят из xpoмоникелевых сталей, алюминия или из стали, футерованной кислотоупорной керамикой.
Получение слабой азотной кислоты имеет две стадии;
а) окисление аммиака до окиси азота N0;
б) переработка N0 в азотную кислоту.
Окисление аммиака проводятся при температуре 800—900°С в присутствии катализатора, изготовленного из сплава платины н родия (5—10%) в виде сеток, сплетённых из тонкой проволоки. Кроме платины, могут применяться менее активные катализаторы на основе окиси кобальта или железа с активирующими добавками. Аммиак может окисляться при 900°С и безкатализатора, но в этом случае получаетсяне окись азота, а азот:
4NH3 + 3О2 =2N3 + 6Н20 + Q.
Катализаторы очень чувствительны к примесям сероводорода, пыли и т, д., поэтому воздух перед смешением с аммиаком тщательно очищается. На рис. 2 показана схема контактного аппарата для окисления аммиака под атмосферным давлением. Аппарат имеет корпус цилиндрической формы в ней закреплены платино-радиовые сотки (3—4 шт.) и поролитовые трубки (из пористой керамики) для очистки воздушко-амиачной смеси от пыли. Для получения окиси азота в контактный аппарат подают смесь, содержащую 10—11%. Повышать содержание амиака нельзя, так как при 20° С смесь с содержанием 15—28% NH3 становится взрывоопасной. При прохождении cmcеcи через платиновые сетки аммиак окисляется с образованием N0. Степень окисления аммиака составляет 98%.
Контактные аппараты, работающие под давлением 1,5—10 am (9,81•104 н/м2), мало отличаются от описанных выше, но в них имеется 16—20 сеток и аппаратура более толстостенная.
Переработка окиси азота в разбавленную азотную кислоту осуществляется следующим образом. Выходящие из контактного аппарата нитрозные газы охлаждаются, и окись азота N0 окисляется самопроизвольно кислородом:
2NO +О2 - > 2NO2 + Q.
Окисление NO в NO2 происходит очень медленно. Для увеличения скорости окисления необходимо понижать температуру (реакция аномальная, скорость растет при снижении температуры в отличие от других реакции) и испытать дарение (при увеличении давления с 1 до 10 am скорость возрастает в 100U раз). Поэтому окисление N0 в N02 и абсорбцию NO2 часто происходит в установках, работающих под давлением 1,5—10 am (0,15—1 Мн/м2), что резко сокращает объемы окислительно-абсорбционных башен.
Абсорбция двуокиси азота осуществляетсяводой по суммарному уравнению
3NO2+ Н2О - > 2НNО3 + NO + Q.
Нитрит натрия затем окисляется до нитрата натрия.
На рис. 3 показана принципиальная схема получения азотной кислоты при атмосферном давлении. Воздух и аммиак после очистки от примесей подаются в смеситель1, а затем в контактный аппарат 2. Для окисления амиака. Образовавшиеся нитрозные газы при температуре 800°С выходят из аппарата и, пройдя котел-утилизатор 3, oхлаждаются до 250°С и поступают в кожухотрубный холодильник4, где дополнительно охлаждаются до 30° С, В холодильнике начитаются окисление N0 до NO2 и конденсация пapoв, воды, при этом частично образуется HNO3
Из холодильника нитрозные газы направляются в абсорбционные насадочные башни 5, в которых окислы азота поглощаются водой; таких башен в системе б—8 шт. Прейдя последовательно через эти башни, газы поступают в окислительную башню б, где оставшаяся часть N0 окисляется в NO2 и затем а башни щелочной абсорбции 7. Для поглощения N0 последняя башня орошается водой. Образовавшаяся слабая кислота охлаждается в холодильниках 8 и с помощью насосов 9 проходит последовательно противотоком газу все поглотительные башни. Кислота (50% HNO3) выводится из первой по ходу газа башни. Степень переработки окислов азота в азотную кислоту составляет 92%, а остальные окислы азота улавливаются в башнях щелочной абсорбции.