Барий
Страница 2
СОЕДИНЕНИЯ (ОБЩИЕ СВОЙСТВА)
Известны многочисленные соединения, в которых барий присутствует в виде двухвалентного катиона. Ион Ва2+ бесцветен, имеет устойчивую восьмиэлектронную конфигурацию. Радиус иона 1,34 А. Он обладает относительно большим объемом и слабо выраженной тенденцией к поляризации, поэтому не образует устойчивых комплексных соединений. Гидроокись Ba(OH)g представляет собой сильное основание.
Неорганические соединения
Гидрид бария, ВаН2, получают нагреванием металлического бария, сплавов кадмий — барий, ртуть — барий или окиси бария в атмосфере водорода:
Ва + Н2 = ВаН2 + 55 ккал Ва0+ 2Н2 = BaH2 + Н2О
BaH2 — серовато-белые кристаллы с плотностью 4,21 г/см3. Выше 675° они подвергаются термической диссоциации. Гидрид бария разлагает воду и взаимодействует с азотом, соляной кислотой и аммиаком:
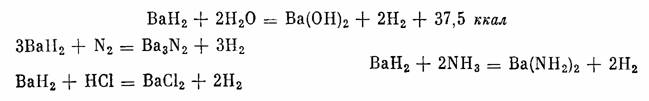
Гидрид бария применяют в качестве катализатора реакций гидрогенизации.
Окись бария, ВаО, получают непосредственным синтезом из элементов. Кроме того, используют термическое разложение гидроокиси, перекиси, карбоната или нитрата бария. Применяют также прокаливание смеси карбоната бария с углем, сульфата бария с односернистым железом или нагревание сульфида бария с окисью магния и водой:

ВаО представляет собой кубические (решетка типа NaCI) или гексагональные бесцветные кристаллы (или белый аморфный порошок), очень гигроскопичные, с плотностью 5,72 г/см3 (для кубической модификации) и 5,32 г/см3 (для гексагональной) и твердостью 3,3 по шкале Mooca; т. пл. 1923°, т. кип. 2000°. Ва0 люминесцирует под действием ультрафиолетовых лучей и фосфоресцирует в рентгеновских лучах.
Растворяясь в воде, окись бария дает гидроокись бария Ba(OH)2. В отличие от окислов кальция и стронция окись бария при температуре 500° в заметных количествах поглощает двуокись углерода. На холоду окись бария взаимодействует с хлором, а при нагревании — с кислородом, серой, азотом, углеродом, двуокисью серы, сероуглеродом, двуокисью кремния, двуокисью свинца, окисью железа, хрома, а также с солями аммония:

При нагревании окись бария восстанавливается магнием, цинком, алюминием, кремнием и цианидами щелочных металлов.
Окись бария применяют для изготовления стекла, эмалей и термо' катализаторов. В результате замещения в цементе окиси кальция окисью бария получают цементы с исключительной устойчивостью по отношению к воде, содержащей сульфат-ионы.
Перекись бария, ВаО2, получают, сильно прокаливая гидроокись, нитрат или карбонат бария в токе воздуха в присутствии следов воды. Другие способы получения: непосредственный синтез из элементов при нагревании, прокаливание окиси бария с окисью меди, нагревание окиси бария с хлоратом калия, нагревание окиси бария до 350°, дегидратация кристаллогидрата
BaO2*8H2O при 120°:
Ва + 02 = Ва02 + 145,7 ккал Ba0 + СиО = Ва02 + Сu
Ba0 +1/2 02 = Ва02 + 12,1 ккал 3ВаО + КclO3 = ЗВа02 + КСl
Ba02 представляет собой белый парамагнитный порошок с плотностью 4,96 г1см3 и т. пл. 450°. Он разлагается до Ba0 (600°) или до кислорода (795°), устойчив при обычной температуре (может храниться годами), плохо растворяется в воде, спирте и эфире, растворяется в разбавленных кислотах:

Термическое разложение перекиси бария ускоряют окислы - СеО, Cr2O3,
Fe2 O3 и Cu0.
Известны кристаллогидраты BaO2*8H2O и BaO2H2O. Октагид-рат Ba02•H2O получают действием перекиси водорода на баритовую поду в слабощелочных растворах, а также обработкой на холоду раствора хлорида пли гидроокиси бария перекисью натрия:
Ва(ОН)2 + H2O2 + 6H2O = Ва02*8Н2О
BaO2*8H2O выделяется в виде бесцветных гексагональных кристаллов, трудно растворимых в воде, спирте, эфире. Нагретое с перекисью водорода это соединение превращается в желтое вещество — надперекнсь бария ВаО^.
Перекись бария реагирует при нагревании с водородол1, серой, углеродом, аммиаком, солями аммония, феррицианидом калия и т. д.

С концентрированной соляной кислотой перекись бария реагирует, выделяя хлор:
ВаO2 + 4НС1конц. = BaCl2 + Cl2 + 2H2O
Перекись бария восстанавливает соли благородных металлов (обладающие малой химической активностью) до соответствующего металла. Перекись бария применяют для получения перекиси водорода, в зажигательных бомбах, а также в качестве катализатора крекинг-процесса.
BaO2•H2O2 представляет собой желтые моноклинные микрокристаллы, устойчивые при 0°, трудно растворимые в обычных растворителях.
Гидроокись бария, Ва(ОН)2, получают действием воды на металлический барий или ВаО. Используют также обработку растворов солей бария (особенно нитрата) щелочами. В промышленности применяют действие перегретого пара на сульфид бария. С этой же целью можно нагреть до 175" (под давлением) метаспликат бария BaSiOs с раствором NaOH. Описан метод, основанный на восстановлении перекиси бария при 550°:

Ba(OH)2— белый порошок с плотностью 4,495 г/см3 и т. пл. 408°. В катодных лучах гидроокись бария фосфоресцирует желто-оранжевым цветом. Растворяется в воде, трудно растворима в ацетоне и метплацетате.
При растворении Ва(ОН)2 в воде получается бесцветный раствор с сильно щелочной реакцией — баритовая вода, которая в присутствии двуокиси углерода быстро покрывается поверхностной пленкой карбоната бария.
Известны кристаллогидраты Ва(ОН)2*8Н2О, Ва(ОН)2*7H2O, Ва(ОН) •2Н2O и Ва(ОН)2*H2O. Кристаллогидрат Ва(ОН)2*8H2O выделяется в виде бесцветных моноклинных призм с плотностью 2,18 г/cм3 и т. пл. 78°. При нагревании до 650° в токе воздуха кристаллогидрат превращается в окись или перекись бария.
Пропускание хлора через баритовую воду сопровождается образованием хлорида, хлората и очень незначительных количеств гино-хлорита бария:
6Ва(ОН)2 + 6CL2 = 5BaCl2 + Ва(ClO3)2 + 6H2О
Баритовая вода реагирует при 100° с сероуглеродом:
2Ва(ОН)2 + CS2 = ВаСО3 + Ba(HS)2 + H2O
Металлический алюминий взаимодействует с баритовой водой с образованием гидроксоалюмината бария и водорода:
2Аl + Ва(ОН)2 + 10H2O = Ba[Al(OH)4(H2O)2]2+3H2
Выше 1000° гидроокись бария подвергается термической диссоциации:
Ва(ОН)2 → ВаО + Н2O
Баритовая вода Ва(ОН)2 применяется в качестве очень чувствительного химического реактива на двуокись углерода.
Фторид бария, BaF2, получают непосредственным синтезом из элементов, действием фтористого водорода на окись, гидроокись, карбонат или хлорид бария, обработкой баритовой воды фтористо-водородной кислотой, обработкой нитрата или хлорида бария фто-ридом натрия или калия, а также сплавленном хлорида магния с фторидом кальция или магния в атмосфере CO2 и термическим разложением гексафторосиликата бария в атмосфере инертного газа:
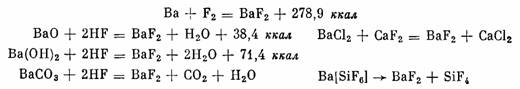
Бесцветные кубические кристаллы BaF2 имеют решетку типа CaF2 с расстоянием между центром иона Ва2+ и иона Fֿ 2,68 А. Плотность 4,83 г/см3, т.пл. 1280°, т. кип. 2137°. Кристаллы мало растворимы в воде (1,63 г/л при 18°), растворяются в фтористоводо-родной, соляной и азотной кислотах. Применяются для изготовления эмалей и оптических стекол. Температура плавления смеси BaF2*LiF 850°, а смеси BaF2*BaCl2 1010°.