Белки в медицине
Белки в медицине
Оглавление
1. Введение стр. 2
2. Структура стр. 4
3. Свойства стр. 6
4. Роль в организме стр. 7
5. Применение в медицине стр. 13
6. Литература стр. 14
белки
ЕЛКИ — это азотсодержащие высокомолекулярные органические вещества со сложным составом и строением молекул.
Белок можно рассматривать как сложный полимер аминокислот.
Белки входят в состав всех живых организмов, но особо важную роль они играют в животных организмах, которые состоят из тех или иных форм белков (мышцы, покровные ткани, внутренние органы, хрящи, кровь).
Растения синтезируют белки (и их составные части a-аминокислоты) из углекислого газа СО2 и воды Н2О за счет фотосинтеза, усваивая остальные элементы белков (азот N, фосфор Р, серу S, железо Fe, магний Mg) из растворимых солей, находящихся в почве.
Животные организмы в основном получают готовые аминокислоты с пищей и на их базе строят белки своей организма. Ряд аминокислот (заменимые аминокислоты) могут синтезироваться непосредственно животными организмами.
Характерной особенностью белков является их многообразие, связанное с количеством, свойствами и способах соединения входящих в их молекулу аминокислот. Белки выполняют функцию биокатализаторов — ферментов, регулирующих скорость и направление химических реакций в организме. В комплексе с нуклеиновыми кислотами обеспечивают функции роста и передачи наследственных признаков, являются структурной основой мышц и осуществляют мышечное сокращение.
В молекулах белков содержатся повторяющиеся амидные связи С(0)—NH, названные пептидными (теория русского биохимика А.Я.Данилевского).
Таким образом, белок представляет собой полипептид, содержащий сотни или тысячи аминокислотных звеньев.
Структура белков |
Первичная структура белков | | 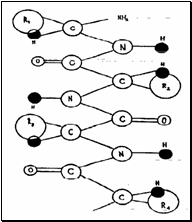 |
собый характер белка каждого вида связан не только с длиной, составом и строением входящих в его молекулу полипептидных цепей, но и с тем, как эти цепи ориентируются.
В структуре любого белка существует несколько степеней организации:
1. Первичная структура белка — специфическая последовательность аминокислот в полипептидной цепи.
1.
|
Вторичная структура белков | |
Вторичная структура белка — способ скручивания полипептидной цепи в пространстве (за счет водородной связи между водородом амидной группы —NH— и карбонильной группы — СО—, которые разделены четырьмя аминокислотными фрагментами).
2.
|
Третичная структура белков | |
Третичная структура белка — реальная трехмерная конфигурация закрученной спирали полипептидной цепи в пространстве (спираль, скрученная в спираль). Третичная структура белка обуславливает специфическую биологическую активность белковой молекулы. Третичная структура белка поддерживается за счет взаимодействия различных функциональных групп полипептидной цепи:
· дисульфидный мостик (-S-S-) между атомами серы,
· сложноэфирный мостик – между карбоксильной группой (-СО-) и гидроксильной (-ОН),
· солевой мостик - между карбоксильной (-СО-) и аминогруппами (NH2).
4. Четвертичная структура белка — тип взаимодействия между несколькими полипептидными цепями.
|
Четвертичная структура белков | |
Например, гемоглобин представляет из себя комплекс из четырех макромолекул белка.
Физические свойства
елки имеют большую молекулярную массу ( 104—107), многие белки растворимы в воде, но образуют, как правило, коллоидные растворы, из которых выпадают при увеличении концентрации неорганических солей, добавлении солей тяжелых металлов, органических растворителей или при нагревании (денатурация).
Химические свойства
1. Денатурация — разрушение вторичной и третичной структуры белка.
2. Качественные реакции на белок:
n биуретовая реакция: фиолетовое окрашивание при обработке солями меди в щелочной среде (дают все белки),
n ксантопротеиновая реакция: желтое окрашивание при действии концентрированной азотной кислоты, переходящее в оранжевое под действием аммиака (дают не все белки),
n выпадение черного осадка (содержащего серу) при добавлении ацетата свинца (II), гидроксида натрия и нагревании.
3. Гидролиз белков — при нагревании в щелочном или кислом растворе с образованием аминокислот.
Синтез белков
Белок — сложная молекула, и синтез его представляется трудной задачей. В настоящее время разработано много методов прекращения [ГМВ1] a-аминокислот в пептиды и синтезированы простейшие природные белки — инсулин, рибонуклеаза и др.
Большая заслуга в создании микробиологической промышленности по производству искусственных пищевых продуктов принадлежит советскому ученому А.Н.Несмеянову.
Роль белков в организме.
Функции белков в организме разнообразны. Они в значительной мере обусловлены сложностью и разнообразием форм и состава самих белков.
Белки - незаменимый строительный материал. Одной из важнейших функций белковых молекул является пластическая. Все клеточные мембраны содержат белок, роль которого здесь разнообразна. Количество белка в мембранах составляет более половины массы.
Многие белки обладают сократительной функцией. Это прежде всего белки актин и миозин, входящие в мышечные волокна высших организмов. Мышечные волокна - миофибриллы - представляют собой длинные тонкие нити, состоящие из параллельных более тонких мышечных нитей, окруженных внутриклеточной жидкостью. В ней растворены аденозинтрифосфорная кислота (АТФ), необходимая для осуществления сокращения, гликоген - питательное вещество, неорганические соли и многие другие вещества, в частности кальций.
Велика роль белков в транспорте веществ в организме. Имея различные функциональные группы и сложное строение макромолекулы, белки связывают и переносят с током крови многие соединения. Это прежде всего гемоглобин, переносящий кислород из легких к клеткам. В мышцах эту функцию берет на себя еще один транспортный белок - миоглобин.