Актинобациллезная (гемофилезная)
Страница 5
Исследования экспериментально заражённых морских свинок (интраназальная инокуляция) показало, что изменения в лёгких в виде очаговой гиперемии в зоне ветвлений крупных и средних бронхов развиваются уже через час после инокуляции культуры. Возбудитель на это стадии реизолировали из лёгочной ткани, бронхов, трахеи. Через три часа в лёгких развивались типичные изменения. На этой стадии в 25% случаев культуры возбудителя реизолировали из крови и паренхиматозных органов. По истечении 6 часов изменения в лёгких получили полное развитие. Таким образом, бактериемия и диссеминация возбудителя происходит на фоне уже имеющихся изменений в лёгких.
Наблюдение за экспериментально заражёнными больными свиньями в условиях неблагополучного хозяйства позволяют выделить три варианта течения болезни: сверхострое, острое и подострое. При сверхостром течении на фоне жёсткого респираторного синдрома летальный исход наступает в течении 6-24 часов. В грудной полости, где расположены поражённые доли лёгкого, обнаруживали 150-300см3 красноватой жидкости, изменённая доля лёгкого увеличена в объёме, ткань на разрезе тёмно-красного цвета, интерлобулярные септы отёчны, консистенция поражённой ткани плотная, с разреза стекает красноватая жидкость, бронхи и трахея заполнены аналогичной пенистой жидкостью. Отложения фибрина на пульмональной и костальной плевре отсутствуют.
У животных с острым течением болезни отмечен прогрессирующий респираторный синдром с повышением температуры до 40,6—41°C, завершающийся летальным исходом в течении 6—7 суток. У павших свиней в грудной полости находили до 200 см3 красноватой жидкости с хлопьями фибрина. Поражённые лёгкие тёмно-красные, плотные, ломкие, с выраженным отёком междольковой соединительной ткани. Костальная и лёгочная плевра покрыты плёнками фибрина.
У свиней с подострым течением регистрировали симптомы пневмонии, лихорадку ремитирующего типа, плохую поедаемость корма. Поражённые доли лёгких увеличены, бугристые, плотные, неравномерно окрашены: участки тёмно-красного, серо-коричневого, грязно-бурого цвета. Через 15-20 дней в лёгочной ткани обнаруживали очаги уплотнения, окружённые соединительной тканью. Отложения фибрина на лёгочной и костальной плевре пронизаны соединительной тканью.
Гистологические изменения в лёгких на начальной стадии болезни могут быть охарактеризованы как бактериальный токсический шок (Гистологические исследования проведены д.в.н. Шубиным В.А.) Типичным для органопатологии бактериального шока считается парез и стаз артериол, мелких артерий, набухание и фибриноидный некроз стенок. Присоединение внутрисосудистого свёртывания крови придаёт шоку необратимый характер и приводит культур возникновению некрозов ткани. Дальнейшие изменения развиваются на указанном фоне. На 2-3 сутки начинается инфильтрация поражённых тканей мононуклеарными клетками, в основном лимфоцитами, при отсутствии или малом количестве нейтрофилов, эти клетки формируют своеобразный демаркационный вал. Позднее в поражённых тканях развиваются некротические очаги, подвергающиеся инкапсуляции. В зависимости от течения болезни и сроков гибели животного обнаруживается та или иная стадия патологического процесса.
Подтверждением вывода о ведущей роли токсинов в патогенезе актинобациллёзной плевропневмонии являются следующие результаты наших исследований. Установлено, сто в периодической аэрируемой культуре возбудитель в первые три часа культивирования синтезирует термолабильные, чувствительные к трипсину гемолизин и экзотоксин. Динамика их накопления и инактивации в культуральной жидкости, содержащей гемолизин и экзотоксин, вызывает у морских свинок в лёгких изменения типичные для актинобациллёзной пневмонии. По нашему мнению, 6-8- часовые агаровые и 3- часовые бульонные аэрируемые культуры в физиологическом отношении близки, поскольку находятся в начальной стадии логарифмического роста. Поэтому мы считаем, что на первом этапе развития изменений в лёгких определяющую роль играют гемолизин и экзотоксин. По нашему мнению, 6-8- часовые агаровые культуры возбудителя содержат не некоторое количество в связанном виде гемолизина и экзотоксина, что определяет большую вирулентность молодых культур.
2.1.4. Патогенные свойства H.parasuis.
Исследовали чувствительность в возбудителю морских свинок, белых мышей, поросят-отъёмышей.
ЛД50 культуры H.parasuis штамм №1 для морских свинок при интраназальном заражении составила 354 млн.м.к., внутрибрюшинном - 594 млн.м.к., подкожном - 1,414 млд.м.к При всех способах заражения с различной частотой обнаруживали развитие серозно-фибринозного плеврита, перитонита, реже перикардита. После интраназальной инокуляции у 100% животных отмечали развитие катаральной пневмонии. У павших животных культуры возбудителя наиболее часто выделяли из поражённых серозных оболочек и реже - из паренхиматозных органов.
ЛД50 культуры H.parasuis при внутрибрюшинном введении штамма серовара С составила 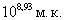 ,
, 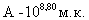 ,
, 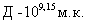 ,
, 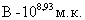 . Белые мыши, как и морские свинки были более чувствительны к внутрибрюшинному (ЛД50=1,414 млрд.м.к.) и интраназальному (ЛД50=1,549 млрд.м.к.) способам заражения при устойчивости к подкожному введению культуры. Патологоанатомические изменения у мышей и морских свинок были однотипны.
. Белые мыши, как и морские свинки были более чувствительны к внутрибрюшинному (ЛД50=1,414 млрд.м.к.) и интраназальному (ЛД50=1,549 млрд.м.к.) способам заражения при устойчивости к подкожному введению культуры. Патологоанатомические изменения у мышей и морских свинок были однотипны.
С нашей точки зрения, морских свинок можно рассматривать как наиболее удобную модель для биопробы и изучения пато - и иммуногенеза инфекции, вызываемой H.parasuis.
В опытах на поросятах-отъёмышах показано, что гемофилёзный полисерозит может быть воспроизведён при интраназальном, трахеальном, внутрибрюшинным и внутривенном введении культуры H.parasuis. Учитывая экологию возбудителя, можно констатировать, что естественными входными воротами инфекции являются дыхательные пути. При трахеальном заражении первые клинические симптомы в виде угнетения и повышения температуры тела отмечаются через 6-8 часов, позднее (20-24 часа) у абсолютного большинства животных развивается катаральная пневмония. В 75% случаев уже на этой стадии развивается серозно-фибринозный плеврит и в 50% случаев - перитонит, что свидетельствует о высоких инвазивных свойствах возбудителя. У животных, убитых через 24 часа после заражения, на фоне описанных патологоанатомических изменений культуры возбудителя были выделены в 100% случаев из лёгких и бронхиальных лимфатических узлов и в 25% случаев - из крови. В более поздние сроки существенных изменений в характере патологоанатомических изменений не наступало, за исключением резорбции экссудата из полостей и появления у отдельных животных симптомов поражения суставов конечностей и головного мозга. Гистологические исследования (выполнены д.в.н., профессором Шубиным В.А.) позволяют охарактеризовать изменения у экспериментально заражённых и естественно больных свиней как септико-токсический процесс с поражением серозных покровов, паренхиматозных органов, лимфатических узлов и центральной нервной системы.
Исследования показали, что типичные патоморфологические изменения могут вызвать как капсулообразующие, так и бескапсульные формы возбудителя при большей вирулентности первых.
По нашим данным изменения в лёгких, плевре, перикарде и перитонеуме ассоциируются с локализацией в них возбудителя. Частота изоляции культур H.parasuis из тканей и органов зависит от характера болезни и давности процесса. При остром течении в результате экспериментального (трахеального) заражения через 48-72 часа из лёгких культуры возбудителя выделили в 100% случаев, плевры - 75%, перитонеума и перикарда -25%, бронхиальных лимфатических узлов - 100%, селезёнки - 50%, крови - 25% случаев. При бактериологическом исследовании поросят, павших с картиной острого полисерозита, в естественных условиях культуры возбудителя выделили из лёгких у 42,85%, перикарда - 92,2%, плевры - 71,42%, печени - 57,14%, селезёнки - 66,66% животных. В более отдалённые сроки после экспериментального заражения и от животных, павших в естественных условиях с картиной подострого полисерозита, возбудитель выделяли реже и преимущественно из плевры, лёгких, перикарда, перитонеума и средостенных лимфоузлов.