Секвенирование (Генная инженерия)
Секвенирование (Генная инженерия)
ОГЛАВЛЕНИЕ
Введение …………………………………………………………………………………………3
1. Определение нуклеотидной последовательности модифицированным методом Максама и Гилберта ……………………………………………………………………………………….4
2. Секвенирование ДНК методом полимеразного копирования ( метод Сэнгера) …………8
3. Филогенетический анализ геномов вирусов ………………………………………………15
4. Компьютерный анализ генетических текстов …………………………………………… 18
Заключение …………………………………………………………………………………… 22
Список литературы …………………………………………………………………………….23
ВВЕДЕНИЕ.
Разработка методов клонирования и определения последовательности оснований (секвенирования) нуклеиновых кислот положила начало новому этапу развития молекулярной биологии. Знание первичной структуры участков генома, выполняющих определенные функции, дало возможность эффективно применить для их исследования целый арсенал новых методов генной инженерии. Эти методы (направленный мутагенез, рекомбинация in vitro и др.) позволяют модифицировать участки нуклеотидных последовательностей и исследовать их функции на молекулярном уровне. С их помощью комбинируются участки генетического материала и создаются геномы с совершенно новыми функциями.
Секвенирование нуклеиновых кислот в настоящее время стало рутинным методом молекулярной биологии. Несомненно, в ближайшем будущем появятся еще более совершенные автоматические секвенаторы, что приведет к резкому увеличению числа расшифрованных последовательностей.
Благодаря знанию генетического кода появилась возможность определять участки нуклеотидных последовательностей, кодирующих потенциальные белки. Этот источник и сегодня дает нам основную информацию о функциональном строении нуклеотидной последовательности.
1. ОПРЕДЕЛЕНИЕ НУКЛЕОТИДНОЙ ПОСЛЕДОВАТЕЛЬНОСТИ МОДИФИЦИРОВАННЫМ МЕТОДОМ МАКСАМА И ГИЛБЕРТА.
Быстрый прогресс, наблюдавшийся в последние годы в различных областях молекулярной биологии, во многом обусловлен появлением эффективного метода определения первичной структуры ДНК. Этот метод, предложенный в 1977 г. Максамом и Гилбертом, основан на селективной химической модификации различных типов гетероциклических оснований в составе ДНК с последующим расщеплением межнуклеотидных связей в модифицированных звеньях. Реакции селективной модификации по каждому типу гетероциклических оснований проводятся таким образом, чтобы в каждой молекуле ДНК в среднем модифицировалось только одно звено данного типа. Поскольку все звенья данного типа в составе молекулы эквивалентны и реагируют с модифицирующим агентом с одинаковыми скоростями, то в сумме каждое звено этого типа окажется частично модифицированным. Дальнейшая обработка ДНК вторичным амином или щелочью приводит к отщеплению модифицированных гетероциклических оснований от цепи ДНК и разрыву полинуклеотидной цепи в местах отщепления гетероциклов (рис. 1).
Модификации подвергают ДНК, 32Р-меченные по 5'-концевому нуклеотидному звену. Радиоактивная метка вводится фосфорилированием с помощью 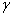 -32Р-АТР и Т4-полинуклеотидкиназы. Таким образом, в результате химической деградации получается набор фрагментов ДНК различной длины. Длины этих фрагментов соответствуют положению мономерных звеньев того типа, который подвергался модификации. Концевая радиоактивная метка служит точкой отсчета при определении длины продуктов химической деградации ДНК (рис. 2)
-32Р-АТР и Т4-полинуклеотидкиназы. Таким образом, в результате химической деградации получается набор фрагментов ДНК различной длины. Длины этих фрагментов соответствуют положению мономерных звеньев того типа, который подвергался модификации. Концевая радиоактивная метка служит точкой отсчета при определении длины продуктов химической деградации ДНК (рис. 2)
Набор полученных фрагментов фракционируется электрофорезом в ПААГ, который позволяет разделять олиго (поли) нуклеотиды, отличающиеся по длине всего на одно мономерное звено. Последовательность нуклеотидов в ДНК читается непосредственно с радиоавтографа геля.
Метод Максама и Гилберта, разработанный для анализа первичной структуры достаточно длинных ДНК, применим и для коротких (8 – 16 звенных) оли-годезоксирибонуклеотидов. Однако в этом случае реакции химической модификации проводят в более жестких условиях (увеличивая время и температуру реакции) с целью повышения степени модификации.
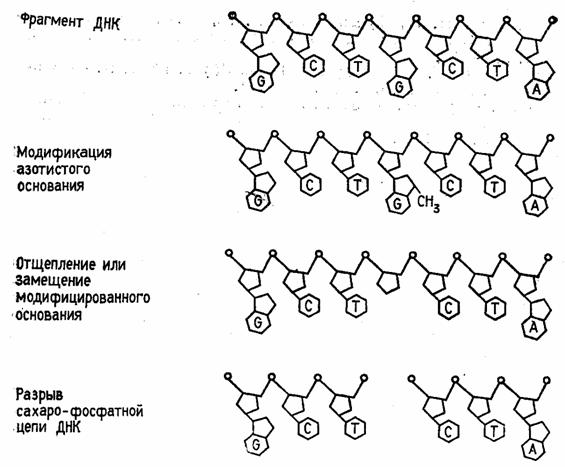
Рисунок 1.1 Отщепление модифицированных звеньев от цепи ДНК после обработки вторичным амином или щелочью.
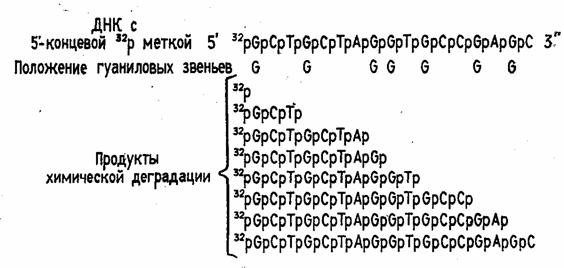
Рисунок 2 Химическая деградация ДНК.
Набор реакций, применяемых для расщепления ДНК по мономерным звеньям определенного типа достаточно велик и постоянно пополняется: по остаткам гуанина – обработка диметилсульфатом (рис. 3); по остаткам аденина и гуанина – апуринизация 50%-ной муравьиной кислотой (по Бартону); по остаткам аденина и цитозина – расщепление гетероциклических оснований под действием 1,2 н. гидроксида натрия и по остаткам тимидина и цитозина – обработка гидразином (рис. 4).
В настоящее время широко используются два основных варианта секвенирования по Максаму — Гилберту. В первом из них реакции химической модификации ДНК проводят в растворе, а во втором ДНК предварительно иммобилизуют на твердой фазе (например, ДЭАЭ-целлюлозе). Первый метод более традиционен, его многочисленные модификации с успехом использовались для секвенирования фрагментов ДНК различных размеров, в том числе олигонуклеотидов. В то же время второй метод имеет ряд преимуществ. Он менее трудоемок и занимает меньше времени, проще в освоении, позволяет обойтись минимальным набором оборудования. В целом оба метода обеспечивают получение вполне приемлемых результатов, а выбор одного из них определяется конкретными условиями лаборатории.
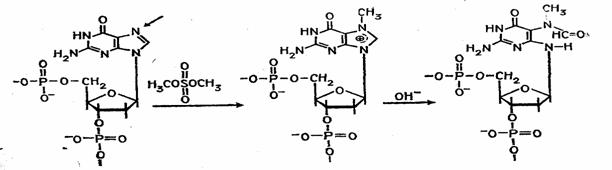
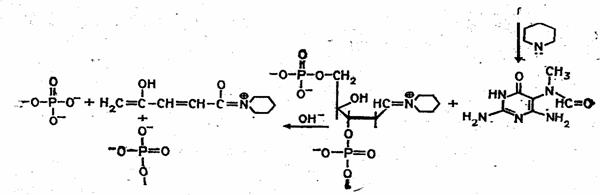
Рисунок 3 Реакция селективного расщепления по остаткам гуанина
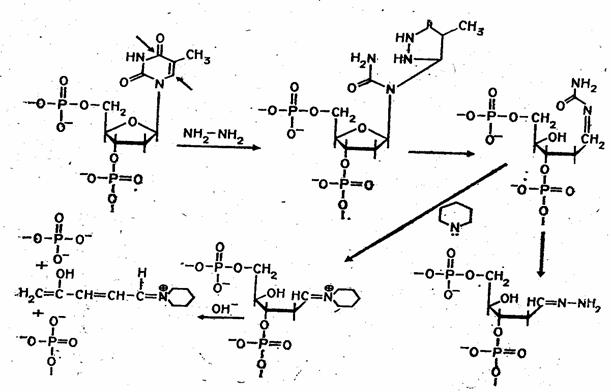
Рисунок 4 Реакция селективного расщепления по остаткам тимидина и цитозина.
2. СЕКВЕНИРОВАНИЕ ДНК МЕТОДОМ ПОЛИМЕРАЗНОГО КОПИРОВАНИЯ.
(МЕТОД СЭНГЕРА)
Ферментативный синтез олиго(поли)дезоксирибонуклеотидов с помощью ДНК-полимераз, заключающийся в копировании матричного полинуклеотида нашел блестящее применение в качестве одного из двух наиболее эффективных методов установления первичной структуры ДНК. Метод состоит в получении блоков-копий полидезоксирибонуклеотида, структура которого изучается. При этом обязательным является выполнение двух условий. Во-первых, копирование должно проводиться, начиная с определенного мономерного звена. Во-вторых, синтез копий следует осуществлять четыре раза, каждый раз останавливая его поочередно на каком-либо одном из четырех мономёрных звеньев (A, G, С или Т), иначе говоря, стремятся получить полный набор "комплементационно отраженных" копий исследуемого полинуклеотида, образование которых прекратилось в каждом из мест расположения одного из четырех мономерных звеньев нуклеиновой кислоты. Определение длины каждой копии позволяет установить положение данного мономерного звена в цепи исследуемого полинуклеотида. Длина копии определяется фракционированием в полиакриламидном геле. Этот метод, таким образом, так же как и метод, основанный на модификации оснований позволяет получать информацию о положении определенного мономерного звена в цепи полинуклеотида прямо после фракционирования.
Для получения копии исследуемого полинуклеотида в последнем выбирают точку отсчета, что достигается введением в систему ферментативного синтеза в качестве нуклеозидного компонента олигонуклеотида-затравки. Такой олигонуклеотид во всех копиях, образующихся в результате достраивания его ферментативным путем, остается постоянным 5'-концевым фрагментом, т. е. является точкой отсчета. Копирование с помощью ДНК-полимеразы в присутствии всех четырех дезоксирибонуклеозид-5'-пирофосфатов (один из них берется  32Р-меченным) проводят в течение ограниченного времени. Цель этого этапа - проведение статистически ограниченного синтеза для получения всех возможных копий, начиная с затравки, достроенной на одно, два и т. д. звеньев, и включая полную копию изучаемого полинуклеотида. В идеале смесь должна включать все возможные полинуклеотиды (рис. 5), синтез которых статистически прекращается где-то в середине матричного полинуклеотида в районе ATGCTG матричной последовательности. На практике различные компоненты смеси присутствуют в разных количествах. Если такую смесь далее подвергнуть электрофорезу в полиакриламидном геле в определенных условиях, когда скорость движения пропорциональна длине цепи, на электрофореграмме обнаруживается серия полос, представляющих различные олигонуклеотиды. Такое фракционирование обычно не проводят, хотя оно может использоваться для контроля на
32Р-меченным) проводят в течение ограниченного времени. Цель этого этапа - проведение статистически ограниченного синтеза для получения всех возможных копий, начиная с затравки, достроенной на одно, два и т. д. звеньев, и включая полную копию изучаемого полинуклеотида. В идеале смесь должна включать все возможные полинуклеотиды (рис. 5), синтез которых статистически прекращается где-то в середине матричного полинуклеотида в районе ATGCTG матричной последовательности. На практике различные компоненты смеси присутствуют в разных количествах. Если такую смесь далее подвергнуть электрофорезу в полиакриламидном геле в определенных условиях, когда скорость движения пропорциональна длине цепи, на электрофореграмме обнаруживается серия полос, представляющих различные олигонуклеотиды. Такое фракционирование обычно не проводят, хотя оно может использоваться для контроля на