Исследование апоптотической активности лимфоцитов периферической крови in vitro при инфекционном мононуклеозе и мононуклеозоподобном синдроме
Страница 5
Wagner e. a. [1995] показано, что стимуляция апоптоза в EBV-преобразованных лимфоцитах осуществляется Т-лимфоцитами, экспрессирующими BLT-экстеразу. Защиту В-лимфоцитов от апоптотической гибели обеспечивают экспрессируемые ими мембранные белки -LMP1 и BHRF1, кодируемые EBV [Исаева М.П. и соавт.,1998]. Защита осуществляется через регуляцию bcl-2-экспрессии лимфоцитами. Bcl-2 proto-oncogen кодирует внутренние митохондриальные белки, блокирующие запрограммированную гибель клеток, в связи с чем регулирование LMP1 и BHRF1 экспрессии. bcl-2 определяет живое состояние и гибель клетки. LMP1 предотвращает апоптоз, индуцируемый анти-fas-антителами, а BHRF1- анти-Pa8-антителами и TNF-a [Akbar A. N. e. a., 1993].
Исходя из вышеизложенного, можно предположить, что апоптоз при ИМ служит механизмом, регулирующим численное соотношение В- и Т-клеток в популяции лимфоцитов на разных стадиях инфекционного процесса.
ЗАКЛЮЧЕНИЕ.
Таким образом, ИМ- доброкачественное лимфопролиферативное заболевание, достоверным диагностическим критерием которого являются изменения в системе крови. Своеобразным маркером заболевания служат “атипичные мононуклеары”, представляющие собой трансформированные под действием вирусных антигенов лимфоидные клетки. Одним из механизмов ограничения лимфопролиферативности процесса при ИМ является апоптоз, который регулирует численное соотношение В- и Т-клеток в популяции лимфоцитов на разных стадиях инфекционного процесса.
Однако литературные данные, касающиеся апоптотических реакций клеток в норме и при патологическом состоянии, и при ИМ в частности, немногочисленны и фрагментарны, что и послужило причиной настоящего исследования.
Глава 2. МАТЕРИАЛЫ И МЕТОДЫ
2.1. Материал и объект исследования
Нами были обследованы дети, в возрасте от 7 до 14 лет, больные ИМ (инфекцией, вызванной вирусом Эпштейна-Барр) средней степени тяжести, острым и гладким течением и ОИЗ с МПС (цитомегаловирусная инфекция, инфекция, вызванная вирусом герпеса, иерсиниоз, различные формы ангин-фоликулярная, лакунарная, некротическая) в период развернутой клинико-гематологической картины заболевания (1 группа больных), в период реконвалесценции (2 группа больных) и в катамнезе (3 группа больных). Диагноз заболевания устанавливали по характерной клинико-гематологической картине заболевания и лабораторным данным. Диагноз ИМ во всех случаях подтверждали выявлением в сыворотке больных ДНК вируса Эпштейна-Барр методом полимеразной цепной реакции (отдел молекулярной биологии ЦНИЛ СГМУ) и антител к антигену вируса Эпштейна-Барр (Ig A, M, G к вирусному капсидному антигену, Ig G к раннему антигену) с помощью непрямой иммунофлюоресценции (лаборатория онковирусологии НИИ онкологии ТНЦ СО РАМН).
Все дети, больные ИМ находились на лечении в инфекционных отделениях в 3 горбольницы г.Томска и в больницы им. Г.Е.Сибирцева.
Контрольную группу составили условно здоровые дети аналогичного возраста. Материал исследования – периферическая кровь. Забор крови осуществляли из локтевой вены, утром, натощак.
Распределение обследованных детей в зависимости от методов и сроков исследования можно наблюдать в табл. 1.
2.2. Исследование апоптоза лимфоцитов
2.2.1. Индукция апоптоза лимфоцитов in vitro
В пробирку вносили 0,4 мл плазмы гепаринизированной крови( 25 Ед/мл) и 2 мл солевого раствора Дульбекко, не содержащего Ca2+ и Mg2+(‘Sigma’, США). Контролем служила суспензия, состоящая из 0,4 мл плазмы гепаринизированной крови(25 Ед/мл) и 2 мл солевого раствора Дульбекко с 10 % ЭТС. Пробы инкубировали при 37 С в течение 6 часов.
2.2.2. Выделение ДНК лимфоцитов
1. В чистые полипропиленовые пробирки типа “Eppendorf” объемом 1,5 мл вносили 3 мкл носителя и 450 мкл денатурирующего раствора. Добавляли 450 мкл исследуемой сыворотки или плазмы крови, используя наконечники с фильтрами. Тщательно перемешивали на вортексе в течение 10 секунд. Затем инкубировали при комнатной температуре 10 минут. После этого центрифугировали 15 секунд при 12 тыс. об/мин, добавляли 100 мкл хлороформа и перемешивали на вортексе 5 секунд. Далее вновь центрифугировали при 12 тыс. об/мин 10 минут. Переносили до 300 мкл верхней фазы в чистую полипропиленовую пробирку, содержащую 300 мкл изопропилового спирта, перемешивали на вортексе 5 секунд. Чтобы избежать контаминации, данную процедуру проводили используя наконечники с фильтрами. После этого центрифугировали при 12 тыс. об/мин 15 минут. Удаляли супернатант, используя водоструйный насос, в колбу-ловушку. К осадку добавляли 1 мл промывочного раствора, перемешивали и вновь центрифугировали при 12 тыс. об/мин 5 минут. Далее как можно тщательнее удаляли супернатант, осадок подсушивали 10-20 минут, добавляя 30 мкл деионизированной воды, закрывали пробирки, инкубировали 10 минут при комнатной температуре, перемешивали встряхиванием.
2.2.3. Исследование фрагментации ДНК лимфоцитов
15 мкл суспензии ДНК каждой пробы использовали для электрофоретической идентификации апоптоза клеток, 35 мкл для оценки содержания фрагментированной ДНК в лимфоцитах.
2.2.4. Электрофорез ДНК лимфоцитов
Электрофорез проводили в 1,5 % агарозном геле с добавлением 1 мкг/мл бромистого этидия при напряжении 20 В/см в течение 30 минут. Полученные гели просматривали и фотографировали в УФ-свете.
На электрофореграммах апоптотическая фрагментация ДНК выявлялась в виде “лесенки” из фрагментов ДНК различной длины. Некроз клеток обуславливал “размазанный” характер зоны миграции ДНК. Полоса свечения интактной ДНК находилась в районе старта.
2.2.5. Определение содержания фрагментированной ДНК в лимфоцитах
Содержание ДНК в пробах определяли дифениламиновым методом [Шаткин А., 1972]. К 1 мл гидролизованной ДНК добавляли 2 мл реактива Дише (1 г дифениламина, 100 ледяной уксусной кислоты, 2,75 мл концентрированной серной кислоты) и инкубировали в течение 16-20 часов при 30С. После инкубировали в кипящей водяной бане 10 минут для развития окраски. После этого пробы охлаждали и исследовали с помощью спектрофотометра СЭФ-46 при длине волны 600 нм. В качестве раствора сравнения использовали аналогичный раствор без ДНК.
Содержание ДНК (мкг) в лимфоцитах рассчитывали по калибровочной кривой с использованием стандартного раствора ДНК клеток тимуса теленка (1 мг/мл), 0,5 мл которого предварительно смешивали с равным объемом 0,1 Н раствора и гидролизовали в течение 10 минут в кипящей водяной бане и разбавляли 0,5 Н раствором HCIO4 до необходимой концентрации.
2.3. Исследование морфологии апоптоза лимфоцитов
После инкубации пробы центрифугировали 10 минут при 1000 об/мин, надосадочную жидкость удаляли, а из осадка готовили мазки, которые окрашивали азур-эозином в течение 40-50 минут. Для оценки морфологии апоптотических изменений лимфоцитов использовали цитопатологические критерии, предложенные S. G. Martin e.a. [Маянский А. Н., 1997]
2.4. Статистическая обработка результатов


 Полученные данные обрабатывали на Statistica for Windows (версия 6.0) и пакета программ Microsoft Excel (1997). Для всех имеющихся выборок данных проверена гипотеза нормальности распределения (по критерию Колмогорова-Смирнова). Для каждой выборки вычисляли средневыборочные характеристики.
Полученные данные обрабатывали на Statistica for Windows (версия 6.0) и пакета программ Microsoft Excel (1997). Для всех имеющихся выборок данных проверена гипотеза нормальности распределения (по критерию Колмогорова-Смирнова). Для каждой выборки вычисляли средневыборочные характеристики.
`Х - среднее арифметическое;
` - среднее квадратичное отклонение;
- среднее квадратичное отклонение;
m – ошибка среднего;
по формуле:
`Х = åа / n (1);
` =
= 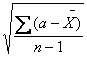 (2);
(2);
m = ±  (3);
(3);
где а – величины, полученные при исследовании;
n – число исследований.
При соответствии нормальному закону распределения признака в исследуемых выборках, проверка гипотезы о равенстве средних выборочных величин производилась с использованием t-критерия Стьюдента. Для оценки достоверности различий выборок, не подчиняющихся критерию нормального распределения, использовали непараметрический критерий Манна-Уитни. Различия считали достоверными, при уровне значимости p<0,05 [Лакин А.В.,1989].