Синтез и исследование алкилсалицилатных присадок
Страница 4
Таблица 3.
Состав олигомеров этилена С16-С18.
Угле-водо-роды
Па-ра-фи-ны | Олефины | | Всего олефинов | По длине | По строению |
| С16 | С18 | С14 и ниже | С20 и выше | α-олефины | Винили-деновые | С внутр. двойной связью |
| Содерж. в % масс. | 4 | 96 | 57-67 | 28-38 | До 2 | До 3 | До 40 | До 40 | До 20 |
Химизм процесса. 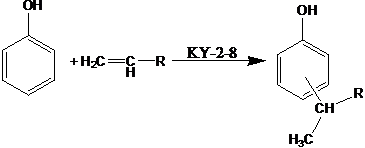 Реакция алкилирования является реакцией электрофильного замещения и катализируется катализаторами кислотного типа: минеральные и органические кислоты, галогениды металлов, катионнообменные смолы, алюмосиликаты. В качестве катализаторов алкилирования фенола высшими олефинами описаны также хлораты металлов, триэтилаллюминий, молекулярный йод, фенолят алюминия и другие. Широкое применение в производстве присадок, при алкилировании фенола высокомолекулярными олефинами получила также бензолсульфокислота (далее БСК). Её каталитическая активность близка к активности H2SO4 и AlCl3. Будучи сильной кислотой, БСК не обеспечивает селективность процесса алкилирования. В её присутствии образуется около 30% диалкилфенолов, главным образом 2,6-замещённых. Существенным недостатком процесса алкилирования фенолов в присутствии растворимых катализаторов (минеральных и органических кислот, галогенидов металлов и их молекулярных соединений) является необходимость отмывки продуктов реакции от катализатора. При этом образуется значительное количество фенольных сточных вод и возникает проблема их очистки, имеют место повышенные потери продукта. Применение нейтрализующих средств, например, аммиака и удаление катализатора в виде аммонийных солей фугованием не всегда обеспечивает полную очистку продуктов алкилирования от катализатора. Указанных недостатков лишён метод алкилирования фенолов с применением гетерогенных катализаторов (катионообменные смолы, алюмосиликаты, синтетические цеолиты и др.). К тому же указанные катализаторы являются менее сильными кислотами, что в значительной мере обеспечивает селективность процесса. В настоящее время алкилирование фенола олефинами в промышленности осуществляют в реакторах колонного типа на кислотном гетерогенном катализаторе сульфокатионите КУ-2-8, представляющим собой сульфированный сополимер стирола и дивинилбензола. В результате набухания полимера молекулы фенола и олефинов проникают внутрь зёрен, где у активных центров (сульфогрупп) протекает алкилирование. Сульфокатионит в отсутствие полярного растворителя (например, воды) не способен протонировать молекулы олефинов, а следовательно, не может катализировать реакцию алкилирования. В нашем случае среда безводная, однако роль полярного растворителя здесь играет фенол. Молекулы фенола абсорбируются катионитом, и внутри зёрен последнего происходит обмен протонами между SO3H-группой этого катионита и ОН-группой фенола. Именно этот обмен протонами и делает возможным протонирование молекул олефинов, а следовательно и протекание реакции алкилирования на сульфокатионите. Поскольку катионит лучше сорбирует фенол, чем олефины, то внутри зёрен создаётся избыток фенола, что обуславливает образование преимущественно моноалкилфенолов. Количество функциональных групп на поверхности катионита ничтожно мало, в связи с этим ионно-каталитические процессы происходят, главным образом, внутри гранул, чему способствует набухание смол в реагирующих компонентах. Повышение температуры увеличивает скорость алкилирования, что связано с ростом скорости диффузии реагентов внутрь гранул катионитов и увеличением подвижности протонов сульфогрупп. Так, при повышении температуры от 95 до 130 ºС скорость алкилирования увеличивается в 4 раза. Показано, что при повышении температуры от 130 до 150 ºС выход алкилфенолов увеличивается от 64 до 81% с повышением содержания дизамещённых. Количество последних зависит от соотношения фенола и олефинов: с повышением доли фенола образование диалкилпроизводных снижается. Продолжительность контакта реакционной смеси с катионитом определяет глубину превращения. Алкилирование проводят при температуре 120-140 ºС и мольном соотношении реагентов фенол : олефины 1,5÷2 к 1. Перед проведением реакции фенол и олефины должны быть тщательно обезвожены. Это необходимо потому, что при температуре 120-140 ºС вода гидролизует катионит с образованием серной кислоты.
Реакция алкилирования является реакцией электрофильного замещения и катализируется катализаторами кислотного типа: минеральные и органические кислоты, галогениды металлов, катионнообменные смолы, алюмосиликаты. В качестве катализаторов алкилирования фенола высшими олефинами описаны также хлораты металлов, триэтилаллюминий, молекулярный йод, фенолят алюминия и другие. Широкое применение в производстве присадок, при алкилировании фенола высокомолекулярными олефинами получила также бензолсульфокислота (далее БСК). Её каталитическая активность близка к активности H2SO4 и AlCl3. Будучи сильной кислотой, БСК не обеспечивает селективность процесса алкилирования. В её присутствии образуется около 30% диалкилфенолов, главным образом 2,6-замещённых. Существенным недостатком процесса алкилирования фенолов в присутствии растворимых катализаторов (минеральных и органических кислот, галогенидов металлов и их молекулярных соединений) является необходимость отмывки продуктов реакции от катализатора. При этом образуется значительное количество фенольных сточных вод и возникает проблема их очистки, имеют место повышенные потери продукта. Применение нейтрализующих средств, например, аммиака и удаление катализатора в виде аммонийных солей фугованием не всегда обеспечивает полную очистку продуктов алкилирования от катализатора. Указанных недостатков лишён метод алкилирования фенолов с применением гетерогенных катализаторов (катионообменные смолы, алюмосиликаты, синтетические цеолиты и др.). К тому же указанные катализаторы являются менее сильными кислотами, что в значительной мере обеспечивает селективность процесса. В настоящее время алкилирование фенола олефинами в промышленности осуществляют в реакторах колонного типа на кислотном гетерогенном катализаторе сульфокатионите КУ-2-8, представляющим собой сульфированный сополимер стирола и дивинилбензола. В результате набухания полимера молекулы фенола и олефинов проникают внутрь зёрен, где у активных центров (сульфогрупп) протекает алкилирование. Сульфокатионит в отсутствие полярного растворителя (например, воды) не способен протонировать молекулы олефинов, а следовательно, не может катализировать реакцию алкилирования. В нашем случае среда безводная, однако роль полярного растворителя здесь играет фенол. Молекулы фенола абсорбируются катионитом, и внутри зёрен последнего происходит обмен протонами между SO3H-группой этого катионита и ОН-группой фенола. Именно этот обмен протонами и делает возможным протонирование молекул олефинов, а следовательно и протекание реакции алкилирования на сульфокатионите. Поскольку катионит лучше сорбирует фенол, чем олефины, то внутри зёрен создаётся избыток фенола, что обуславливает образование преимущественно моноалкилфенолов. Количество функциональных групп на поверхности катионита ничтожно мало, в связи с этим ионно-каталитические процессы происходят, главным образом, внутри гранул, чему способствует набухание смол в реагирующих компонентах. Повышение температуры увеличивает скорость алкилирования, что связано с ростом скорости диффузии реагентов внутрь гранул катионитов и увеличением подвижности протонов сульфогрупп. Так, при повышении температуры от 95 до 130 ºС скорость алкилирования увеличивается в 4 раза. Показано, что при повышении температуры от 130 до 150 ºС выход алкилфенолов увеличивается от 64 до 81% с повышением содержания дизамещённых. Количество последних зависит от соотношения фенола и олефинов: с повышением доли фенола образование диалкилпроизводных снижается. Продолжительность контакта реакционной смеси с катионитом определяет глубину превращения. Алкилирование проводят при температуре 120-140 ºС и мольном соотношении реагентов фенол : олефины 1,5÷2 к 1. Перед проведением реакции фенол и олефины должны быть тщательно обезвожены. Это необходимо потому, что при температуре 120-140 ºС вода гидролизует катионит с образованием серной кислоты.  Выделившаяся серная кислота катализирует гомогенное алкилирование, что приводит к снижению селективности процесса и образованию кроме целевых моноалкилфенолов ещё и побочных продуктов: ди- и триалкилфенолов. Поэтому гидролиз катионита нежелателен и реагенты должны быть максимально обезвожены. 2.Получение алкилфенолята натрия. Алкилфенолят натрия получают взаимодействием алкилфенола с гидроксидом натрия. Как и всякая реакция нейтрализации, эта реакция сопровождается выделением небольшого количества тепла (до 2,4 ккал/моль). Химизм процесса.
Выделившаяся серная кислота катализирует гомогенное алкилирование, что приводит к снижению селективности процесса и образованию кроме целевых моноалкилфенолов ещё и побочных продуктов: ди- и триалкилфенолов. Поэтому гидролиз катионита нежелателен и реагенты должны быть максимально обезвожены. 2.Получение алкилфенолята натрия. Алкилфенолят натрия получают взаимодействием алкилфенола с гидроксидом натрия. Как и всякая реакция нейтрализации, эта реакция сопровождается выделением небольшого количества тепла (до 2,4 ккал/моль). Химизм процесса. 
Процесс проводится при температуре 100-125 ºС в реакторе с мешалкой. Используется 42%-ный водный раствор щёлочи. Обезвоживание полученного алкилфенолята натрия осуществляют в двух роторных плёночных испарителях, в которые подаётся азот (первая ступень обезвоживания), а затем в циркуляционных плёночных реакторах, соединённых последовательно (вторая ступень обезвоживания). Отпаривание влаги идёт при t=160 ºС и атмосферном давлении в токе азота, который подаётся в нижнюю часть реактора. Полное обезвоживание достигается благодаря многократной циркуляции алкилфенолята в каждом из реакторов. 3.Получение алкилсалицилата натрия. Алкилсалицилат натрия получают карбоксилированием алкилфенолята натрия диоксидом углерода (реакция Кольбе-Шмидта). Химизм процесса. Продуктом целевой реакции Кольбе-Шмидта является в основном алкил-о-гидроксибензоат (алкилсалицилат) натрия, образуются лишь следы пара-изомера. Однако если реакцию проводить с алкилфенолятом калия, то основным продуктом является алкил-п-гидроксибензоат. Поэтому в нашем производстве использование алкилфенолята калия недопустимо. Предполагают, что преимущественное образование алкил-о-гидроксибензоата при использовании алкилфенолята натрия связано с тем, что образующееся в результате атаки орто-положения переходное состояние стабилизировано в результате образования хелатного соединения в виде ионной пары (см. ниже):
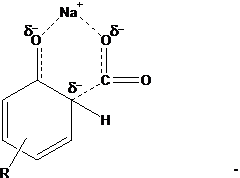
Размеры катиона К+ больше, и, вероятно, он менее эффективен в качестве хелатирующего агента, так что атака пара-положения становится поэтому более предпочтительной [47]. Способность алкилфенолята натрия образовывать хелаты (σ-комплексы) с полярными соединениями (СО2, Н2О, ацетон) обуславливает наличие в его молекуле группы -ONa. Реакция образования хелата экзотермическая, её тепловой эффект равен 17,0 ккал/моль. Так, при взаимодействии с СО2 при 20 ºС температура алкил(С9-С20)фенолята натрия повышается на 20 ºС. При взаимодействии с СО2 фенолята натрия выделяется тепло, равное 18,2 ккал/моль. Именно способность образовывать хелаты вызывает необходимость максимального обезвоживания алкилфенолята. Влага прочно удерживается из-за замыкания в кольцо координационными связями концевых атомов воды. Образование таких структур препятствует протеканию реакции Кольбе-Шмидта, потому что хелат алкилфенолята с водой более прочен, чем с СО2. В итоге вода не даёт части молекул алкилфенолята вступить в реакцию, благодаря чему снижается степень превращения его в алкилсалицилат и выход последнего. По этой же причине снижается выход алкилсалициловых кислот при карбоксилировании в полярных растворителях. Ацетон, например, способен количественно вытеснить СО2 из хелатов фенолята и алкилфенолята натрия. Летучие неполярные растворители снижают выход незначительно из-за снижения парциального давления СО2 в системе. Нелетучие неполярные растворители, снижая вязкость алкилфенолята натрия, способствуют увеличению степени превращения последнего в алкилсалицилат. Природа растворителя оказывает значительное влияние на процесс карбоксилирования незамещённых фенолятов натрия. Для высших алкилфенолятов это влияние выражено не столь резко. Отмечается, что в присутствии карбоната кальция реакцию между фенолом и двуокисью углерода проводят в присутствии воды. Наиболее оптимальные условия проведения реакции Кольбе-Шмидта для алкилфенолятов натрия таковы: температура 130 ºС, давление 0,5-2 МПа, продолжительность реакции – не менее 4 ч. При этих условиях наблюдается минимальное образование побочных продуктов при выходе алкилсалицилата натрия 60-75% от теории. Чем выше температура реакции, тем выше должно быть давление СО2. В промышленности процесс карбоксилирования алкилфенолята натрия обычно проводят периодически в последовательно соединённых герметичных реакторах с интенсивным перемешивающим устройством. В рубашки реакторов предусмотрена подача воды для охлаждения. Описана непрерывная схема карбоксилирования в насадочной колонне с последующей выдержкой карбоксилируемой смеси в пустотелой горизонтальной ёмкости с рубашкой для обогрева.