Геохимия океана. Происхождение океана
Страница 4
Результаты масс-спектрометрических определений показали, что между величиной отношения О18/О16 и количеством кислорода, растворенного в морской воде на разной глубине, существует значительное расхождение отрицательного знака. Использовав в качестве стандарта отношение О18/О16 в воздухе (0,2039%), удалось установить, что разница между процентным содержанием О18 и таковым воздуха с глубиной постепенно возрастает, достигая максимума в +0,006% в слое с минимальным содержанием кислорода, располагающемся на глубине около 700 м. После прохождения слоя с минимальным содержанием кислорода d снова уменьшается, падая на глубине 2870 м примерно до +0,001%. Доул [1952] установил, что кислород, освобождающийся при фотосинтезе, имеет более низкую величину отношения О18/О16, чем атмосферный кислород; по его данным, фактор фракционирования равен 0,983. Это должно приводить к уменьшению относительного количества О18 в растворенном в морской воде кислороде, так как этот кислород частично производится фитопланктоном.
С другой стороны, кислород в морской воде поглощается при дыхании живых организмов, при бактериальных процессах, при окислении органического детрита и т.д.; при этом легкий изотоп кислорода поглощается избирательно. Вследствие этого следует ожидать, что находящийся в воде остаточный кислород по сравнению с воздухом должен быть относительно обогащен О18. По данным определений Доула [1954], фактор фракционирования изотопов кислорода при процессах поглощения кислорода, растворенного в морской воде, равен 0,991. Необходимо отметить, что азот в газе, растворенном в воде океана, так же как и атмосферный азот, имеет нормальный изотопный состав.
Азот и редкие газы. Растворимость азота в морской воде описывается следующей формулой Фокса:
(1.12.) V(N2)=18,639-0,4304t / 0,00745t2-0,0000549t3-Cl(0,2172-0,00718t+0,0000952t2).
Результаты определений показывают, что содержание растворенного азота, а также аргона, неона и гелия, в отличие от кислорода мало изменяется с глубиной и всегда близко к насыщению.
В таблице 5 приведен пример данных о вертикальных вариациях содержания растворенных в воде неона и гелия в Атлантическом океане.
Таблица 5. Вариации содержания в морской воде растворенных неона и гелия (Rakestraw и др., 1939).
Атлантический океан (35о55’ с.ш. и 67о39’ з.д.), апрель
| Глубина, м | Температура, оС | Содержание кислорода, см3/л | Содержание He+Ne 10-5 см3/л |
| 0 5 25 62 166 333 622 912 1772 2959 | 18,28 18,31 17,97 17,93 17,92 17,63 15,62 9,55 3,86 3,16 | 5,14 5,15 5,05 5,17 5,15 4,90 4,10 3,60 5,88 6,15 | 18,5 14,1 15,2 15,2 15,2 15,6 15,9 15,9 16,5 17,8 |
6. Электрохимические процессы в океане
Поскольку морская вода представляет собой электролит, то естественно, что в океане протекают разнообразные электрохимические процессы.
Морская вода является проводником электричества, поэтому при ее движении через магнитное поле Земли в соответствии с законом электроиндукции возникает э.д.с.
Зависимость между разницей потенциалов и скоростью течения воды в океане имеет следующий вид:
(1.13.) Ñ2j=H rot u,
где Н –интенсивность магнитного поля Земли; u -скорость течения; j - разница потенциалов.
Электрические токи в океане, вызванные совместным действием земного магнетизма и движения воды, могут влиять на многие подводные вопросы. Например, подводный кабель, проложенный по дну узкого пролива с сильными приливно-отливными течениями, будет очень быстро корродироваться. В настоящее время получено подтверждение предположения автора о том, что коррозия начинается под воздействием электрического тока, изменяющегося в зависимости от приливного течения; коррозия ускоряется под воздействием вторичной поляризации, возникающей на корродированной поверхности кабеля.
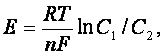 Другое электрохимическое явление океана заключается в возникновении концентрационных ячеек. Разность потенциалов Е определяется по формуле:
Другое электрохимическое явление океана заключается в возникновении концентрационных ячеек. Разность потенциалов Е определяется по формуле:
(1.14.) Где С1 и С2 – концентрации известных ионов. В открытом океане величина отношения С1/С2 близка к 1, и поэтому здесь трудно ожидать возникновения большой разницы потенциалов.
Более того, ввиду присутствия в воде растворенного кислорода, часто обладающего значительным градиентом концентрации, наблюдается значительный окислительно-восстановительный потенциал. Если на борту корабля поместить каломелевый полуэлемент, а в воду погрузить платиновый электрод, то можно легко измерить разность потенциалов между электродами, изменяющуюся с глубиной в зависимости от содержания кислорода.
Номура [1941] установил, что в мелководной зоне моря между придонным и верхним слоями воды может возникать значительная разность потенциалов, достигающая иногда 0,4 в. в пресной и солоноватой воде, когда буферные реакции слабы, окислительно-восстановительный потенциал близок величине рН.
Гольдберг [1954] считает, что в основе образования марганцевых конкреций, встречаемых в глубоководной зоне лежит электрохимический процесс аккумуляции марганца и железа.
Последние исследования глубоководной зоны установили, что морская вода испытывает перемещения даже близ самого дна. Вследствие этого верхняя часть дна океана будет служить электродом. Если подводные перемещения воды связывать с приливными движениями, то дно – электрод должно попеременно приобретать разную полярность. Соли окиси марганца в морской воде, имеющие отрицательный заряд, будут осаждаться вследствие электрофореза при положительном заряде электрода, а железо бдут осаждаться при приобретении электродом отрицательного заряда. Если полярность электрода изменяется через одинаково равные промежутки времени, то в конкрециях будет аккумулироваться равное количество железа и марганца.
7. Обмен двуокисью углерода между атмосферой и океаном
Атмосферный воздух в среднем содержит 0,03 об % углекислоты. Общее содержание двуокиси углерода в атмосфере оценивается в 0,0233 х 1020 г. В океане двуокись углерода присутствует в виде Н2СО3, НСО-3, СО2-3, органического вещества; общее ее содержание оценивается в 1,4 х 1020 г, что примерно в 60 раз превосходит ее количество в атмосфере.