Геохимия океана. Происхождение океана
Страница 5
По расчетным данным наибольшее количество углекислоты производится живыми организмами, в то же время предполагается, что количество углекислоты, расходующееся при эрозии и седиментации, сопровождаемых преобразованием силикатов в карбонаты, приблизительно равно ее количеству, поступающему за счет вулканической деятельности, деятельности фумарол, горячих источников и т.п.
Количество углерода, содержащегося в организмах, будучи выражено через СО2, составляет около 0,145 х 1020 г, что в 6 или 7 раз превышает содержание СО2 в атмосфере. Как указывал В.И. Вернадский, организмы являются важным звеном в геохимическом цикле углерода.
Другой важный момент заключается в том, что в океане в растворенном состоянии также находится колоссальное количество углекислоты. Средняя общая концентрация СО2 в морской воде составляет 2,3 миллимоля/л. У поверхности моря, где вода соприкасается с воздухом, наблюдается тенденция к установлению одинакового парциального давления СО2 в атмосфере и в морской воде. Таким образом, океаном может контролироваться содержание СО2 в атмосфере. Эта идея впервые была высказана Шлезингом еще в XIX столетии.
Как будет сказано ниже, скорость обмена молекулами углекислоты между морской водой и атмосферой может быть легко установлена на основании имеющихся определений радиоуглеродного возраста морских осадков и организмов.
Величина отношения С13/С12 в морских карбонатах примерно на 2,5% выше этой величины у наземной флоры. Соответственно фактор обогащения С14 в них два раза больше, чем фактор обогащения С13. С учетом влияния эффекта изотопного фракционирования концентрация С14 в морских материалах, пониженная относительно его концентрации в стандартах, должна быть целиком отнесена за счет радиоактивного распада, по которому может быть определен абсолютный возраст вещества.
Крэг [1954] установил, что хотя ожидаемая величина обогащения современных морских раковин С14 равна 5%; что соответствует 400 годам абсолютного возраста углерода в поверхностных водах океана. Крэг высказал предположение, что это, возможно, результат медленного обмена двуокисью углерода, между океаном и атмосферой.
По данным Зюсса [1954, 1955], средний радиоуглеродный возраст морских организмов (по пробам из Атлантического океана) составляет 430 лет.
(1.15.) 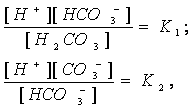 Распределение двуокиси углерода в океане. В свежей воде угольная кислота диссоциирует следующим образом:
Распределение двуокиси углерода в океане. В свежей воде угольная кислота диссоциирует следующим образом:
(1.16.) Где К1 и К2 – соответственно первая и вторая константы дисоциации, величина которых изменяется в зависимости от температуры, солености и хлорности воды. При 20о С К1=4,15 х 10-7, рК1=6,38 и К2= 4,20 х 10-11, рК2=10,38.
Скорость обмена двуокиси углерода между атмосферой и океаном. В связи с возможным накоплением двуокиси углерода в результате сжигания больших количеств ископаемого топлива значительное внимание уделяется вопросам о распределении углекислоты на Земле в целом и о скорости обмена двуокисью углерода между воздухом и морской водой. Если количество атмосферной двуокиси углерода действительно увеличивается, то должно происходить и повышение температуры воздуха, обусловленное абсорбцией инфракрасного излучения, что должно повлечь за собой существенные изменения в климате Земли. Такая возможность в значительной степени будет зависеть от скорость обмена углекислотой между атмосферой и гидросферой.
Исходя из наблюдений за поведением С14 в атмосфере и океане Ревель и Зюсс [1957] оценивают время пребывания углекислоты в атмосфере 14-30 лет.
Определение парционального давления углекислоты в воздухе и в поверхностных водах Атлантического океана Такахаши [1959] установили, что концентрация двуокиси углерода в воздухе непосредственно над поверхностью моря довольно постоянна, в среднем около 317,4 ррm, и что океан абсорбирует углекислоту всей площадью своей поверхности. По данным Такахаши, средняя концентрация углекислоты в атмосферном воздухе 320,8 ррm.
8. Определение палеотемператур древних морей.
Шкала палеотемператур по соотношению изотопов кислорода в органическом кальците.
Юри и его сотрудники [1951] предложили интересный метод определения температур древних морей, основанный на зависимости изотопного состава кислорода воды и карбонатных ионов от температуры. В проводившихся ими исследованиях определялось процентное содержание тяжелого изотопа О18 в материале карбонатных ископаемых останков древних морей, которые образовались за счет отмирания обитавших в них живых организмов.
По данным Сиборга и Перльмана [1948] изотопы кислорода имеют следующую относительную распространенность: О16 – 99,757, О17 – 0,039, О18 – 0,204. Эти величины могут колебаться, отклоняясь максимум на 4%.
Механизм изотпоного фракционирования при равновесном обмене был исследован Юри и Грифом [1935], Юри [1947] и другими исследователями. Значительное количество данных получено относительно обмена дейтерия и протия.
Для реакции обмена изотопов кислорода между карбонатными ионами (СО2-3) и молекулами воды (Н2О) фактор фракционирования может быть определен по уравнению:
| 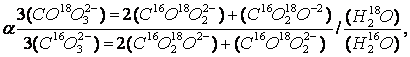 |
| 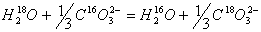 |
(1.17.) Где величина a приблизительно равна константе равновесия К следующей реакции обмена:
(1.18)
Таким образом, рассчитав К для реакции 1,17 можно получить фактор фракционирования a и его вариации в зависимости от температуры.
Расчетами установлено, что фракционирование протекает более эффективно при низких температурах и величина фактора фракционирования от 0 до 25 оС изменяется на 0,44%, т.е. 0,176% на 1оС. Поэтому определяя концентрацию О18, можно узнать температуру воды.
Путем определения содержания О18 в раковинах морских животных, живущих при известной температуре, Эпштейн, Бухсбаум, Лоуенстем и Юри [1953] установили следующие зависимость между температурой и девиациями содержания О18.
(1.19.) t=16,5-4,3d+0,14d2,
 d - в уравнении 1.18. определяется по формуле:
d - в уравнении 1.18. определяется по формуле:
(1.20.) где R – отношение числа молекул С16О18О к числу молекул С16О2 в пробе и стандарте. В качестве стандарта карбоната использовался белемнит из формации Пиди.
Относительное содержание в морской воде О18. Для точного определения температуры по кислородной шкале необходимо знать соленость воды, так как относительное содержание О18 в морской воде сильно варьирует в зависимости от ее солености. Поскольку давление водяных паров, состоящих из Н2О16 на 0,8 и 1,1%, выше такового Н2О18 при 25 и 0оС соответственно, то содержание О18 в воде океанов должно существенно зависеть от процессов испарения и конденсации.