Интересные сведения о белках
ИНТЕРЕСНЫЕ СВЕДЕНИЯ О БЕЛКАХ
Введение
Более 4 миллиардов лет назад на Земле из маленьких неорганических молекул непостижимым образом возникли белки, ставшие строительными блоВнками живых организмов. Своим бесВнконечным разнообразием всё живое обязано именно уникальным молекуВнлам белка, и иные формы жизни во Вселенной науке пока неизвестны.
Нормальная деятельность любого организма возможна лишь при непрерывном поступлении пищи. Входящие в состав пищи белки, жиры, углеводы, минеральные соли, вода и витамины необходимы для жизненных процессов организма. Питательные вещества являются как источником энергии, покрывающем расходы организма, так и строительным материалом, который используется в процессе роста организма и воспроизведения новых клеток, замещающих отмирающие.
Но питательные вещества в том виде, в каком они употребляются в пищу, не могут всосаться и быть использованными организмом. Только вода, минеральные соли и витамины всасываются и усваиваются в том виде, в каком они поступают. Другие питательные вещества в пищеварительном тракте подвергаются как физическим воздействиям (измельчаются и перетираются), так и химическим изменениям, которые происходят под влиянием особых веществ - ферментов, содержащихся в соках пищеварительных желёз. Под влиянием пищеварительных соков питательные вещества расщепляются на более простые, которые всасываются и усваиваются организмом.
Белки, или протеины (от греч. protos тАФ первый, первичный), тАФ это природВнные органические соединения, котоВнрые обеспечивают все жизненные процессы любого организма. Из белВнков построены хрусталик глаза и паВнутина, панцирь черепахи и ядовитые вещества грибов.. С помощью белков мы перевариваем пищу и боремся с болезнями. Благодаря особым белкам по ночам светятся светлячки, а в глуВнбинах океана мерцают таинственВнным светом медузы.
Впервые белок был выделен (в виВнде клейковины) в 1728 г. итальянцем Якопо Бартоломео Беккари (1682тАФ 1766) из пшеничной муки. Это собыВнтие принято считать рождением хиВнмии белка. С тех пор почти за три столетия из природных источников получены тысячи различных белков и исследованы их свойства.
"Во всех растениях и животных присутствует некое вещество, которое без сомнения является наиболее важным из всех известных веществ живой природы и без которого жизнь была бы на нашей планете невозможна. Это вещество я наименовал - протеин". Так писал еще в 1838 году голландский биохимик Жерар Мюльдер, который впервые открыл существование в природе белковых тел и сформулировал свою теорию протеина.
И в самом деле, все живое на земле содержит белки. Они составляют около 50% сухого веса тела всех организмов. У вирусов содержание белков колеблется в пределах от 45 до 95%. Белки являются одними из четырех основных органических веществ живой материи (белки, нуклеиновые кислоты, углеводы, жиры), но по своему значению и биологическим функциям они занимают в ней особое место. Около 30% всех белков человеческого тела находится в мышцах, около 20% - в костях и сухожилиях и около 10% - в коже. Но наиболее важными белками всех организмов являются ферменты, которые, хотя и присутствуют в их теле и в каждой клетке тела в малом количестве, тем не менее управляют рядом существенно важных для жизни химических реакций. Все процессы, происходящие в организме: переваривание пищи, окислительные реакции, активность желез внутренней секреции, мышечная деятельность и работа мозга регулируется ферментами. Разнообразие ферментов в теле организмов огромно. Даже в маленькой бактерии их насчитываются многие сотни.
В наше время, когда абсолютно достоверно установлено, что наследственная информация сосредоточена в молекуле ДНК клеток любых живых организмов, не вызывает сомнения, что только белки являются теми молекулярными инструментами, при помощи которых генетическая информация реализуется. Без белков, в частности ферментов, ДНК не может воспроизводить себя, т. е. лишена способности передавать генетическую информацию.
Живая природа характеризуется рядом свойств, отличающих ее от неживой природы, и почти все эти свойства связаны с белками. Прежде всего, для живых организмов характерны широкое разнообразие белковых структур и их высокая упорядоченность; последняя существует во времени и в пространстве. Удивительная способность живых организмов к воспроизведению себе подобных также связана с белками. Сократимость, движение - непременные атрибуты живых систем - имеют прямое отношение к белковым структурам мышечного аппарата. Наконец, жизнь немыслима без обмена веществ, постоянного обновления составных частей живого организма, т.е. без процессов анаболизма и катаболизма (этого удивительного единства противоположностей живого), в основе которых лежит деятельность каталитически активных белков - ферментов.
В природе существует примерно 1010-1012 различных белков, обеспечивающих жизнедеятельность организмов всех степеней сложности от вирусов до человека, они обеспечивают жизнь более 2 млн. видам организмов. Белками являются ферменты, антитела, многие гормоны и другие биологически активные вещества. Необходимость постоянного обновления белков лежит в основе обмена веществ. Именно поэтому белки и явились тем исключительным материалом, который послужил основой возникновения жизни на Земле. Ни одно вещество из всех веществ биологического происхождения не имеет столь большого значения и не обладает столь многогранными функциями в жизни организма как белки.
Ф. Энгельс писал: тАЮПовсюду, где мы встречаем жизнь, мы находим, что она связана с каким-либо белковым телом и повсюду, где мы встречаем какое-либо белковое тело, которое не находится в процессе разложения, мы без исключения встречаем и явления жизнитАЬ.
Исследование белков
Свое название белки получили от яичного белка, который с незапамятных времен использовался человеком как составная часть пищи. Согласно описаниям Плиния Старшего, уже в Древнем Риме яичный белок применялся и как лечебное средство. Однако подлинная история белковых веществ начинается тогда, когда появляются первые сведения о свойствах белков как химических соединений (свертываемость при нагревании, разложение кислотами и крепкими щелочами и т. п.). Среди белков животного происхождения, вслед за яичным белком, были охарактеризованы белки крови. Образование сгустков крови при ее свертывании описано еще основателем учения о кровообращении У.Гарвеем; позднее на этот факт обратил внимание и Р.Бойль. Среди растительных белков пальма первенства принадлежит нерастворимой в воде клейковине из пшеничной муки, которую впервые получил Я.Беккари. В своих работах, он отметил сходство клейковины с веществами животной природы.
Впервые термин белковый (albumineise) применительно ко всем жидкостям животного организма использовал французский физиолог Ф.Кене в 1747 г., и именно в таком толковании термин вошел в 1751 г. в ВлЭнциклопедиюВ» Д.Дидро и Ж.Д'Аламбера.
С этого периода исследования, связанные с получением белков, приобретают систематический характер. В 1759 г. А.Кессель-Майер, а несколько позднее И.Руэль описали выделение клейковины из различных растений и охарактеризовали ее свойства. В 1762 г. А.Халлер исследовал процесс образования и свертывания казеина, а в 1777 г. А.Тувенель, работавший тогда в Петербурге, называет творог белковой частью молока . Важнейший этап в изучении белков связан с работами французского химика А.Фуркруа, который рассматривал белки как индивидуальные вещества и доказал единую природу белковых веществ, выделенных из растительных и животных источников. Для трех главных белковых компонентов крови он предложил названия альбумин, желатин и фибрин. В 1780 г. Ф.Вассерберг относит к телам белковой природы хрусталик глаза.
К началу XIX столетия появляются первые работы по химическому изучению белков. Уже в 1803 г. Дж.Дальтон дает первые формулы белков - альбумина и желатина - как веществ, содержащих азот. В 1810 г. Ж.Гей-Люссак проводит химические анализы белков - фибрина крови, казеина и отмечает сходство их элементного состава. Решающее значение для понимания химической природы белков имело выделение при их гидролизе аминокислот. Вероятно, первым это сделал А.Браконно в 1820 г., когда, действуя на белки серной кислотой, при кипячении он получил Влклеевой сахарВ», или глицин, при гидролизе фибрина из мяса - лейцин и при разложении шерсти - также лейцин и смесь других продуктов гидролиза. Первой открытой аминокислотой был, видимо, аспарагин, выделенный Л.Вокленом из сока спаржи Asparagus (1806). В это же время Ж.Пруст получил лейцин при разложении сыра и творога. Затем из продуктов гидролиза белка были выделены многие другие аминокислоты.
Первая концепция строения белков принадлежит голландскому химику Г.Мульдеру (1836). Основываясь на теории радикалов, он сформулировал понятие о минимальной структурной единице, входящей в состав всех белков. Эту единицу Мульдер назвал протеином (Рг), а свою концепцию - теорией протеина. Позднее состав протеина был уточнен; дополнительно к протеинным единицам некоторые белки содержали серу и фосфор. Работы Г. Мульдера способствовали широкому распространению взглядов о единстве всех белков, их фундаментальном значении в мире живой природы.
В ходе проверки Влтеории протеинаВ» были резко расширены химические исследования белков, и в этом приняли участие выдающиеся химики того времени Ю. Либих и Ж. Дюма. Ю. Либих, поддерживавший в принципе идею протеиновой единицы, уточнил формулу протеина.
Однако вскоре наступают трудные времена для теории протеина. В 1846 г. Н. Э.Лясковский, работавший в лаборатории Ю. Либиха, доказал неточность многих приведенных Г.Мульдером анализов. Свои сомнения в правильности теории публично высказал Ю. Либих, он планировал начать широкие исследования структуры белков и даже изучил продукты распада белковых веществ. Понимая весомость аргументов оппонентов, Г.Мульдер пытался корректировать формулу протеина, но в конце концов уступил под натиском новых фактов и открытий. Теория протеина стала достоянием истории, однако ее значение непреходяще, ибо она стимулировала химические исследования белков, сделала белки одним из главных объектов бурно развивающейся химии природных веществ.
В 1902г. Э.Фишер создал метод анализа и разделения аминокислот, основанный на переводе их в сложные эфиры, которые можно было подвергать фракционной перегонке, не опасаясь разложения. С помощью этого метода провел качественное и количественное определение продуктов расщепления белков и открыл аминокислоты валин, пролин и гидроксипролин. Позднее из аминокислот он получил продукты их конденсации, названные полипептидами.
В 1934Ваг. Лайнус Полинг совместно с А.E.Мирски сформулировал теорию строения и функции белка. В 1936Ваг. он положил начало изучению атомной и молекулярной структуры белков и аминокислот (мономеров, из которых состоят белки) с применением рентгеновской кристаллографии. В 1942Ваг. Полингу и его коллегам, получив первые искусственные антитела, удалось изменить химическую структуру некоторых содержащихся в крови белков, известных как глобулины. В 1951Ваг. П. и Р.Б.ВаКори опубликовали первое законченное описание молекулярной структуры белков. Это был результат исследований, длившихся долгих 14 лет. Применяя методы рентгеновской кристаллографии для анализа белков в волосах, шерсти, мускулах, ногтях и других биологических тканях, они обнаружили, что цепи аминокислот в белке закручены одна вокруг другой таким образом, что образуют спираль. Это описание трехмерной структуры белков ознаменовало крупный прогресс в биохимии.
Биологические ВлбусыВ»
Белки имеют очень сложное строение и являются наиболее сложными из питательных веществ. Белки - обязательная составная часть всех живых клеток. В состав белков входят: углерод, водород, кислород, азот, сера и иногда фосфор. Наиболее характерно для белка наличие в его молекуле азота. Другие питательные вещества азота не содержат. Поэтому белок называют азотосодержащим веществом.
Молекула белка очень длинная. ХимиВнки называют такие молекулы полиВнмерными (от греч. poly тАФ много и meros тАФ часть, доля). ДействиВнтельно, длинная молекула полимера состоит из множества маленьких моВнлекул, связанных друг с другом. Так нанизываются на нить бусинки в ожерелье. В полимерах роль нити игВнрают химические связи между бусинВнками-молекулами.
Секрет белков спрятан в особенВнностях этих самых молекул-бусинок. БольВншинство полимеров не принимает устойчивой формы в пространстве, уподобляясь тем же бусам, у которых и не может быть пространственной структуры: повесишь их на шею тАФ они примут форму кольца или овала, положишь в коробку тАФ свернутся в клубок неопределённой формы. А теВнперь представим себе, что некоторые бусинки могут ВлслипатьсяВ» друг с другом. Например, красные притягиВнваются к жёлтым. Тогда вся цепочка примет определённую форму, обязанВнную своим существованием ВлслипаниюВ» жёлтых и красных бусинок.
Нечто подобное происходит и в белках. Отдельные маленькие молеВнкулы, входящие в состав белка, облаВндают способностью ВлслипатьсяВ», так как между ними действуют силы приВнтяжения. В результате у любой белкоВнвой цепи есть характерная только для неё пространственная структура. Именно она определяет чудесные свойства белков. Без такой структуры они не могли бы выполнять те функВнции, которые осуществляют в живой клетке.
Состав и строение белков
Основные азотосодержащие вещества, из которых состоят белки, - это аминокислоты. Количество аминокислот невелико - их известно только 28. Все громадное разнообразие содержащихся в природе белков представляет собой различное сочетание известных аминокислот. От их сочетания зависят свойства и качества белков.
АминоВнкислоты тАФ это и есть те ВлбусинкиВ», из которых состоит белок, и устроены они сравнительно просто.
В каждой молекуле аминокислоты есть атом углерода, связанный с четырьмя заместителями. Один из них тАФ атом водорода, второй тАФ карВнбоксильная группа тАФ СООН. Она легВнко Влотпускает на волюВ» ион водороВнда Н+, благодаря чему в названии аминокислот и присутствует слово ВлкислотаВ». Третий заместитель тАФ амиВнногруппа тАФNH2 и, наконец, четвёрВнтый заместитель тАФ группа атомов, коВнторую в общем случае обозначают R. У всех аминокислот R-группы разные, и каждая из них играет свою, очень важную роль. Свойства ВлбусинокВ», отличающие одну аминокислоту от другой, скрыВнты в R-группах (их ещё называют боВнковыми цепями).
Число аминокислот, различаВнющихся R-группой, велико. В настоящее время в различных объектах живой природы обнаружено до 200 различных аминокислот. В организме человека их, например, около 60. Но чаще других в белках встречается всего 20 разных аминокислот. Их можно расВнсматривать как алфавит ВлязыкаВ» белВнковой молекулы. Химики называют эти главные аминокислоты стандартВнными, основными или нормальными.
Для нормальной жизнедеятельноВнсти человеческий организм нуждается в полном наВнборе из 20 основных аминокислот. Но одни из них могут быть синтезироВнваны в клетках самого организма, а другие тАФ должны поступать в готовом виде из пищевых продуктов. В перВнвом случае аминокислоты называют заменимыми, а во втором тАФ незамениВнмыми. Набор последних для разных организмов различен. Например, для белой крысы незаменимыми являютВнся 10 аминокислот, а для молочнокислых бактерий тАФ 16. Растения могут саВнмостоятельно синтезировать самые разнообразные аминокислоты, создаВнвать такие, которые не встречаются в белках.
Элементный состав белков
Белки содержат в среднем около 1 6% азота, 50-55% углерода, 21-23% кислорода, 15-17% азота, 6-7% водорода, 0,3-2,5% серы. В составе отдельных белков обнаружены также фосфор, йод, железо, медь и некоторые другие макро- и микроэлементы, в различных, часто очень малых количествах. Содержание основных химических элементов в белках может различаться, за исключением азота, концентрация которого характеризуется наибольшим постоянством.
Последовательность соединения аминокислот в том или ином белке устанавливают путем ступенчатого расщепления или рентгеноструктурным анализом.
Молекулярная масса
Белки являются высокомолекулярными соединениями. Это полимеры, состоящие из сотен и тысяч аминокислотных остатков тАФ мономеров. Соответственно и молекулярная масса белков находится в пределах 10000 - 1000000. Так, в составе рибонуклеазы (фермента, расщепляющего РНК) содержится 124 аминокислотных остатка и ее молекулярная масса составляет примерно 14000. Миоглобин (белок мышц), состоящий из 153 аминокислотных остатков, имеет молекулярную массу 17000, а гемоглобин тАУ 64500 (574 аминокислотных остатка). Молекулярные массы других белков более высокие: γ-глобулин (образует антитела) состоит из 1250 аминокислот и имеет молекулярную массу около 150000, а молекулярная масса белка вируса гриппа тАУ 320000000.
Классификация белков
Из-за относительно больших размеров белковых молекул , сложности их строения и отсутствия достаточно точных данных о структуре большинства белков еще нет рациональной химической классификации белков. Существующая классификация в значительной мере условна и построена главным образом на основании физико-химических свойств белков, источников их получения , биологической активности и других, нередко случайных, признаков. Так, по физико-химическим свойствам белки делят на фибриллярные и глобулярные , на гидрофильные(растворимые) и гидрофобные (нерастворимые) и т.п. По источнику получения белки подразделяют на животные, растительные и бактериальные; на белки мышечные, нервной ткани, кровяной сыворотки и т.п.; по биологической активности тАУ на белки-ферменты, белки-гормоны, структурные белки, сократительные белки, антитела и т.д. Следует, однако, иметь в виду, что из-за несовершенства самой классификации, а также вследствие исключительного многообразия белков многие из отдельных белков не могут быть отнесены ни к одной из описываемых здесь групп.
Все белки принято делить на простые белки, или протеины, и сложные белки, или протеиды (комплексы белков с небелковыми соединениями). Простые белки (они широко распространены в животном и растительном мире) являются полимерами только аминокислот; сложные, помимо остатков аминокислот, содержат также небелковые, так называемые простетические группы.
Протеины.
Гистоны. Имеют сравнительно низкую молекулярную массу (12-13 тыс.), с преобладанием щелочных свойств. Локализованы в основном в ядрах клеток. Растворимы в слабых кислотах, осаждаются аммиаком и спиртом. Имеют только третичную структуру. В естественных условиях прочно связаны с ДНК и входят в состав нуклеопротеидов. Основная функция тАФ регуляция передачи генетической информации с ДНК и РНК (возможна блокировка передачи).
Протамины. Самая низкая молекулярная масса (до 12 тыс.). Проявляют выраженные основные свойства. Хорошо растворимы в воде и слабых кислотах. Содержатся в половых клетках и составляют основную массу белка хроматина. Как и гистоны образуют комплекс с ДНК, функция - придают ДНК химическую устойчивость.
Глютелины. Растительные белки, содержащиеся в клейковине семян злаковых и некоторых других, в зеленых частях растений. Нерастворимы в воде, растворах солей и этанола, но хорошо растворимы в слабых растворах щелочей. Содержат все незаменимые аминокислоты, являются полноценными продуктами питания.
Проламины. Растительные белки. Содержатся в клейковине злаковых растений. Растворимы только в 70%-м спирте (это объясняется высоким содержанием пролина и неполярных аминокислот).
Протеиноиды. Белки опорных тканей (кость, хрящ, связки, сухожилия, ногти, волосы). Нерастворимые или трудно растворимые в воде, солевых и водно-спиртовых смесях белки с высоким содержанием серы. К протеиноидам относятся кератин, коллаген, фиброин.
Альбумины. Невысокой молекулярной массой (15-17 тыс.). Характерны кислые свойства. Растворимы в воде, и слабых солевых растворах. Осаждаются нейтральными солями при 100%-м насыщении. Участвуют в поддержании осмотического давления крови, транспортируют с кровью различные вещества. Содержатся в сыворотке крови, молоке, яичном белке.
Глобулины. Молекулярная масса до 100 тыс. В воде нерастворимы, но растворимы в слабых солевых растворах и осаждаются в менее концентрированных растворах (уже при 50%-м насыщении). Содержатся в семенах растений, особенно в бобовых и масленичных; в плазме крови и в некоторых других биологических жидкостях. Выполняющие функцию иммунной защиты, обеспечивают устойчивость организма к вирусным инфекционным заболеваниям.
Склеропротеины тАФ нерастворимые белки. К склеропротеинам относятся кератины, белок кожи и соединительных тканей коллаВнген, белок натурального шелка фиброин.
Протеиды построены из протеинов, соединенных с молекулами другого типа (простетическими группами).
Фосфопротеины. Имеют в качестве небелкового компонента фосфорную кислоту. Представителями данных белков являются казеиноген молока, вителлин (белок желтков яиц). Такая локализация фосфопротеидов свидетельствует о важном их значении для развивающегося организма. У взрослых форм эти белки присутствуют в костной и нервной тканях.
Липопротеины. Сложные белки, простетическая группа которых образована липидами. По строению это небольшого размера (150-200нм) сферические частицы, наружная оболочка которых образована белками (что позволяет им передвигаться по крови), а внутренняя часть тАФ липидами и их производными. Основная функция липопротеинов тАФ транспорт по крови липидов.
Металлопротеины. Содержат катионы одного или нескольких металлов. Наиболее часто это тАФ железо, медь, цинк, молибден, реже марганец, никель. Белковый компонент связан с металлом координационной связью.
Гликопротеины. Простетическая группа представлена углеводами и их производными. Имеют функции: структурно-механическую (имеются в коже, хряще, сухожилиях); каталитическую (ферменты); защитную; участие в регуляции клеточного деления.
Хромопротеины. Выполняют ряд функций: участие в процессе фотосинтеза и окислительно-восстановительных реакциях, транспорте С и СО2. Являются сложными белками, простетическая группа которых представлена окрашенными соединениями.
Нуклеопротеины. Роль протеистической группы выполняет ДНК или РНК. Белковая часть представлена в основном гистонами и протаминами. Такие комплексы ДНК с протаминами обнаружены в сперматозоидах, а с гистонами - в соматических клетках, где молекула ДНК ВлнамотанаВ» вокруг молекул белка-гистона. Нуклепротеинами по своей природе являются вне клетки вирусы - это комплексы вирусной нуклеиновой кислоты и белковой оболочки - капсида.
При соединении двух или нескольких аминокислот образуется более сложное соединение - полипептид. Полипептиды, соединяясь, образуют еще более сложные и крупные частицы и в итоге - сложную молекулу белка.
Функции белка
Белки выполняют множество самых разнообразных функций, характерных для живых организмов. Здесь же будут перечислены главные и в некотором смысле уникальные биологические функции белков, не свойственные или лишь частично присущие другим классам биополимеров.
Каталитическая функция. Все известные в настоящее время биологические катализаторы - ферменты - являются белками. К 1988 г. было идентифицировано более 2100 ферментов. Эта функция белков является уникальной, определяющей скорость химических реакций в биологических системах.
Питательная (резервная) функция. Эту функцию осуществляют так называемые резервные белки, являющиеся источниками питания для развития плода, например белки яйца (овальбумины). Основной белок молока (казеин) также выполняет главным образом питательную функцию. Ряд других белков несомненно используется в организме в качестве источника аминокислот, которые в свою очередь являются предшественниками биологически активных веществ, регулирующих процессы обмена веществ.
Транспортная функция. Дыхательная функция крови, в частности перенос кислорода, осуществляется молекулами гемоглобина - белка эритроцитов. В транспорте липидов принимают участие альбумины сыворотки крови. Ряд других сывороточных белков образует комплексы с жирами, медью, железом, тироксином, витамином А и другими соединениями, обеспечивая их доставку в соответствующие органы-мишени.
Защитная функция. Основную функцию защиты в организме выполняет иммунная система, которая обеспечивает синтез специфических защитных белков-антител в ответ на поступление в организм бактерий, токсинов или вирусов. Высокая специфичность взаимодействия антител с антигенами (чужеродными веществами) по типу белок-белок способствует узнаванию и нейтрализации биологического действия антигенов. Защитная функция белков проявляется и в способности ряда белков крови к свертыванию. Свертывание белка плазмы крови фибриногена приводит к образованию сгустка крови, что предохраняет от потери крови при ранениях.
Сократительная функция. В акте мышечного сокращения и расслабления участвует множество белковых веществ. Однако главную роль в этих жизненно важных процессах играют актин и миозин - специфические белки мышечной ткани. Сократительная функция присуща не только мышечным белкам, но и белкам цитоскелета, что обеспечивает тончайшие процессы жизнедеятельности клеток (расхождение хромосом в процессе митоза).
Структурная функция. Белки, выполняющие структурные функции, занимают по количеству первое место среди других белков тела человека. Среди них важнейшую роль играет коллаген в соединительной ткани, кератин в волосах, ногтях, коже, эластин в сосудистой стенке и др. Большое значение имеют комплексы белков с углеводами в формировании ряда секретов - мукоидов, муцина и т. д. В комплексе с липидами (в частности, фосфолипидами) белки участвуют в образовании биомембран клеток.
Гормональная функция. Обмен веществ в организме регулируется разнообразными механизмами. В этой регуляции важное место занимают гормоны, вырабатываемые в железах внутренней секреции. Ряд гормонов представлен белками или полипептидами, например гормоны гипофиза, поджелудочной железы и др.
Можно назвать еще некоторые жизненно важные функции белков, в частности способность сохранять онкотическое давление в клетках и крови, буферные свойства, поддерживающие физиологическое значение рН внутренней среды, и др.
Таким образом, из этого далеко не полного перечня основных функций белков видно, что указанным биополимерам принадлежит исключительная и разносторонняя роль в живом организме. Если попытаться вычленить главное, решающее свойство, которое обеспечивает многогранность биологических функций белков, то следовало бы назвать способность белков строго избирательно, специфически соединяться с широким кругом разнообразных веществ. В частности, эта высокая специфичность белков обеспечивает взаимодействие ферментов с субстратами, антител с антигенами, транспортных белков крови с переносимыми молекулами других веществ и т. д. В случае ферментов это взаимодействие основано на принципе биоспецифического узнавания, завершающегося связыванием фермента с соответствующей молекулой, что содействует протеканию химической реакции. Высокой специфичностью действия наделены также белки, которые составляют молекулярную основу таких процессов, как дифференцировка и деление клеток, развитие живых организмов, обеспечивающее их биологическую индивидуальность.
Структура белков
Полимерная молекула белка образуетВнся при соединении в длинную цепочВнку бусинок-аминокислот. Они наниВнзываются на нить химических связей благодаря имеющимся у всех аминоВнкислот амино- и карбоксильной групВнпам, присоединённым к атому углеВнрода.
Образующиеся в результате такой реакции соединения называются пептидами. Соединяя аминокислоты посредством пептидных связей, можВнно получить пептиды, состоящие из остатков очень многих аминокислот. Такие соединения получили название полипептиды. Полипептидное строВнение белковой молекулы доказал в 1902 г. немецкий химик Эмиль ГерВнман Фишер.
В начале 50-х гг. XX в. американские химики Лайнус Карл Полинг (1901тАФ 1994), награждённый Нобелевской премией за исследования природы химической связи, и Роберт Кори (1897тАФ1971) предположили, что неВнкоторые участки аминокислотной цеВнпочки в белках закручены в спираль. Благодаря совершенствованию эксВнпериментальных методов (структуру белков изучают с помощью рентгеновВнских лучей) через несколько лет эта гениальная догадка подтвердилась.
Действительно, полипептидные цепи очень часто образуют спираль, закрученную в правую сторону. Это первый, самый низкий уровень проВнстранственной организации белкоВнвых цепочек. Позднее выяснилось, что спираль тАФ не единственный способ укВнладки аминокислотных цепочек. ПоВнмимо спиралей они образуют ещё и слои. Благодаря водородВнным связям могут ВлслипатьсяВ» сразу несколько разных фрагментов одной полипептидной цепи. В резульВнтате получается целый слой.
В большинстве белков спирали и слои перемежаются всевозможными изгибами и фрагментами цепи без какой-либо определённой структуры.
При изучении состава белков было установлено, что все они построены по единому принципу и имеют четыре уровня организации: первичную, вторичную, третичную, а отдельные из них и четвертичную структуры.
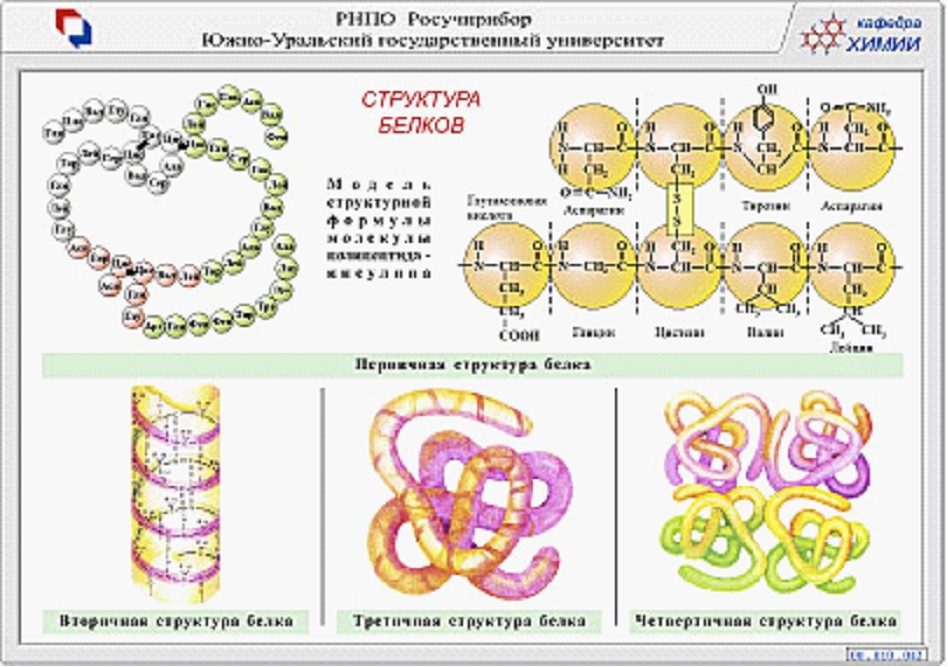
Первичная структура
Представляет собой линейную цепь аминокислот (полипептид), расположенных в определенной последовательности с четким генетически обусловленным порядком чередования и соединенных между собой пептидными связями.
К настоящему времени установлены последовательности аминокислот для нескольких тысяч различных белков. Запись структуры белков в виде развернутых структурных формул громоздка и не наглядна. Поэтому используется сокращенная форма записи тАФ трехбуквенная или однобуквенная.
Вторичная структура
Вторичной структурой называют конформацию, которую образует полипептидная цепь. Для высокомолекулярных белков характерна структура спирали.
Для полипептидных цепей известно несколько различных типов спиралей. Если при наблюдении вдоль оси спирали она удаляется от наблюдателя по часовой стрелке, то спираль считается правой (правозакрученной), а если удаляется против часовой стрелки тАФ левой (левозакрученной). Наиболее распространена правая α-спираль (предложена Л.Полингом и Р.Кори). Строение спирали стабилизируется внутримолекулярными водородными связями.
Третичная структура
Сведения о чередовании аминокислотных остатков в полипептидной цепи (первичная структура) и наличие в белковой молекуле спирализованных, слоистых и неупорядоченных ее фрагментов (вторичная структура) еще не дают полного представления ни об объеме, ни о форме, ни тем более о взаимном расположении участков полипептидной цепи по отношению друг к другу. Эти особенности строения белка выясняют при изучении его третичной структуры, под которой понимают тАФ общее расположение в пространстве составляющих молекул одной или нескольких полипептидных цепей, соединенных ковалентными связями. То есть третичная конфигурация тАФ реальная трехмерная конфигурация, которую принимает в пространстве закрученная спираль, которая в свою очередь свернута спиралью. У такой структуры в пространстве имеются выступы и впадины с обращенными наружу функциональными группами.
Полное представление о третичной структуре дают координаты всех атомов белка. Благодаря огромным успехом рентгеноструктурного анализа такие данные, за исключением координат атомов водорода получены для значительного числа белков. Это огромные массивы информации, хранящиеся в специальных банках данных на машиночитаемых носителях, и их обработка немыслима без применения быстродействующих компьютеров. Полученные на компьютерах координаты атомов дают полную информацию о геометрии полипептидной цепи, что позволяет выявить спиральную структуру, β-складки или нерегулярные фрагменты.
Первые пространственные модели молекул белка тАФ миоглобина и гемоВнглобина тАФ построили в конце 50-х гг. XX в. английские биохимики Джон Ко-удери Кендрю (родился в 1917 г.) и Макс Фердинанд Перуц (родился в 1914 г.). При этом они использовали данные экспериментов с рентгеновВнскими лучами. За исследования в обВнласти строения белков Кендрю и Перуц в 1962 г. были удостоены НобеВнлевской премии. А в конце столетия была определена третичная структура уже нескольких тысяч белков.
Четвертичная структура
У большинства белков пространственная организация заканчивается третичной структурой, но для некоторых белков с молекулярной массой больше 50-100 тысяч, построенных из несколько полипептидных цепей характерна четвертичная.
Сущность такой структуры в объединении несколько полимерных цепей в единый комплекс. Такой комплекс также рассматривается как белок, состоящий из нескольких субъединиц. Белки, состоящие из нескольких субъединиц, широко распространены в природе (гемоглобин, вирус табачной мозаики, фосфорилаза, РНК-полимераза). Субъединицы принято обозначать греческими буквами (так у гемоглобина имеется по две α- и β-субъединицы). Наличие нескольких субъединиц важно в функциональном отношении тАФ оно увеличивает степень насыщения кислородом.
Денатурация белков
Связи, поддерживающие пространстВнвенную структуру белка, довольно легВнко разрушаются. Мы с детства знаем, что при варке яиц прозрачный яичВнный белок превращается в упругую белую массу, а молоко при скисании загустевает. Происходит это из-за разВнрушения пространственной структуры белков альбумина в яичном белке и каВнзеина (от лат. caseus тАФ сыр) в молоВнке. Такой процесс называется денатуВнрацией. Денатурация белка тАФ разрушение сил (связей), стабилизирующих четвертичную, третичную и вторичную структуры, приводящее к дезориентации конфигурации белковой молекулы и сопровождаемое изменением растворимости, вязкости, химической активности, характера рассеивания рентгеновских лучей, снижением или полной потерей биологической функции.
В нашем примере в первом случае денатурацию вызывает нагревание, а во втором тАФ значиВнтельное увеличение кислотности (в результате жизнедеятельности обитаВнющих в молоке бактерий). При денаВнтурации белок теряет способность выполнять присущие ему в организме функции (отсюда и название процесВнса: от лат. denaturare тАФ лишать приВнродных свойств). Денатурированные белки легче усваиваются организмом, поэтому одной из целей термической обработки пищевых продуктов явВнляется денатурация белков.
Различают физические (температура, давление, механическое воздействие, ультразвуковое и ионизирующее излучения) и химические (тяжелые металлы, кислоты, щелочи, органические растворители, алкалоиды) факторы, вызывающие денатурацию.
Обратным процессом является ренатурация, то есть восстановление физико-химических и биологических свойств белка. Иногда для этого достаточно удалить денатурирующий объект. Ренатурация невозможна, если затронута первичная структура.
В природе почти ничего не происхоВндит случайно. Если белок принял определённую форму в пространстве, это должно служить достижению каВнкой-то цели. Действительно, только беВнлок с ВлправильнойВ» пространственной структурой может обладать опредеВнлёнными свойствами, т. е. выполнять те функции в организме, которые ему предписаны. А делает он это с помоВнщью всё тех же R-групп аминокислот. Оказывается, боковые цепи не тольВнко поддерживают ВлправильнуюВ» форВнму молекулы белка в пространстве. R-группы могут связывать другие оргаВннические и неорганические молекулы, принимать участие в химических реВнакциях, выступая, например, в роли каВнтализатора.
Биологические катализаторы
В основе всех жизненных процессов лежат тысячи химических реакций. Они идут в организме без применения высокой температуры и давления, т. е. в мягких условиях. Вещества, которые окисляются в клетках человека и животных, сгорают быстро и эффективно, обогащая организм энергией и строительным материалом. Но те же вещества могут годами храниться как в консервированном (изолированном от воздуха) виде, так и на воздухе в присутствие кислорода. Возможность быстрого переваривания продуктов в живом организме осуществляется благодаря присутствию в клетках особых биологических катализаторов - ферментов.
У них есть свой секрет, который позволяет им работать гораздо эффективнее других катализаторов, ускоряя реакВнции в миллиарды раз.
Предположим, что несколько приВнятелей никак не могут встретиться. Но стоило одному из них пригласить друзей на день рождения, как резульВнтат не заставил себя ждать: все оказаВнлись в одном месте в назначенное время.
Чтобы встреча состоялась, понадоВнбилось подтолкнуть друзей к контакВнту. То же самое делает и фермент. В его молекуле есть так называемые центры связывания. В них расположеВнны привлекательные для определёнВнного типа химических соединений (и только для них!) Влуютные креслаВ» тАФ R-группы, связывающие какие-то учаВнстки молекул реагирующих веществ. Например, если одна из молекул имеВнет неполярную группу, в центре свяВнзывания находятся гидрофобные боВнковые цепи. Если же в молекуле есть отрицательный заряд, его будет подВнжидать в молекуле фермента R-группа с положительным зарядом.
В результате обе молекулы реагенВнтов связываются с ферментом и окаВнзываются в непосредственной близоВнсти друг от друга. Мало того, те их группы, которые должны вступить в химическую реакцию, сориентироваВнны в пространстве нужным для реакВнции образом. Теперь за дело приниВнмаются боковые цепи фермента, играющие роль катализаторов. В ферВнменте все ВлпродуманоВ» таким обраВнзом, что R-группы-катализаторы тоже расположены вблизи от места собыВнтий, которое называют активным центром. А после завершения реакВнции фермент Влотпускает на волюВ» моВнлекулы-продукты.
Ферменты - это специфические белки, входящие в состав всех клеток и тканей живых организмов и играющие роль биологических катализаторов. О ферментах люди узнали давно. Еще в начале прошлого века в Петербурге К.С.Кирхгоф выяснил, что проросший ячмень способен превращать полисахарид крахмала в дисахарид мальтозу, а экстракт дрожжей расщеплял свекловичный сахар на моносахариды - глюкозу и фруктозу. Это были первые исследования в ферментологии. Хотя на практике применение ферментативных процессов было известно с незапамятных времен (сбраживание винограда, сыроварение и др.).
В разных изданиях применяются два понятия: "ферменты" и "энзимы". Эти названия идентичны. Они обозначают одно и тоже - биологические катализаторы. Первое слово переводится как "закваска", второе - "в дрожжах".
Долгое время не представляли, что же происходит в дрожжах, какая сила, присутствующая в них, заставляет вещества разрушаться и превращаться в более простые. Только после изобретения микроскопа было установлено, что дрожжи - это скопление большого количества микроорганизмов, которые используют сахар в качестве своего основного питательного вещества. Иными словами, каждая дрожжевая клетка "начинена" ферментами способными разлагать сахар. Но в то же время были известны и другие биологические катализаторы, не заключенные в живую клетку, а свободно "обитающие" вне ее. Например, они были найдены в составе желудочных соков, клеточных экстрактов. В связи с этим в прошлом различали два типа катализаторов: считалось, что собственно ферменты неотделимы от клетки и вне ее не могут функционировать, т.е. они "организованы". А "неорганизованные" катализаторы, которые могут работать вне клетки, называли энзимами. Такое противопоставление "живых" ферментов и "неживых" энзимов объяснялось влиянием виталистов, борьбой идеализма и материализма в естествознании. Точки зрения ученых разделились. Основоположник микробиологии Л.Пастер утверждал, что деятельность ферментов определяется жизнью клетки. Если клетку разрушить, то прекратиться и действие фермента. Химики во главе с Ю.Лбихом развивали чисто химическую теорию брожения, доказывая, что активность ферментов не зависит от существования клетки.
Работы А.Н. Лебедева по исследованию дрожжевых клеток и труды других ученых положили конец виталистическим представления в теории биологического катализа, а термины "фермент" и "энзим" стали применять как равнозначные.
В наши дни ферментология - это самостоятельная наука. Выделено и изучено около 2 тысяч ферментов.
Важнейшим свойством ферментов является преимущественное одной из нескольких теоретически возможных реакций. В зависимости от условий ферменты способны катализировать как прямую, так и обратную реакцию. Это свойство ферментов имеет большое практическое значение.
Другое важнейшее свойство ферментов - термолабильность, т. е. высокая чувствительность к изменениям температуры. Так как ферменты являются белками, то для большинства из них температура свыше 70ЛЪС приводит к денатурации и потере активности. При увеличении температуры до 10ЛЪС реакция ускоряется в 2-3 раза, а при температурах близких к 0ЛЪС скорость ферментативных реакций замедляется до минимума.
Следующим важным свойством является то, что ферменты находятся в тканях и клетках в неактивной форме (проферменте). Классическими его примерами являются неактивные формы пепсина и трипсина. Существование неактивных форм ферментов имеет большое биологическое значение. Если бы пепсин вырабатывался сразу в активной форме, то пепсин "переваривал" стенку желудка, т. е. желудок "переваривал" бы сам себя.
Когда в пищеварительном тракте или в эксперименте белки расщепляются на более простые соединения, то через ряд промежуточных стадий (альбумоз и пептонов) они расщепляются на полипептиды и, наконец, на аминокислоты. Аминокислоты в отличие от белков легко всасываются и усваиваются организмом. Они используются организмом для образования собственного специфического белка. Если же вследствие избыточного поступления аминокислот их расщепление в тканях продолжается, то они окисляются до углекислого газа и воды.
Большинство белков растворяется в воде. Молекулы белков в силу их больших размеров почти не проходят через поры животных или растительных мембран. При нагревании водные растворы белков свертываются. Есть белки (например, желатина), которые растворяются в воде только при нагревании.
При поглощении пища сначала попадает в ротовую полость, а затем по пищеводу в желудок. Чистый желудочный сок бесцветен, имеет кислую реакцию. Кислая реакция зависит от наличия соляной кислоты, концентрация которой составляет 0,5%.
Желудочный сок обладает свойством переваривать пищу, что связано с наличием в нем ферментов. Он содержит пепсин - фермент, расщепляющий белок. Под влиянием пепсина белки расщепляются на пептоны и альбумозы. Железами желудка пепсин вырабатывается в неактивном виде, переходит в активную форму при воздействии на него соляной кислоты. Пепсин действует только в кислой среде и при попадании в щелочную среду становится негативным.
Пища, поступив в желудок, более или менее длительное время задерживается в нем - от 3 до 10 часов. Срок пребывания пищи в желудке зависит от ее характера и физического состояния - жидкая она или твердая. Вода покидает желудок немедленно после поступления. Пища, содержащая большее количество белков, задерживается в желудке дольше, чем углеводная; еще дольше остается в желудке жирная пища. Передвижение пищи происходит благодаря сокращению желудка, что способствует переходу в пилорическую часть, а затем в двенадцатиперстную кишку уже значительно переваренной пищевой кашицы.
Пищевая кашица, поступившая в двенадцатиперстную кишку, подвергается дальнейшему перевариванию. Здесь на пищевую кашицу изливается сок кишечных желез, которыми усеяна слизистая оболочка кишки, а также сок поджелудочной железы и желчь. Под влиянием этих соков пищевые вещества - белки, жиры и углеводы - подвергаются дальнейшему расщеплению и доводятся до такого состояния, когда могут всосаться в кровь и лимфу.
Поджелудочный сок бесцветен и имеет щелочную реакцию. Он содержит ферменты, расщепляющие белки, углеводы и жиры.
Одним из основных ферментов является трипсин, находящийся в соке поджелудочной железы в недеятельном состоянии в виде трипсиногена. Трипсиноген не может расщеплять белки, если не будет переведен в активное состояние, т.е. в трипсин. Трипсиноген переходит в трипсин при соприкосновении с кишечным соком под влиянием находящегося в кишечном соке вещества энтерокиназы. Энтерокиназа образуется в слизистой оболочке кишечника. В двенадцатиперстной кишке действие пепсина прекращается, так как пепсин действует только в кислой среде. Дальнейшее переваривание белков продолжается уже под влиянием трипсина.
Трипсин очень активен в щелочной среде. Его действие продолжается и в кислой среде, но активность падает. Трипсин действует на белки и расщепляет их до аминокислот; он также расщепляет образовавшиеся в желудке пептоны и альбумозы до аминокислот.
В тонких кишках заканчивается переработка пищевых веществ, начавшаяся в желудке и двенадцатиперстной кишке. В желудке и двенадцатиперстной кишке белки, жиры и углеводы расщепляются почти полностью, только часть их остается не переваренной. В тонких кишках под влиянием кишечного сока происходит окончательное расщепление всех пищевых веществ и всасывание продуктов расщепления. Продукты расщепления попадают в кровь. Это происходит через капилляры, каждый из которых подходит к ворсинке, расположенной на стенке тонких кишок.
Обмен белков
После расщепления белков в пищеварительном тракте образовавшиеся аминокислоты всасываются в кровь. В кровь всасывается также незначительное количество полипептидов - соединений, состоящих из нескольких аминокислот. Из аминокислот клетки нашего тела синтезируют белок, причем белок, который образуется в клетках человеческого организма, отличается от потребленного белка и характерен для человеческого организма.
Образование нового белка в организме человека и животных идет беспрерывно, так как в течении всей жизни взамен отмирающих клеток крови, кожи, слизистой оболочки, кишечника и т. д. создаются новые, молодые клетки. Для того чтобы клетки организма синтезировали белок, необходимо, чтобы белки поступали с пищей в пищеварительный канал, где они подвергаются расщеплению на аминокислоты, и уже из всосавшихся аминокислот будет образован белок.
Если же, минуя пищеварительный тракт, ввести белок непосредственно в кровь, то он не только не может быть использован человеческим организмом, он вызывает ряд серьезных осложнений. На такое введение белка организм отвечает резким повышением температуры и некоторыми другими явлениями. При повторном введении белка через 15-20 дней может наступить даже смерть при параличе дыхания, резком нарушение сердечной деятельности и общих судорогах.
Белки не могут быть заменены какими-либо другими пищевыми веществами, так как синтез белка в организме возможен только из аминокислот.
Для того чтобы в организме мог произойти синтез присущего ему белка, необходимо поступление всех или наиболее важных аминокислот.
Из известных аминокислот не все имеют одинаковую ценность для организма. Среди них есть аминокислоты, которые могут быть заменены другими или синтезированными в организме из других аминокислот; наряду с этим есть и незаменимые аминокислоты, при отсутствии которых или даже одной из них белковый обмен в организме нарушается.
Белки не всегда содержат все аминокислоты: в одних белках содержится большее количество необходимых организму аминокислот, в других - незначительное. Разные белки содержат различные аминокислоты и в разных соотношениях.
Белки, в состав которых входят все необходимые организму аминокислоты, называются полноценными; белки, не содержащие всех необходимых аминокислот, являются неполноценными белками.
Для человека важно поступление полноценных белков, так как из них организм может свободно синтезировать свои специфические белки. Однако полноценный белок может быть заменен двумя или тремя неполноценными белками, которые, дополняя друг друга, дают в сумме все необходимые аминокислоты. Следовательно, для нормальной жизнедеятельности организма необходимо, чтобы в пище содержались полноценные белки или набор неполноценных белков, по аминокислотному содержанию равноценных полноценным белкам.
Поступление полноценных белков с пищей крайне важно для растущего организма, так как в организме ребенка не только происходит восстановление отмирающих клеток, как у взрослых, но и в большом количестве создаются новые клетки.
Обычная смешанная пища содержит разнообразные белки, которые в сумме обеспечивают потребность организма в аминокислотах. Важна не только биологическая ценность поступающих с пищей белков, но и их количество. При недостаточном количестве белков нормальный рост организма приостанавливается или задерживается, так как потребности в белке не покрываются из-за его недостаточного поступления.
К полноценным белкам относятся преимущественно белки животного происхождения, кроме желатины, относящейся к неполноценным белкам. Неполноценные белки - преимущественно растительного происхождения. Однако некоторые растения (картофель, бобовые и др.) содержат полноценные белки. Из животных белков особенно большую ценность для организма представляют белки мяса, яиц, молока и др.
Для чего в гемоглобине железо
В природе существуют белки, в коВнторых помимо аминокислот содерВнжатся другие химические компоненВнты, такие, как липиды, сахара, ионы металлов. Обычно эти компоненты играют важную роль при выполнеВннии белком его биологической функВнции. Так, перенос молекул и ионов из одного органа в другой осуществляВнют транспортные белки плазмы крови. Белок гемоглобин (от греч. gemo - кровь и лат. globes - шар, шарик), содержащийся в кровяных клетках тАФ эритроцитах (от греч. eritros тАФ красный и kites тАФ клетка), доставляет кисВнлород от лёгких к тканям. В молекуВнле гемоглобина есть комплекс иона железа со сложной органической молекулой, называемый гемом. ГемоВнглобин состоит из четырёх белковых субъединиц, и каждая из них содерВнжит по одному гему.
В связывании кислорода в лёгких принимает участие непосредственно ион железа. Как только к нему хотя бы в одной из субъединиц присоединяВнется кислород, сам ион тут же чуть-чуть меняет своё расположение в моВнлекуле белка. Движение железа ВлпроВнвоцируетВ» движение всей аминокисВнлотной цепочки данной субъединицы, которая слегка трансформирует свою третичную структуру. Другая ещё не присоединившая субъедиВнница, кислород, ВлчувствуетВ», что произошло с соВнседкой. Её структура тоже начинает меняться. В итоге вторая субъединиВнца связывает кислород легче, чем перВнвая. Присоединение кислорода к третьей и четвёртой субъединицам происходит с ещё меньшими трудноВнстями. Как видно, субъединицы помоВнгают друг другу в работе. Для этого-то гемоглобину и нужна четвертичная структура. Оксид углерода СО (в проВнсторечии угарный газ) связывается с железом в геме в сотни раз прочнее кислорода. Угарный газ смертельно опасен для человека, поскольку лиВншает гемоглобин возможности приВнсоединять кислород.
Это интересно!
Медная кровь
В холодных водах Перуанского течения в Тихом океане обитает кальмар Dosidicus gigas. Его сигарообразное тело вместе со щупальцами достигает в длину 3,5 м, а масса гиганта может превышать 150 кг. Мощные мышцы выбрасывают струю воды с силой, с какой она бьёт из пожарного рукава, благодаря чему кальмар способен двигаться со скоростью до 40 км/ч. Клювом, очень крепким и острым, он может перебить стальной кабель. По свидетельству очевидцев, кальмар буквально в клочья раздирает 20-килограммовую рыбину. Этот свирепый хищник очень опасен и для человека. В книге Франка Лейна ВлЦарство осьминогаВ» утверждается, что Влчеловек, упавший за борт в местах, где обитает много кальмаров, не проживёт и полминутыВ».
Чтобы ВлзарядитьсяВ» энергией, этому обитателю океана требуется много кислорода - не менее 50л в час. Поступающий из морской воды кислород разносится по телу кальмара с помощью особого белка, содержащего медь, - гемокианина (от греч. gemo - кровь и kianos - лазурный, голубой).
Стоит заметить, что в крови позвоночных кислород ВлтранспортируютВ» атомы железа в составе гема - особой сложной молекулы, которая входит в состав белка гемоглобина. Им буквально нашпигованы красные кровяные клетки - эритроциты. Молекула гемоглобина содержит четыре гемовых фрагмента, каждый из которых способен связать молекулу кислорода. В отличие от гемоглобина, в гемокианине атомы меди непосредственно связаны с белковыми молекулами, которые не включены ни в какие клетки, а свободно ВлплаваютВ» в крови. Зато одна молекула гемокианина способна связать до 200 атомов меди. И ещё одна особенность гемокианина - его молекулы имеют огромные даже для белков размеры. У ВлобычныхВ» белков, входящих в состав яиц, молока, мыши, молекулярная масса колеблется в пределах от 6 тыс. до 1 млн., а молекулярная масса гемокианина может достигать 10 млн.! Это один из самых крупных белков; больше по размеру и массе - только белковые комплексы у вирусов.
Гемокианин - очень древний белок. Он устроен проще, чем гемоглобин и не так эффективен. Тем не менее при малом содержании кислорода в морской воде гемокианин довольно успешно снабжает им ткани холоднокровных животных. Так, давление кислорода в жабрах лангуста составляет всего 7 мм рт. ст. (930 Па), а в тканях - 3 мм рт. ст.; причём концентрация этого газа в крови лангуста в 20 раз выше, чем в морской воде.
Кроме кальмаров, кислород переносится Влголубой кровьюВ» также у десятиногих ракообразных (омары, крабы, креветки). Гемокианин найден у всех головоногих моллюсков (осьминоги, кальмары, каракатицы), разнообразных улиток, пауков и др. А вот у морских гребешков, устриц и других двустворчатых моллюсков его нет.
Количество гемокианина в крови может быть самым разным. Так, у шустрых осьминога и мечехвоста (морское животное типа членистоногих) концентрация этого необычного белка доходит до 10г в 100мл крови - почти столько же гемоглобина в крови человека. В то же время, у малоподвижного съедобного моллюска морское ушко Hatiotis tuberculata в 100мл крови всего 0,03г гемокианина. Это и понятно: чем более активно животное, чем больше кислорода необходимо ему для восполнения энергетических затрат, тем выше в крови концентрация белка, переносящего кислород.
Гемокианин был открыт в 60-х годах XIXв., когда биологи заметили, что кровь головоногих моллюсков при прохождении через жабры окрашивается в голубой цвет. А в 1878г. бельгийский физиолог Леон Фредерик доказал, что голубой цвет вызван реакцией кислорода с медьсодержащим белком, который он назвал гемокианином. Когда последний теряет кислород, он, в отличие от гемоглобина, становится бесцветным. Примечательно, что всю работу по изучению нового белка Фредерик выполнил в течение одного дня.
Из гемокианина нетрудно полностью извлечь медь. Для этого достаточно обработать белок в отсутствии кислорода реактивом, который прочно связывается с ионами одновалентной меди. Таким же способом можно определить содержание меди в гемокианине. Лишённый этого металла, он теряет способность переносить кислород. Но если потом ввести в раствор белка ионы меди, гемокианин восстанавливает свою физиологическую активность. Так было доказано, что в отсутствие кислорода медь гемокианина находится в степени окисления +1. При избытке же этого газа происходит частичное окисление металла. При этом всегда на одну связанную гемокианином молекулу кислорода приходится два атома меди. Таким образом, кислород окисляет ровно половину атомов меди. Это ещё одно отличие гемокианина от значительно более распространённого в животном мире гемоглобина, в котором все атомы железа равноценны и имеют заряд +2 как в свободном состоянии, так и в комплексе с кислородом.
Что записано в генах
Последовательность аминокислот в белках кодируется генами, которые хранятся и передаются по наследству с помощью молекул ДНК. Пространственную структуру белка задаёт именно порядок расположеВнния аминокислот. Получается, что не только первичная, но и вторичная, третичная и четвертичная структуры белков составляют содержание наВнследственной информации. СледоВнвательно, и выполняемые белками функции запрограммированы генеВнтически. Громадный перечень этих функций позволяет белкам по праву называться главными молекулами жизни. Поэтому сведения о белках и есть то бесценное сокровище, котоВнрое передаётся в природе от поколеВнния к поколению.
Интерес человека к этим органиВнческим соединениям с каждым годом только увеличивается. Сегодня учёные уже расшифровали структуру многих белковых молекул. Они выясняют функции самых разных белков, пытаВнются определить взаимосвязь функВнций со структурой. Установление сходства и различий у белков, выполВнняющих аналогичные функции у разВнных живых организмов, позволяет глубже проникать в тайны эволюции.
Откуда берется иммунитет
Как уже отмечалось выше, белки выполняют в организме мноВнжество функций; они, например, заВнщищают клетки от нежелательных вторжений, предохраняют их от поВнвреждений. Специальные белки тАФ антитела обладают способностью распознавать проникшие в клетки бактерии, вирусы, чужеродные полиВнмерные молекулы и нейтрализовывать их.
У высших позвоночных от чужеВнродных частиц организм защищает иммунная система. Она устроена так, что организм, в который вторгВнлись такие ВлагрессорыВ» тАФ антигены, начинает вырабатывать антитела. Молекула антитела прочно связываВнется с антигеном: у антител, как и у ферментов, тоже есть центры связыВнвания. Боковые цепи аминокислот расположены в центрах таким обраВнзом, что антиген, попавший в эту лоВнвушку, уже не сможет вырваться из Влжелезных лапВ» антитела. После свяВнзывания с антителом враг выдворяетВнся за пределы организма.
Можно ввести в организм небольВншое количество некоторых полимерВнных молекул, входящих в состав бакВнтерий или вирусов-возбудителей какой-либо инфекционной болезни. В организме немедленно появятся соответствующие антитела. Теперь попавший в кровь или лимфу ВлнастоВнящийВ» болезнетворный микроб тотВнчас же подвергнется атаке этих антиВнтел, и болезнь будет побеждена. Такой способ борьбы с инфекцией есть не что иное, как нелюбимая многими прививка. Благодаря ей организм приобретает иммунитет к инфекциВнонным болезням.
Аминокислоты тАУ показатели возраста
Аминокислоты D- и L-формы обладают способностью очень медленно превращаться друг в друга. За определённый (весьма длительный) период времени чистая D- или L-форма может стать смесью равных количеств обеих форм. Такая смесь называется раиемагом, а сам процесс тАФраиемизаиией. Скорость раиемизации зависит от температуры и типа аминоВнкислоты. Данное свойство можно использовать для определения возрасВнта ископаемых остатков организмов, а при необходимости тАФ и живых существ. Например, в белке дентина (дентин тАФ костная ткань зубов) парагиновая кислота самопроизвольно раиемизуется со скоростью 0,1% в год. У детей в период формирования зубов в дентине содержится тольВнко аспарагиновая кислота. Дентин выделяют из зуба и определяют в нём содержание 0-формы. Результаты теста достаточно точны. Так, для 97-летВнней женщины, возраст которой был документально засвидетельствован, тест показал возраст 99 лет. Данные исследований, выполненных на исВнкопаемых остатках доисторических животных тАФ слонов, дельфинов, медВнведей, тАФ хорошо согласуются с результатами датирования, полученными радионуклидным методом.
Заключение
В данной работе были рассмотрены химические и физические свойства белков, классификация белков, состав и строение белков, были рассмотрены разнообразные функции белков, а также их значение.
Наукой было установлено, что белки, как обязательная составная часть всех живых клеток, играют исключительно важную роль в живой природе, являются главным, наиболее ценным и незаменимым компонентом питания. Это связанно с той огромной ролью, которую они играют в процессах развития и жизни человека. Белки являются основой структурных элементов и тканей, поддерживают обмен веществ и энергии, участвуют в процессах роста и размножения, обеспечивают механизмы движений, развитие иммунных реакций, необходимы для функционирования всех органов и систем организма.
У белков очень сложное строение и выявить структуру молекул белков тоже достаточно сложно.
Первый белок, у которого была расшифрована первичная структура, был инсулин. Это случилось в 1954 году. Для этого понадобилось около 10 лет. Синтез белков - очень сложная задача, и если ее решить, то возрастет количество ресурсов для дальнейшего использования их в технике, медицине иВат.д., а также уже возможен биохимический и синтетический способы получения пищи.
Академик А.Н. Несмеянов провел широкие исследования в области создания микробиологической промышленности по производству искусственных продуктов питания. Практическое осуществление путей получения такой пищи ведется в двух основных направлениях. Одно из них основано на использовании белков растений, например сои, а второе - на использовании белков продуктов, полученных микробиологическим путем из нефти.
В природе широко представлена автоматическая самосборка надмолекулярных структур и инициатором ее являются белковые молекулы. Это дает надежду выяснить закономерности формообразования у растений и животных и понять молекулярные механизмы, обеспечивающие сходство родителей и детей.
Чем глубже химики и биологи познают природу и строение белковых молекул, тем более они убеждаются в исключительном значении получаемых данных для раскрытия тайны жизни. Раскрытие связи между структурой и функцией в белковых веществах - вот краеугольный камень, на котором покоится проникновение в самую глубокую сущность жизненных процессов, вот та основа, которая послужит в будущем исходным рубежом для нового качественного скачка в развитии биологии и медицины.
"Жизнь - это форма существования белка"
Список использованной литературы:
- ВлХИМИЯтАФсправочник для абитуриентов и студентовВ». Издательство acT-Фолио, М., 2000.
- Большая медицинская энциклопедия.
- ВлЭнциклопедия для детей. ХимияВ». Аванта+, М., 2000.
- Албертс Б., Брей Д., и др. Молекулярная биология клетки, М., 1994.
- Березин Б.Д., Березин Д.Б. Курс современной органической химии. Учебное пособие для вузов. тАФМ.: Высшая школа, 1999.
- Кнорре Д.Г., Мызина С.Д. Биологическая химия. тАФМ.: Высшая школа, 1998.
- Общая органическая химия. Под ред. Д. Бартона, У.Д. Оллиса. Нуклеиновые кислоты, аминокислоты, петиды, белки. тАФМ.: Химия, 1986.
- Филлпович Ю.Б. Основы биохимии: уч. для студ. хим. и биол. спец. пед. инст. М.:Высшая школа, 1985.
- Шамин А.Н. История химии белка. тАФМ., ВлНаукаВ», 1977.
- Якубке Х.-Д., Ешкайт Х. Аминокислоты, пептиды, белки. М., ВлМирВ», 1985.
Вместе с этим смотрят:
Интерстициальные клетки КэйжделаИскусственный отбор и селекцияИспользование фитонцидных растений для оздоровления воздуха помещенийИсследование клеточного цикла методом проточной цитометрии