Конспект лекций по биофизике
Биофизика как наука
Биофизика тАУ это наука, изучающая физические и физико-химические процессы, протекающие в биосистемах на разных уровнях организации и являются основой физиологических актов. Возникновение биофизики произошло, как прогресс в физике, вклад внесли математика, химия и биология.
Живые огранизмы тАУ открытая, саморегулирующаяся, самовоспроизводящаяся и развивающаяся гетерогенная система, важнейшими функциональными веществами в которой являются биополимеры: белки и нуклеиновые кислоты сложного атомно-молекулярного строения.
Задачи биофизики:
1. Раскрытие общих закономерностей поведения открытых неравновесных систем. Теоретическое обоснование термодинамических (т/д) основ жизни.)
2. Научное истолкование явлений индивидуального и эволюционного развития, саморегуляции и самовоспроизведения.
3. Выяснение связей между строением и функциональными свойствами биополиметов и других биологически активных веществ.
4. Создание и теоретическое обоснование физ-хим методов исследования биообъектов.
5. Физическое истолкование обширного комплекса функциональных явлений (генерация и распределение нервного импульса, мышечное сокращение, рецепция, фотосинтез и др.)
Разделы биофизики:
1. Молекулярная тАУ изучает строение и физ-хим свойства, биофизику молекул.
2. Биофизика клетки тАУ изучает особенности строения и функционирования клеточных и тканевых систем.
3. Биофизика сложных систем тАУ изучает кинетику биопроцессов, поведение во времени разнообразных процессов присущих живой материи и термодинамику биосистем.
Термодинамика биологических процессов
1. Предмет и практическая значимость т/д биосистем. Подходы: феноменологический и детальный. Значение имеют т/д параметры только в исходном и конечном состоянии. Термодинамика тАУ это наука, изущающая наиболее общие закономерности превращения различных видов энергии в системе.
2. Практическая значимость т/д в биологии. Позволяет оценить энергетические изменения, происходящие в результате биохимических реакций; рассчитать энергию разрыва конкретных хим связей; рассчитать осмотическое давление по обе стороны полупроницаемой мембраны; рассчитать влияние концентрации соли в растворе на растворимость макромолекул. Применяется для описания процессов, протекающих в электрохимических ячейках. Привлекается для обоснования теории возникновения и эволюции жизни на Земле.
3. Понятие т/д систем, виды т/д систем. Система тАУ совокупность взаимодействующих между собой относительно элементарных структур или процессов, объединяющихся в целое выполнением некоторой общей функции, несводимой к функциям ее компонентов. Т/д система тАУ часть пространства с материальным содержимым, ограниченная оболочкой.
а) изолированные (не обмениваются с окружающей средой ни веществом, ни энергией),
б) замкнутые (обмениваются энергией),
в) открытые (обмениваются веществом и энергией).
Параметры:
- экстенсивные, зависят от количества вещества в системе (масса, объем),
- интенсивные, не зависят от количества вещества в системе (давление, t0).
Первое начало термодинамики
dQ = dU - dW
Количество теплоты, поступающей в систему расходуется на увеличение внутренней энергии системы за вычетом совершенной работы.
dW = pdV + dW'max
Работа равна произведению давления на изменившийся объем плюс максимально полезная работа против внешнего давления по изменению объема системы.
Живые организмы не являются источников новой энергии. Окисление поступающих в живой организм питательных веществ приводит к высвобождению в нем эквивалетного количества энергии.
......... тАУ определение питательных веществ, поступающих в организм. Металлический сосуд с теплоизолирующими стенками в который помещаются исследуемые питательные вещества, затем их сжигают с помощью высоковольтных разрядов и измерают теплоту сгорания.
1 г белка тАУ 5,4 ккал (4,1 ккал до мочевины)
1 г жира тАУ 9,3 ккал
1 г углеводов тАУ 4,1 ккал
Определение расхода энергии в течение суток. Метод прямой или непрямой калориметрии.
Прямой: Камера "ледяной калориметр". Теплоизолирующий материал, лед, лабораторное животное (человек). Энергия, высвобождающаяся из организма эквивалентна поступающей в организм
Непрямой: С полным и неполным газовым анализом.
ДК = выд СО2 в ед t / погл О2 в ед t
Производят сравнение состава и объема вдыхаемого и выдыхаемого воздуха. Используют мешок Дугласа. Для анализа используют газоанализаторы: ГА Холдейна: система стеклянных трубочек, поглощающая CO2 и O2. Сейчас ГА с поглощением световых потоков.
Нормальный дыхательный коэффициент 0,85В±0,03. Нахождение КЭК (калориметрический эквивалент кислорода) тАУ численно равен количеству энергии, высвобождающейся в организме при потреблении 1 л О2. Рисунок ДК = 1, КЭК = 5,05; 0,8; 4,8; 0,7; 4,69; 0,85; 4,86.
В клинических условиях используют неполный газовый анализатор, не считают СО2. Считают объем поглощенного О2 с помощью спирографа (аппарат метатест). Диаграмма под наклоном, из замкнутой системы постепенно уходит О2, Х отражает объем поглощенного O2 из системы 1 см≈400 мл. ДК принимается равным здесь 0,85.
1 л тАУ 4,86 ккал
400 мл тАУ х
Второе начало термодинамики
показывает в каком направлении происходит перемещение энергии в изолированных системах.
Энтропия S в т/д имеет троякий смысл:
если в т/д системе происходят процессы, связанные с выделением или поглощением тепла, то эта система при любой t0 способна поглотить некоторое дополнительное количество тепла. Величина, характеризующая тепловую емкость системы и является функцией t0 тАУ S.
1. Тепловая емкость системы.
2. Т/д функция состояния системы, являющаяся мерой ее неупорядоченности.
лед S = 9.8, жидкость S = 16.7, газ S = 45.1
3. Мера вероятности системы, имеет статистический характер. Впервые установил Больцман.
S = k*lgW
Т/д вероятность тАУ это количество микросостояний, возможных в пределах данного макросостояния. Все микросостояния, определяющие т/д вероятность имеют одинаковую математическую вероятность. Математическая вероятность тАУ это среднее значение частоты появления события при массовых испытаниях.
В изолированных системах необратимые т/д процессы протекают в направлении возрастания энтропии. S полностью обратимых т/д процессов сохраняет постоянное значение. Теплота тАУ это особый вид энергии (низкого качетва) не может переходить без потери в другие виды энергии. Тепловая энергия связана с хаотическим движением молекул, остальные виды энергии базируются на упорядоченном движении молекул.
Дриллюэн создал классификацию видов энергии по способности вида энергии превращаться в другие виды энергии.
A. тАУ max эффективная, превращается во все другие виды энергии. Гравитационная, ядерная, световая, электрическая,
B. тАУ химическая,
C. тАУ тепловая. Деградация высших типов энергии в энергию низших типов тАУ основное эволюционное свойство изолированных систем.
Рисунок
Т/д потенциал
Задачи т/д:
1. Определение величины работы, совершаемой в системе.
2. Характеристические функции состояния системы изменения которых численно равно полезной работе при условии постоянства определенных т/д параметров.
dU=dQ-dW
dS=dQ/T связ энергия
dQ=TdS
dWmax=TdS-dU
dWmax= dW'max полез +pdV
(бесполезная работа тАУ работа против сил внешнего давления)
dWmax=TdS-dU-pdV
1) V, T = const
2) P, T = const
Рассмотрим первый случай
Если V, T = const, то pdV=0, то dWmax=TdS-dU=-d(U-TS)=-dF
F=U-TS тАУ термодинамический потенциал Гельм-Гольци или свободная энергия Гельм-Гольца
Рассмотрим второй случай
Если P, T = const, то dWmax=-d(U+pdV-TS)=-dG
G тАУ т/д потенциал Гиббса или свободная энергия Гиббса
В реальных условиях редко Р постоянно, а V системы изменяется, следовательно величины т/д потенциалов совпадают.
Т/д потенциалы делают заключения
1. Выполенение полезной работы при выполнении необратимого процесса всегда сопровождается рассеянием энергии, величину которой определяет произведением TdS, чем больше эта величина, тем более необратимым является процесс. Для абсолютно обратимых процессов
2. По знаку и величине т/д потенциала можно судить о направленности процесса, если в результате процесса величина т/д потенциалов уменьшается, такой процесс является самопроизвольным, идет с выделением энергии и называется экзергоническим, если т/д потенциалы увеличивается, то процесс идет не самопроизвольный, требует притока энергии извне и называется эндергоническим.
3. При достижении равновесия т/д потенциалы стремятся к минимальному значению.
Процессы превращений энергии и совершения работы могут протекать до тех пор пока свободная энергия не станет равна нулю, а энтропия максимальной. Такое состояние носит названия т/д равновесия.
Такое состояние в неживой природе является конечным состоянием, в направле6нии которого эволюционируют все т/д системы.
КПД
КПД тАУ это отношение произведенной работы к изменению свободной энергии, затраченной на эту работу. КПД = W/dF Í 1 КПД может выражаться в абсолютных единицах или процентах. Согласно второму закону т/д, КПД обратимого процесса должно быть равно 1. КПД необратимых процессов < 1. КПД реальных биологических процессов < 1. Приблизительное значение КПД реальных биологических процессов:
Гликолиз тАУ 36%
Ф/с тАУ75%
Окислительное фосфорилирование тАУ 55%
Сокращение мышц тАУ 40%
Свечение бактерий тАУ 96%
Градиенты
Биологические системы характеризуются наличием большого количества градиентов (осмотический, электрический, концентрационныйтАж)
Градиент какого-либо т/д параметра изменяется с расстоянием
Рисунок
ТР=ΔΤ/ Δυ
ТР тАУ направление от большого значения параметра к меньшему.
Биосистема способна совершать работу, если в ней имеется градиент. Градиент тАУ своеобразное депо энергии.
F свободная энергия F = RTlnФ1/Ф2
Ф значение т/д параметров в 1 и 2 точках
Совершение работы в системе связано с реализацией этой свободной энергии. Если совершается работа, то градиент, за счет энергии которого это происходит, уменьшается, но параллельно возникает другой градиент противоположной направленности. При необратимых процессах величина второго градиента будет меньше, чем величина первого.
Применимость второго закона т/д для характеристики свойств био систем
1. Второй закон т/д был сформулирован для характристики изолированных систем. Реальные биологические системы являются открытыми.
2. Значение энтропии строго определено для равновесного состояния. Био системы в своем развитии проходят через целый ряд неравновесных состояний.
Энтропия и другие функции состояния могут быть определены в любой момент изменения неравновесного состояния или энтропии и др функций состояния является непрерывными и однозначными функциями т/д параметров и времени.
В открытой системе
dS=dQ'/T+dQ/T
dQ'/T тАУ тепло в самой ситеме
dQ/T тАУ тепло, которым система может обмениваться со средой
diS=dQ'/T тАУ внутренний источник энтропии
deS=dQ/T тАУ внешний источник энтропии
dS=diS+deS
Энтропия в системе изменяется за счет процессов производства энтропии в самой системе и за счет обмена энтропии между системой и окружающей средой.
diS>0 тАУ необратимые процессы
dS/dt=diS/dt+deS/dt
Скорость изменения энтропии в системе равна сумме скорости продукции энтропии в самой системе и скорости обмена энтропией между системой и окружающей средой.
Скорость продукции энтропии в системе всегда больше 0, так как т/д процессы в ней необратимы.
Второй закон т/д для открытых систем
1) dS/dt>0 количество энтропии в системе возрастает
а) dS/dt>0; diS/dt>0;
б) deS/dt=0 нет обмена со средой, система изолированная;
в) deS/dt<0, ½deS/dt½< ½diS/dt½
В системе образуется некоторое количество энтропии, но часть энтропии оттекает в окружающую среду, но скорость оттока не велика и энтропия накапливается в системе.
2) dS/dt=0, стационарное состояние, кол-во энтропии постоянно
deS/dt<0, ½deS/dt½=½diS/dt½
Вся энтропия, которая образуется оттекает в окружающую среду. Это состояние наиболее характерно для зрелых био систем.
3) dS/dt<0 общее количество энтропии в системе убывает
deS/dt<0, ½deS/dt½>½diS/dt½
Энтропия в этой системе, но оттекает из системы больше, чем образуется, следовательно общее кол-во энтропии в системе уменьшается. В реальных био системах это встречается на стадии роста, развития и становления ситемы.
Стационарное состояние
Такое состояние т/д системы при котором ее параметры со временем не изменяются, но происходит обмен веществом и энергией. Для био систем часто встречается, но в то же время множество систем стремится к состоянию равновесия. Открытые системы могут переходить в состояние т/д равновесия
Стационарное состояние:
В· постоянный обмен энергией с окружающей средой
В· постоянно тратится свободная энергия на поддержание состояния
В· т/д потенциалы постоянны, G и F не равны 0
В· энтропия постоянна, но не максимальна
В· градиенты присутствуют
Термодинамическое равновесие
В· отсутствует поток вещества и энергии в окружающую среду и обратно
В· на поддержание этого состояния не затрачивается свободная энергия
В· работа способности системы равна 0, т/д потенциалы равны 0
В· энтропия максимальна
В· в системе отсутствуют градиенты
Механизмы устойчивости стационарного состояния в био системах. Теорема Пригожина
В любой открытой т/д системе постоянно образуется энтропия, в том числе и в био системе.
Пригожин сформулировал:
В стационарных состояниях при фиксированных внешних параметрах локальная продукция энтропии в открытой т/д системе стремится к минимальному значению.
Энтропия тАУ мера рассеивания свободной энергии, следовательно любая открытая т/д система в стационарном состоянии стремится к минимальному рассеиванию свободной энергии. Если в силу причин система отклонилась от стационарного состояния, то вследствие стремления к системы к минимальной энтропии, в ней возникают внутренние изменения, возвращающие ее в стационарное состояние.
Механизмы саморегуляции систем
Функционируют по принципу обратной связи. Обратная связь тАУ это понятие, обозначающее влияние выходного сигнала системы на ее рабочие параметры.
Рисунок. Различают положительную и отрицательную обратную связь. "тАУ" чаще встречается в био системах, направлена на снижение влияния выходного сигнала на рабочие параметры системы. "+" усиливает влияние выходного сигнала на рабочие параметры системы в результате чего система может выходить из данного состояния.
Гомеостаз тАУ постоянство многих параметров.
"тАУ" мотонейрон, рисунок
"+" секреция желудочного сока. В желудке имеется желудочный сок, который вырабатывается до принятия пищи. Под действием желудочного сока начинается расщепление белков. В начальном отделе кишечника питательные вещества всасываются в кровь. Гормоны (гастрин, гистамин) всасываются в кровь, попадают в сосуды, кровоснабжающие желудок и активизируют его работу.
Механизм кругового возбуждения в нейронах ЦНС
Рисунок. "+" обратная связь имеет место в патогенезе заболевания. "Порочный круг" при инфаркте недостаток кислорода тАУ нарушается питание сердца тАУ гипоксия тАУ нектоз тканей тАУ изменение функций сердца тАУ застой венозной крови тАУ сердечная мышца страдает от недостатка кровоснабжения
Рисунок. В реальных био системах + и тАУ обратная связь часто накладываются друг на друга, существуют параллельно. + обратная связь стремится вывести систему из стационарного состояния, при этом она будет переходить в новое стационарное состояние более выгодное при данных условиях. При этом оба стационарных состояния находятся в пределах физиологической нормы отклонений.
Типы переходных процессов
Рисунок
Кинетика биопроцессов
Динамические свойства биопроцессов
Каждая система состоящая из элементов будет характеризоваться динамикой, складывающейся из элементов. Кинетика биопроцессов тАУ раздел биофизики, изучающий динамические свойства биопроцессов.
1. Параметры, меняющие свое значение со временем. Переменные величины: численность клеток, биомасса, концентрация отдельных веществ, трансмембранный потенциал. Изначально предполагается, что из изменение в каждый данный момент времени могут быть описаны соответствующими диф уравнениями.
2. Величины, значение которых с течением времени практически не изменяется. Это рН, t0, электропроводность ткани и т.д.
Пример: характеризует кинетику процесса в культуре клеток
Условия: имеется замкнутая популяция клеток, в которой происходят процессы их размножения и гибели. Питательные вещества присутствуют в избытке.
Вопрос: Как меняется численность клеток со временем? Может ли в ней установиться стационарное состояние, когда число клеток со временем меняться не будет?
Решается с помощью диф уравнения.
Количество клеток = N
dN/dt тАУ ? зависит от V размножения иV гибели клеток.
dN/dt =Vразмножения тАУ Vгибели = k1N тАУ k2N = kN
k тАУ коэффициент пропорциональности, определяется условиями. k1, k2: t0, кол-во пищи, концентрация солей, радиация). k = k1 тАУ k2
dN = kN*dt
N = N0*ekt
N тАУ количество клеток в любой момент времени,
N0 тАУ количество клеток в начальный момент наблюдения t = 0,
е тАУ основание натурального логарифма,
k тАУ коэффициент пропорциональности,
t тАУ время наблюдения за системой.
1. Если k > 0
t → ∞, N(t) → ∞ растущая
2. Если k < 0 (k2 < k1)
t → ∞, N(t) → 0 вымирающая
3. Если k = 0 (k2 = k1)
t → ∞, N = N0 cтационарная
Как изменится количество клеток в системе, если ограничить количество питательных веществ?
В этом случае изменение количества клеток в популяции со временем будет описываться логистическим уравненем Ферхюста:
dN/dt = kN*(NmaxтАУN/Nmax)
Nmax тАУ максимально возможная численность популяции в данных условиях.
Рисунок. Логистическая кривая.
Начальная часть N << Nmax экспененциальный рост,
Вторая часть тАУ изгиб в другую сторону N → Nmax количество питательных веществ ограничивает дальнейший рост количества клеток в популяции.
Основные особенности кинетики биопроцессов
1. В биокинетике в качестве переменных величин выступают не только концентрации веществ, но и другие параметры.
2. Биосистема пространственно гетерогенна, следовательно условия действия реагентов могут различаться в разных точках системы и переменные изменяются не только во времени, но и в пространстве.
3. Существуют специфические механизмы саморегуляции действия по принципу обратной связи.
4. Трудности биокинетики связаны так же с тем, что она описывает процессы открытых систем.
Схема системы с отрицательной обратной связью
ОУ тАУ объект управления,
РВ тАУ регулируемая величина,
ИУ тАУ измерительное устройство (измерение параметров регулируемой величины)
АС тАУ аппарат сравнения,
ОС тАУ обратная связь,
f тАУ сигнал от высших центров регуляции.
Простейшая кинетическая модель открытой системы
. Модель системы в которой происходит обмен веществ "а" и "b" с окружающей средой, внутри обратимые реакции превращения "а" в "b", во внешних резервуарах концентрация этих веществ постоянна и равна соответственно А и В.
da/dt = k1(AтАУa)тАУk2(aтАУkтАУ2b)
db/dt = k2aтАУk3(bтАУB)тАУKтАУ2b
Для стационарного состояния будет соблюдаться условие: da/dt = 0, db/dt = 0.
"а" стационарное и "b" стационарное не зависят от начальных условий, то есть от значений "а" и "b" в момент t = 0. "а" стационарное и "b" стационарное определяются только величинами констант k с 1 по 3 и концентраций веществ во внешних резервуарах системы, то есть А и В.
Вывод:
В каком бы начальном состоянии ни находилась система, в ней в конце концов установится один и тот же стационарный режим при котором а = а стационарное, b = b стационарное. Это свойство эквивалентности стационарных состояний. Оно присуще открытым системам и постоянно встречается при изучении свойств биополимеров.
Качественный анализ кинетической модели
Основная идея метода заключается в отказе от нахождения точных аналитических решений диф уравнений. Вместо этого используются качественные характеристики динамического поведения системы: устойчивость или неустойчивость стационарного состояния, переходы между стационарными состояниями, наличие колебательных движений в системе, качественная зависимость поведения системы от критических значений параметров. Наиболее важным свойством стационарного состояния является его устойчивость, она определяется спосбностью системы самопроизвольно в него возвращаться после внесения внешних возмущений, отклоняющих систему от исходно стационарной точки.
Очевидно, чтобы сделать заключение об устойчивость стационарного состояния необходимо иметь соответствующие критерии.
Бассейн с водой открытая система. С определенной Vпр в него поступает вещество а, но оно с определенной Vот из системы истекает. Vпр постоянна, Vпр = V0 = cosnt. Чтобы выяснить с какой скоростью меняется количество вещества в системе, нужно вычислить: da/dt =Vпр тАУVот =V0 тАУ ka, k тАУ const Vот.
Рисунок. Стационарное состояние в т. а отвечает условию, что V= cosnt = 0. В стационарной точке da/dt = 0. Количество вещества в системе постоянно. Качетвенный анализ дается графическим методом. Случайные отклонения а будут компенсироваться системой. Стационарное состояние а устойчиво.
Качественный критерий устойчивости стационарного состояния Ляпунова
Если система находится в состоянии равновесия, то точка, изображающая местоположение исследуемого показателя на графике будет името постоянное значение координат.
dx/dt = 0, dy/dt = 0
x(t) тАУ const, y(t) тАУ const
Такая точка получила название особой точки. Она показывает местоположение на графике стационарной системы. Если система по каким то причинам выходит из состояния равновесия, то изображающая точка сместится из особой точки и начнет двигаться по плоскости в соответствии с изменением координат х и у.
В этой ситуации: dx/dt = p; p = f (x;y); dy/dt = q; q = f (x;y).
p и q тАУ непрерывные функции, определенные в данной области плоскости. В соответствии с критерием Липунова состояние равновесия устойчиво, если для любой области допустимых отклонений от состояния равновесия (e) можно указать область d, окружающую состояние равновесия и обладающую тем свойством, что ни одно движение преображающей точки, начинающееся в пределах области d никогда не достигнет границ области e.
При этих условиях стационарное состояние устойчиво.
Если же для какой то области e не существует области d, то равновесие не устойчиво.
Во многих системах существует не одно, а несколько стационарных состояний, свойства их чаще всего различаются. И это в первую очередь касается их устойчивости, поэтому в данных ситуациях задачей качественного анализа является определение устойчивости всех стационарных состояний и условий перехода между ними.
Редукция числа уравнений. Принцип узкого места
Желательно отразить в системе уравнений все ее наиболее значимые свойства. Но вместе с тем системы диф уравнений из большого их числа, являются перегруженными. Такая модель чересчур детализирована, следовательно наиболее оптимальными моделями, характеризующими основные свойства систем являются модели, состоящие из небольшого числа диф уравнений (предположительно из двух).
Принцип узкого места (ПУМ) основан на разделении всех переменных, характеризующих свойства системы на быстрые и медленные. Характерное время процесса тАУ t отражает время развития процесса. t процессов ферментативного катализа 10тАУ1 тАУ 10тАУ6 с, процессы физиологической адаптации, для них t несколько минут и больше, процессы репродукции в этой же системе, для них t несколько минут и больше. t тАУ величина противоположная скорости. V=1/t. В пределах одной отдельной цепочки взаимосвязанных реакций всегда имеются наиболее медленные и наиболее быстрые стадии.
Согласно ПУМ общая скорость всей цепи реакций определяется наиболее медленной стадией (она и есть узкое место), она имеет самое большое t, Vmin. Общее время всей цепи реакций (всего процесса) будет мало отличаться от характерного времени узкого места. Чтобы воздействовать на время процесса нужно воздействовать на узкое место.
При внешних возмущениях в системе наблюдаются изменения как быстрых, так и медленных перменных, однако эти изменения протекают с разной скоростью. В устойчивой системе быстрые переменные быстро отклоняются от своих начальных значений, но быстро в них возвращаются. Медленные переменные изменяются в ходе длительных переходных процессов, определяющих динамику всей системы. Фактически быстрые переменные колеблются возле своих стационарных значений. Поэтому вместо диф уравнения, описывающего динамику быстрой переменной можно записать алгебраическое уравнение, отражающее ее стационарное значение, что приведет к постоянному уменьшению числа диф уравнений в системе, останутся лишь те, что описывают наиболее медленные процессы.
dx/dt=AF(x;y)
dy/dt=Q(x;y)
A>>1 Þ A*F >> 1 Þ x быстрая переменная (dx/dt быстрая величина, скорость D х велика)
делить на А
e(dx/dt)=F(x;y), где e=1/A, e<<1, eВо0, F(x;y)=0, e=0
Следовательно у является управляющим параметром, влияющим на координаты в стационарной точке. В био системах роль узкого места могут выполнять разные звенья цепи в зависимости от условий.
Например, ф/с:
Рисунок
В данном процессе меняется управляющая стадия в зависимости от освещения. При плохом освещении узким место ф\с-а являются начальные фотохимические стадии поглощения и трансформации энергии и света в пигментном аппарате. Скорость этих процессов не зависит от t0 в промежутке от +5 до +300 С. При хорошем освещении узким местом ф\с-а являются темновые процессы переноса электрона и поглощения воды.
Эти процессы не справляются с потоком электронов, поступающих от пигментного комплекса, что приводит к насыщению ф\с-а (световое насыщение), эти процессы являются ферментативными, поэтому их скорость зависит от t0. И скорость ф\с-а будет увеличиваться с ростом t0.
Типы динамического поведения био систем
Система двух диф уравнений, модель хар-ся отсутствием перегруженности, на их основании можно качественно провести анализ.
dx/dt=P(x;y)
dy/dt=Q(x;y)
Используется метод фазовой плоскости
Фазовая плоскость тАУ это плоскость с осями координат, на которых отложено значение переменных (х;у), отражающих состояние системы, таким образом каждая точка этой плоскости будет соответствовать определенному состоянию системы
х0, у0 тАУ начальные состояния системы.
Траектория из последовательности точек, каждая из которых будет характеризовать состояние системы в любой определенный момент времени.
Последоват. сов-ть точек на фазовой плоскости, отражающая значение переменных (х;у) на пути перехода тАУ это линия, получившая название фаз???
Изображающая точка тАУ точка на фазовой плоскости, отражает состояние системы в определенный момент времени. Фазовый портрет тАУ совокупность фазовых траекторий, отражающих качественные черты поведения системы во времени.
P(x;y)=0 тАУ
Q(x;y)=0 тАУ
стационарное состояние
Для нахождения особой (стационарной) точки, необходимо построить на фазовой плоскости кривые P(x;y)=0; Q(x;y)=0. Очевидно, особая точка будет находиться в месте пересечения этих кривых.
dx/dt=k1A тАУ k1x+k2y-kx=P(x,y)
dy/dt=k2x-k-2y-k3y+k3B=Q(x,y)
y=-C1x+C2
y=C3x+C4
C тАУ коэффициент пропорциональности
Графики могут пересекаться в нескольких точках (если это кривые), следовательно существует несколько стационарных состояний.
Фазовый портрет триггерной системы
Типы устойчивости особых точек
Важной задачей является определение устойчивости особых точек. Производится по виду правых частей исходной системы уравнений. Об устойчивости стационарного состояния системы судят по поведению системы в случае небольшого отклонения от стационарной точки.
e=x-xст
h=у-уст
Для определения характера устойчивости необходимо одновременно учитывать поведение во времени отклонений e и h. Существуют специальные уравнений, описывающие e и h.
e(t)=C11el1t+C12el2t
h(t)=C21el1t+ C22el2t
Особый смысл имеют l1 и l2 тАУ это экспоненциальные показатели
l1,2 = 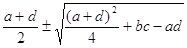
a,b,c,d тАУ значения частных производных в точке (хстац;устац). От вида l1,2 зависит поведение отклонений e и h соответствующих поведению х и у в особой точке (окресностях). l1,2 это либо действительные числа, либо комплексно-сопряженные (если под знаком корня дробь).
1. l1 и l2 < 0 то есть они являются действительными отрицательными числами, значение e и h будут со временем снижаться, то есть отклонение системы от особых точек со временем будет . В этом случае стационарное состояние является устойчивым, а особая точка называется устойчивый узел, такой точке соотвествует особый тип фазового портрета.
Рисунок. Система будет возвращаться по какой-то траектории в стационарное состояние.
2. l1 и l2 > 0, действительные положительные числа e и h будут увеличиваться со временем, следовательно первоначальное состояние было неустойчиво и система все дальше будет отклоняться от состояния равновесия.
Неустойчивый узел. Фазовый портрет такой же, но стрелки на периферию.
3. l1 и l2 действительные числа разных знаков.
Рисунок. Тогда на фазовом портрете системы будет существовать особая точка типа "седла". Сопаратиссы.
Из любого начального положения на фазовой плоскости кроме особой точки сепаратисс система будет удаляться из стационарного состояния. Если l1 и l2 комплексно-сопряженные числа, то изменения во времени e и h носят колебательный характер. Частные случаи:
1. Действительные l1 и l2 < 0,
Рисунок. Re<0, то колебания ситемы носят затухающий характер. Особая точка на фазовом портрете будет называться устойчивый фокус.
2. Действит l1 и l2 > 0,
Рисунок. Cтрелки на фазовом портрете направлены наружу, неустойчивый фокус
3. Re l1 и l2 = 0,
Рисунок. В этом случае l1 и l2 превращаеются в мнимые числа, фазовые траектории будут представлять собой эллипсы, не проходящие через начало координат. В начале координат находится неустойчивая точка (центр). Необольшие возмущения в системе переводят ее с одной траектории на другую, то есть изменяется амплитуда колебания.
Первые пять типов состояния равновесия являются грубыми, так как их характер не изменяется существенно при небольших изменениях правых частей исходного уравнения, а так же из проиводных первого порядка. Эти типы устойчивости характерны для био систем, так как они должны определенным запасом грубости. Такой запас позволяет им сохранить основные динамические свойства при умеренных внешних воздействиях.
Биологические триггеры
(Триггер тАУ спусковой крючок у оружия)
Любая триггерная система способна переключаться с одного режима на другой. Ф.п. стриггер системы характризуются как минимум двумя стационарными точками (А и С)
Рисунок. 2 вида переключения.
1) силовое переключение осуществляется при значительном изменении переменных х или у.
3) связан с наличием управляющего параметра. Он оказывает влияние на величину обеих переменных х и у.
После этого можно восстановить значение управляющего парметра, что приведет к восстановлению исходного вида фазового портрета, однако система при этом остается в устойчивой точке С.
Колебательные процессы
характерная черта био систем. Частые колебания промежуточных продуктов био-хим реакций, численности видов, потенциала мембраны и т.д.
В любом организме существует набор био-хим процессов, в их основе лежат внутренние свойства системы. Причины колебаний во внутренних динамических свойствах системы. Автоколебательные процессы. Тип фазового портрета тАУ устойчивый предельный цикл. Замкнутая траектория, не проходящая через начало координат. С наружной и внутренней стороны подходят спиральные траектории. Система работает в устойчивом колебательном режиме. Если система в силу внешних воздействий выйдет из такого режима, то в силу своих свойств она вернется на замкнутую траекторию. Возвращение будет осуществляться по спиральной траектории. Переход движения вдоль траектории предельного цикла в автоколебательной системе не зависит от начальных условий.
Распределение биологической системы
В био кинетике предполагается изменение переменных не только во времени но и в пространстве, в биохимии важнее изменения во времени. В отличие от точечные, такие модели, которые учитывают измениения переменных во времени и в пространстве, называются распределенными. Таким образом, в распределенных системах будут 2 параллельных процесса тАУ хим превращения в отдельных точках пространства и процесс диффузии веществ из области высокой в область низкой концентрации. То есть происходит перенос вещества между соседними элементарными отсеками. В реальных био системах часто существует пространственное распределение источников энергии. Эти системы называются активные распределенные системы.
Анализ распределенной системы:
Состояние системы уравнений, отражающих хим реакцию и диффузию реагента. Max простой пример распределенной системы тАУ система, в которой имеется одна переменная Х, одновременно участвующая в хим процессе и диффунцирующая вдоль узкой трубки. r тАУ учитывается размер трубки. Диффузионный поток вещества тАУ масса вещества, проходящего через единицу площади перпендикулярной к направлению диффузии (ось х), пропорционален градиенту вещества, взятому с обратным знаком.
I = тАУD*ds(r,t)/dr,
D тАУ коэффициент диффузии, t тАУ время, C тАУ концентрация, изменение концентрации во времени за счет диффузии в элементарном объеме трубки, заключенном между точками r и r+Dr, зависит от разности потоков в точках r и r+Dr. Если D const, то изменение С во времени (скорость изменения С) =
dc/dt=D*d2c(r,t)/dr2,
уравнение диффузии, оно описывает скорость изменения С в системе, в которой происходит только диффузия вещества. Но по условию, в распределенной системе параллельно происходит и хим превращение вещества. Величиной, отражающей хим превращение в системе, является величина точечных членов, которая обозначается, как функция концентрации.
dc/dt=f(c)+D*d2c(r,t)/dr2,
выражение отражает химическое превращение и изменение концентрации. В этой системе изменения происходят только по оси Х. В системах, в которых происходят колебательные процессы невозможно отразить их поведение с помощью одного уравнения, поэтому в данном случае используются базовые модели с двумя переменными:
dx/dt=P(x,y)+Dx*d2x/dr2,
dy/dt=Q(x,y)+Dy*d2y/dr2
Такая базовая модель позволяет качественно описать процессы самопроизвольного возникновения волн и структур в распределенных системах. В общем, они называются самоорганизацией, она возникает, когда в системе появляется неустойчивость, приводящая к потере исходного распределения веществ во времени и пространстве. Вместо этого устанавливается новое распределение вещство во времени и пространстве. Характер самоорганизации зависит от функции f (P,Q) (точечных членов) и D, в частности существуют следующие виды самоорганизации:
1. Распределение возмущения в виде бегущего импульса (нервный импульс).
2. Стоячие волны.
3. Синхронные автоколебания разных элементов во всем пространстве системы.
4. Стационарные неоднородные распределения переменных в пространстве (диссипативные структуры).
5. Генерация волн автономными источниками импульсной актив
Вместе с этим смотрят:
G-белки и их функция
Австралопитеки - обезьянолюди или человекообезьяны?
Адаптация микроорганизмов в экстремальных условиях космоса
Адвентивна флора Чернiгiвськоi областi: iсторiя формування та сучасний стан
Адсорбция ионных и неионных поверхностно-активных веществ (ПАВ)