Допплеровский измеритель скорости кровотока
Введение. 2
1.1. Аналитический обзор.. 3
2.Специальная часть. 43
2.1. Разработка функциональной схемы измерителя. 43
2.2. Разработка принципиальной схемы измерителя. 48
2.3. Анализ метрологических характеристик. 54
2.4. Расчет надежности. 57
3.Технологическая часть. 62
4.Экономическая часть. 68
5.Охрана труда и окружающей среды.. 74
6.Заключение. 82
7.Литература:. 83
8.Приложение. 84
1. ВведениеВ началом дипломного проекта перед разработчиком ставится задача к определенному сроку выполнить все части задания и подготовиться к защите дипломного проекта перед комиссией. Передо мной была поставлена задача разработки современного датчика измерения скорости кровотока на базе существующих методов.
Скорость кровотока, наряду с давлением крови, является основной физической величиной, характеризующей состояние системы кровообращения. Возможность неинвазивной, объективной и динамической оценки кровотока по сосудам малого калибра остается одной из актуальных задач современной ангиологии и смежных специальностей. От ее решения зависит успех ранней диагностики таких заболеваний, как облитерирующий эндартериит, диабетическая микроангеопатия, синдром и болезнь Рейно, всевозможных окклюзий и стенозов артерий.
Перед решением задач проектирования новых устройств, как и при решении любой задачи повышенной сложности, необходимо разбить всю работу на определенное количество этапов, определить трудоемкость каждого из них, четко определить график выполнения каждого участка работ, для каждой части определить срок выполнения и перехода к следующему этапу. Определившись с планом работ нужно тщательно изучить историю развития техники, методов измерения скорости, предложений и решений в той области науки, в которую входит предмет проектирования. Все это было мной проделано и сделаны выводы о целесообразности применения определенных методов и конструкторских решений на разных этапах проектирования.
В аналитическом обзоре будет проведен анализ существующих аналогов, принципов их действия, конструкторского устройства и погрешностей. На основании обзора, в специальной части будет предложен выбранный метод, конструкция, необходимые расчеты и математические выкладки, функциональная и структурная схемы. В ней же будет произведен расчет надежности и анализ погрешностей для проектируемого устройства. В экономической части будет приведен расчет целесообразности внедрения проектируемого прибора в производство. В разделе ВлБезопасность жизнедеятельностиВ» будет рассчитан и устранен один из факторов мешающий безопасной работе с прибором. В технологической части будут определены технические условия производства прибора, технологические карты его наладки и начерчены чертежи конструкции прибора или испытательного стенда для проверки изделия на соответствие техническим условиям. В заключении будут сделаны выводы о проделанной работе.
1.1.1. Методы измерения скорости кровотока.
В восьмидесятые годы значительное развитие получила клиническая диагностика заболеваний человека с помощью введения в его организм радиоизотопов в индикаторных количествах. Визуализация с помощью радиоизотопов включает в себя ряд методов получения изображения, отражающих распределение в организме меченных радионуклидами веществ. Эти вещества называются радиофармпрепаратами (РФП) и предназначены для наблюдения и оценки физиологических функций отдельных внутренних органов. Характер распределений РФП в организме определяется способами его введения, а также такими факторами, как величина кровотока объема циркулирующей крови и наличием того или иного метаболического процесса.
Первое применение радиоизотопа для диагностики заболеваний щитовидной железы относится к концу 1930-хх гг. Ранние разработки устройств визуализации в 1950-х гг. представляли собой сканеры с двухкоординатным сканированием и сцинтилляционные камеры. В клинической практике оба этих типа устройств стали широко использоваться к середине 1960-х гг. Именно с этого периода камера Энгера становится одним из основных технических средств визуализации с помощью изотопов.
Радиоизотопные изображения позволяют получать ценную диагностическую информацию. В ядерной медицине в те годы наиболее распространенным методом клинической диагностики являлась статическая изотопная визуализация в плоскости, называемая планарной сцинтиграфией. Планарные сцинтиграммы представляют собой двумерные распределения, а именно проекции трехмерного распределения активности изотопов, находящихся в поле зрения детектора. В отличие от рентгенографии, в которой точно известно начальное и конечное положение каждого рентгеновского луча, при визуализации радиоизотопного источника можно определить положение лишь регистрируемого g-излучения.
Одним из возможных перспективных применений ультразвука в медицинской диагностике является допплерография, т. е. измерение скорости крови в кровеносном сосуде с помощью эффекта Доплера. Современная аппаратура обработки данных позволяет определить не только среднеквадратическую скорость в сосуде, но и относительные амплитуды сигналов, соответствующие различным скоростям составляющих кровотока. Это достигается посредством вычисления спектра принимаемого доплеровского сигнала в реальном масштабе времени.
Первые сообщения о применении принципа Допплера для измерения скорости кровотока принадлежат Satomura (1960), Franclin е.a.(1961).
В последующие несколько лет ультразвуковые допплеровские приборы были значительно усовершенствованы. Применение детектора направления кровотока (McLeod,1968,Beker e.a.,1969) значительно расширило возможности диагностики.
В 70-х годах был предложен метод "спектрального анализа" допплеровского сигнала, позволивший количественно оценить степень стеноза сонных артерий. В эти же годы параллельно с развитием постоянно волновых допплеровских систем внедряются системы с импульсным излучением. Сочетание последних со спектральным анализом и эхоскопией в "B" - режиме привело к созданию дуплексных систем.
1982 год является точкой отсчета для транскраниальной допплерографии. Первые клинические результаты применения этого метода были опубликованы R.Aaslid именно в этом году. Транскраниальная допплерография, образно говоря, "замкнула последнюю брешь" в диагностике окклюзирующих поражений брахиоцефальных артерий, позволив диагностировать интракраниальные поражения, до этого времени считавшиеся недоступными для ультразвукового исследования.
В основе допплерографии лежит физический эффект Допплера, суть которого состоит в изменении частоты посланных ультразвуковых волн при перемещении среды, от которой они отражаются, или при перемещении источника ультразвука, или при одновременном перемещении среды и источника (Рис 1.1).
В нашем случае ультразвуковые волны отражаются от частиц крови, и это изменение напрямую зависит от скорости кровотока.
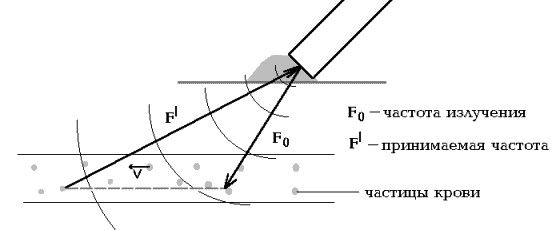
Рис 1.1.
Схема эффекта Допплера.
В современных ультразвуковых допплеровских системах используется один датчик и для излучения, и для улавливания отраженной волновой энергии. Принцип Допплера описывает компонент вектора скорости вдоль линии наблюдения. Этот компонент скорости (или наблюдаемая скорость) равна:
Vo = V x cos a,
где V - абсолютная скорость кровотока,
a - угол между вектором скорости кровотока и направлением ультразвукового пучка.
Поскольку наблюдаемая скорость Vo зависит от угла a, то Vo=V ( при a=0 ) и V > Vo во всех остальных случаях, когда 0 < a < 90 (Рис 1.1).
Иначе говоря, скорость, воспринимаемая по принципу Допплера, не тождественна абсолютной скорости кровотока. Равными величины абсолютной и воспринимаемой по принципу Допплера скоростей могут быть только при a=0.
В наиболее общем виде эффект Допплера описывается формулой:
Fd = 2 x Fo x Vo/c , (1)
где Fd - допплеровская частота,
Fo- посылаемая частота,
c - скорость распространения ультразвуковых волн в среде (в данном случае - крови).
Однако, с учетом зависимости наблюдаемой скорости от угла между датчиком и направлением движения крови, формула < 1 > приобретает окончательный вид:
Fd = 2 x Fo x V x cos a/c
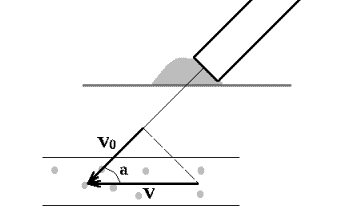
Рис1.2.
Влияние угла a на значение допплеровской скорости.
1.1.2. Болезни, диагностируемые с помощью измерения скорости кровотока и варианты методик обследования.
Скорость кровотока, наряду с давлением крови, является основной физической величиной, характеризующей состояние системы кровообращения. Возможность неинвазивной, объективной и динамической оценки кровотока по сосудам малого калибра остается одной из актуальных задач современной ангиологии и смежных специальностей. От ее решения зависит успех ранней диагностики таких заболеваний, как облитерирующий эндартериит, диабетическая микроангеопатия, синдром и болезнь Рейно. Не менее важным аспектом проблемы эхолокации низкоскоростных потоков крови является мониторинг проходимости микрососудистых анастомозов при реимплантации сегментов конечностей, трансплантации тканевых лоскутов и органов. С помощью высокочастотной (ВЧ) ультразвуковой допплерографии (УЗДГ) открываются перспективы в определении жизнеспособности тканей при критической ишемии, обширных ожогах и обморожениях.
Нарушения мозгового кровообращения являются одной из основных причин смертности населения развитых стран. Ишемическая болезнь мозга по распространенности практически соответствует ишемической болезни сердца и составляет около 36% в структуре сердечно-сосудистых заболеваний. Особое место среди причин, приводящих к нарушениям мозгового кровообращения, занимает патологическая извитость сонных артерий. С одной стороны, это связано с ее высокой распространенностью в качестве причины недостаточности мозгового кровообращения, уступающей только распространенности атеросклеротического поражения каротидных артерий. С другой стороны, до сих пор нет единого мнения о гемодинамической значимости деформации сонных артерий и целесообразности ее хирургической коррекции.
Стенозирующие поражения брахиоцефальных артерий в настоящее время занимают второе место по частоте летальных осложнений. Отмечается увеличение количества больных с атеросклеротическим поражением внутренних сонных артерий (ВСА).
Успешное предупреждение и эффективное лечение нарушений мозгового кровообращения, обусловленных патологической извитостью сонных артерий, атеросклеротических поражений артерий, всевозможных окклюзий и стенозов во многом зависит от диагностики параметров кровотока. Существующие в настоящее время методы исследования брахиоцефальных артерий и мозгового кровотока, такие как дигитальная субтракционная ангиография, компьютерно-томографическая ангиография, магнитно-резонансная ангиография, инвазивны и (или) небезопасны для пациента, дорогостоящи, дают в основном информацию о морфологических изменениях и не позволяют детально оценить количественные характеристики кровотока
Использование транскраниальной допплерографии позволило установить важнейшие закономерности нарушений мозговой гемодинамики при атеросклеротических поражениях сонных артерий. В то же время практически неисследованным остается состояние мозговой гемодинамики при патологической извитости каротидных артерий.
1.1.3. Анатомо-физиологические особенности системы брахиоцефальных артерий
Сокращения:
БА тАУ бедренная артерия
БЦС тАУ брахиоцефальный ствол
ВПА тАУ внутренняя подвздошная артерия
ГА - глазничная артерия
ЗМА тАУ задняя мозговая артерия
ЗСА тАУ задняя соединительная артерия
ЗТА тАУ задняя тибиальная артерия
ЛА тАУ лучевая артерия
НПА тАУ наружная подвздошная артерия
НСА тАУ наружная сонная артерия
ОА тАУ основная артерия
ОПА тАУ общая подвздошная артерия
ОСА тАУ общая сонная артерия
ПА тАУ позвоночная артерия
ПВА тАУ поверхностная височная артерия
ПКА тАУ подключичная артерия
ПМА тАУ передняя мозговая артерия
ПСА - передняя соединительная артерия
ПТА тАУ передняя тибиальная артерия
СМА тАУ средняя мозговая артерия
ТКД тАУ транскраниальная допплерография
УЗДГ тАУ ультразвуковая допплерография
От дуги аорты отходят три основных артериальных ствола - слева общая сонная и подключичная артерии, справа - короткий брахиоцефальный ствол, который делится на правую подключичную и правую общую сонную артерии. Обе позвоночные артерии отходят от соименных подключичных артерий, являясь границей первого и второго сегментов ПКА. Общая сонная артерия у верхнего края щитовидного хряща делится на наружную сонную артерию и внутреннюю сонную артерию (рис. 1.3).
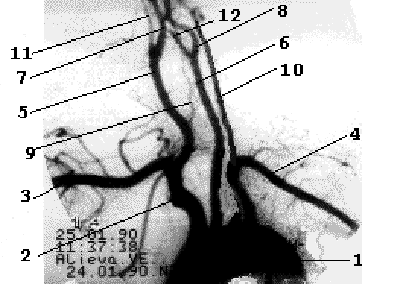
Рис 1.3
Рентгеноанатомия брахиоцефальных ветвей дуги аорты.
1- дуга аорты, 2- брахиоцефальный ствол, 3- правая ПКА, 4- левая ПКА, 5- правая ОСА, 6- левая ОСА, 7- правая ВСА, 8- левая ВСА, 9- правая ПА, 10- левая ПА, 11- правая НСА, 12- левая НСА.
Наружная сонная артерия имеет короткий ствол, делясь на ряд ветвей, что легко позволяет отличить ее от ВСА. Насчитывают девять ветвей НСА, ряд из которых (терминальные ветви лицевой, поверхностной височной и верхнечелюстной артерий) анастомозируют с конечными ветвями глазничной артерии (первая интракраниальная ветвь ВСА) (Рис 1.4).
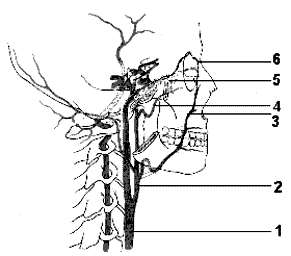
Рис 1.4.
Схема глазничного анастомоза.
1- ОСА, 2- НСА, 3- лицевая артерия, 4- ПВА, 5- ГА, 6-глазничный анастомоз.
Внутренняя сонная артерия до входа в полость черепа ветвей не дает. Непосредственно после выхода из кавернозного синуса она отдает первую ветвь глазничную артерию, а затем делится на две конечные ветви - переднюю мозговую артерию и среднюю мозговую артерию (Рис 1.5).
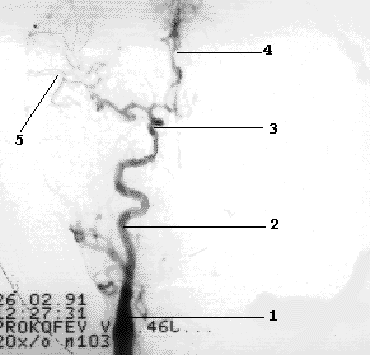
Рис 1.5 Интракраниальные ветви ВСА.
1- ОСА, 2- ВСА, 3- сифон ВСА, 4- ПМА, 5- СМА.
Обе передние мозговые артерии отходят (чаще под прямым углом) от передней полуокружности внутренней сонной артерии в месте, соответствующем наружному краю перекреста зрительных нервов. Эти артерии направляются вперед и внутрь в продольную щель мозга над corpus сollosum. Диаметр передних мозговых артерий варьирует от 1.5 до 2.5 мм. Число и ход вторичных ветвей ПМА весьма вариабельны. Различают от 6 до 8 вторичных ветвей передней мозговой артерии. Корковые ветви передней мозговой артерии анастомозируют на поверхности мозга с корковыми ветвями средней и задней мозговых артерий.
Средняя мозговая артерия является непосредственным продолжением ВСА. Диаметр СМА варьирует от 1.9 до 3.2 мм. Пройдя несколько миллиметров, средняя мозговая артерия погружается в боковую щель. Протяженность основного ствола СМА (I сегмент СМА) различна и составляет от 5 до 30 мм. От первого сегмента СМА (MI) берут начало центральные артерии, идущие к коре больших полушарий, от них отходят вторичные, третичные и т.д. ветви. В бассейне СМА можно наблюдать ветви до седьмого порядка. Число центральных артерий, составляющих в совокупности MII сегмент СМА, колеблется от 4 до 10. Артерии третьего, четвертого и других более мелких порядков составляют MIII cегмент СМА (рис. 1.5).
Корковые ветви СМА широко анастомозируют с корковыми ветвями ПМА и задней мозговой артерии (ЗМА).
Стенозирующие поражения брахиоцефальных артерий в настоящее время занимают второе место по частоте летальных осложнений. Отмечается увеличение количества больных с атеросклеротическим поражением внутренних сонных артерий (ВСА). Частота ишемических инсультов у нелеченных пациентов в данной категории составляет от 20 до 40 %. У 40 - 50% больных со стенозами ВСА острое нарушение мозгового кровообращения (ОНМК) возникает без каких-либо предшествующих преходящих нарушений мозгового кровообращения (R.H.Holdsworth et.al., 1995). Операцией выбора при стенозах ВСА является каротидная эндартерэктомия (КЭ). Однако в ранние сроки после КЭ отмечаются расстройства общей и локальной гемодинамики, в частности, в виде послеоперационной гиперперфузии и гипертонии головного мозга, которая составляет от 10 до 60% (E.L.Bove et al., 1989; Towne J.B. et al., 1997). В связи с этим необходима интраоперационная оценка скорости объемного кровотока во ВСА с целью точности определения интенсивности кровотока в данном артериальном бассейне.
Головной мозг - один из главных органов-мишеней при гипертонической болезни. Цереброваскулярные осложнения во многом определяют судьбу больных гипертонической болезнью, являясь важнейшей причиной стойкой утраты трудоспособности и летального исхода.
Одним из основных показателей перфузии головного мозга служит скорость мозгового кровотока, которая рассчитывается в миллилитрах в минуту на 100 г вещества мозга. Скорость мозгового кровотока в разных участках головного мозга неодинакова. Прежде всего, это касается различий между серым и белым веществом больших полушарий головного мозга: скорости мозгового кровотока в этих областях соотносятся как 3,0-3,5:1. Межполушарная асимметрия мозгового кровотока в покое в норме не выявляется. С возрастом скорость мозгового кровотока уменьшается, что объясняют атеросклеротическими изменениями артерий, снабжающих кровью головной мозг, а также снижением метаболических потребностей головного мозга в процессе старения.
С помощью различных методов были определены основные параметры мозгового кровообращения у человека. По данным литературы, общий мозговой кровоток колеблется в среднем от 614 до 1236 мл/мин. Для головного мозга, весящего в среднем 1400 г, общий мозговой кровоток составляет в среднем 756 98 мл/мин. В расчете на 100 г вещества скорость мозгового кровотока в покое, по данным разных исследователей, колеблется от 40 до 60 мл/мин (W. Powers, 1992; M. Reivich, 1971).
Скорость мозгового кровотока находится в прямой зависимости от величины перфузионного давления и обратно пропорциональна сопротивлению мозговых сосудов. При снижении регионарного мозгового кровотока до некоторого критического уровня возникает ишемия головного мозга с исходом в некроз. Этот критический уровень неодинаков для различных участков головного мозга. В клинических исследованиях показано, что у человека критическая скорость мозгового кровотока, при которой появляется неврологическая симптоматика, составляет для серого вещества 15-29 мл/мин, т.е. примерно 30-40% от нормы. M. Reivich (1971 г.) приводит более высокие значения критического уровня мозгового кровотока. По его наблюдениям, симптомы и признаки ишемии головного мозга появляются при снижении среднего системного АД до 30 мм рт.ст., когда скорость мозгового кровотока составляет около 30 мл/мин на 100 г вещества или около 60% от нормы. S. Strandgaard (1976 г.) наблюдал начальные признаки ишемии головного мозга у больных с нормальным АД при снижении среднего системного АД до 43 8 мм рт.ст.
1.1.4. Методика проведения ультразвуковой допплерографии
Схема проведения допплерографического исследования
Используемые датчики: 4 или 8 МГц в постоянноволновом режиме.
Исследуемый находится в положении лежа на спине. Голова откинута несколько назад так, чтобы были легко доступны для пальпации общие сонные артерии. Дистальный конец датчика устанавливается в медиальный угол глазницы так, чтобы ультразвуковой пучок был направлен в проекцию перекреста зрительных нервов. Легкими движениями проксимального конца датчика достигается максимальный устойчивый сигнал.
В норме кровоток в надблоковой артерии направлен к покровам черепа (антеградный кровоток), то есть навстречу вектору ультразвукового пучка с регистрацией допплерограммы выше изолинии (Рис 1.6).
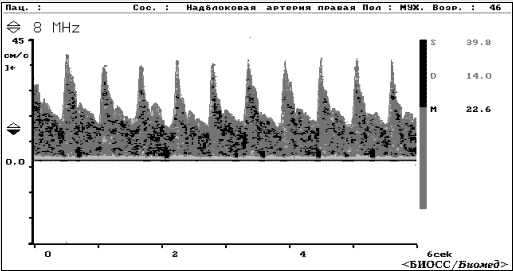
Рис 1.6 Допплерограмма надблоковой артерии.
В то же время, антеградный кровоток может иметь место и при коллатеральном перетоке через передние отделы виллизиева круга (например, при окклюзии ВСА). Поэтому, в дополнении к фоновому исследованию, проводятся компрессионные пробы в следующем порядке:
* гомолатеральная общая сонная артерия,
* контралатеральная общая сонная артерия,
* ветви наружной сонной артерии со стороны исследования,
* ветви наружной сонной артерии с контралатеральной стороны.
В норме компрессия соименной общей сонной артерии приводит к редукции кровотока в надблоковой артерии, что указывает на проходимость внутренней сонной артерии (Рис 1.7).
Компрессия ветвей наружной сонной артерии (поверхностной височной артерии - у козелка ушной раковины, лицевой- у угла нижней челюсти, верхнечелюстной- в "собачьей ямке" у нижнего края орбиты) в норме приводит к увеличению кровотока в надблоковой артерии или реакция на компрессию отсутствует.

Рис 1.7. Допплерограмма надблоковой артерии с компрессией гомолатеральной ОСА.
Нормальные показатели
Приводя в этом разделе нормальные показатели периорбитальной допплерографии, следует отметить, что они разработаны на основании изучения больших групп клинически здоровых пациентов.
Приведенные в табл. 1 показатели нормы верны для допплеровских систем типа "БИОМЕД" (Россия) и моделей фирмы EME/Nicolete (Германия-США).
При использовании других моделей необходима предварительная разработка нормальных показателей периорбитальной допплерографии для конкретного прибора.
Таблица 1
| Артерия | ЛСК в см/сек | Асимметрия |
| надблоковая | >15 см/сек | < 20% |
Вместе с этим смотрят:
Principala cauza a handicapului
Toma Cerba
РЖсторiя виникнення та розвитку масажу
Абдоминальная травма
Аборты