Клонирование и анализ генов легких цепей иммуноглобулинов стерляди
ОГЛАВЛЕНИЕ
СПИСОК СОКРАЩЕНИЙ...............................................3
ВВЕДЕНИЕ...............................................................4
ОБЗОР ЛИТЕРАТУРЫ...................................................5
СТРОЕНИЕ ИММУНОГЛОБУЛИНОВ..........................................5
ГЕНОМНАЯ ОРГАНИЗАЦИЯ И ЭКСПРЕССИЯ
ГЕНОВ L-ЦЕПЕЙ ИГ У МЛЕКОПИТАЮЩИХ..................................7
ГЕНОМНАЯ ОРГАНИЗАЦИЯ И ЭКСПРЕССИЯ
ГЕНОВ L-ЦЕПЕЙ ИГ У НИЗШИХ ПОЗВОНОЧНЫХ...........................11
ЭВОЛЮЦИЯ ГЕНОВ L-ЦЕПЕЙ ИГ............................................19
МАТЕРИАЛЫ И МЕТОДЫ..............................................24
ЭЛЕКТРОФОРЕЗ ДНК......................................................24
ВЫДЕЛЕНИЕ ДНК ИЗ ГЕЛЯ.................................................24
ПОЛУЧЕНИЕ РАДИОАКТИВНЫХ ЗОНДОВ...................................25
ВЫДЕЛЕНИЕ ПЛАЗМИДНОЙ ДНК...........................................26
ОЧИСТКА ПЛАЗМИДНОЙ ДНК МЕТОДОМ РАВНОВЕСНОГО
ЦЕНТРИФУГИРОВАНИЯ В ГРАДИЕНТЕ ПЛОТНОСТИ CsCl....................26
ТРАНiОРМАЦИЯ ПРОКАРИОТИЧЕСКИХ КЛЕТОК..........................27
ВЫДЕЛЕНИЕ ЛЕЙКОЦИТОВ ИЗ КРОВИ РЫБ.................................28
ВЫДЕЛЕНИЕ СУММАРНОЙ РНК ИЗ ЛЕЙКОЦИТОВ...........................28
ВЫДЕЛЕНИЕ ВЫСОКОМОЛЕКУЛЯРНОЙ ДНК
ИЗ ЭУКАРИОТИЧЕСКИХ КЛЕТОК...........................................28
КОНСТРУИРОВАНИЕ БИБЛИОТЕКИ кДНК...................................29
ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ........................................33
СУБКЛОНИРОВАНИЕ ДНК..................................................34
СКРИНИНГ БИБЛИОТЕКИ кДНК............................................34
ОПРЕДЕЛЕНИЕ НУКЛЕОТИДНОЙ ПОСЛЕДОВАТЕЛЬНОСТИ ДНК...............35
САУЗЕРН БЛОТ ГИБРИДИЗАЦИЯ...........................................36
РЕЗУЛЬТАТЫ...........................................................38
КОНСТРУИРОВАНИЕ БИБЛИОТЕКИ кДНК И ЕЕ СКРИНИНГ...................38
ОПРЕДЕЛЕНИЕ ПЕРВИЧНОЙ СТРУКТУРЫ...................................40
СРАВНИТЕЛЬНЫЙ АНАЛИЗ ПЕРВИЧНОЙ СТРУКТУРЫ.......................40
АНАЛИЗ ГЕНОМНОЙ ОРГАНИЗАЦИИ.......................................41
ОБСУЖДЕНИЕ..........................................................46
ВЫВОДЫ................................................................48
СПИСОК ЛИТЕРАТУРЫ................................................49
СПИСОК СОКРАЩЕНИЙ
ИГ иммуноглобулины
пн пар нуклеотидов
тпн тысяч пар нуклеотидов
е.а. единица активности
ИПТГ изопропилтиогалактозид
ТЕМЕД N,N,N,'N'-тетраметил-этилен-диамин
трис трис(гидроксиметил)аминометан
дНTФ дезоксиаденозинтрифосфат
ддНТФ дидезоксинеклеотидтрифосфат
дНТФ дезоксинуклеотидтрифосфат
рATФ рибоаденозинтрифосфат
ДТТ дитиотрейтол
Na2ЭДТА этилендиаминтетраацетат натрия
SDS додецилсульфат натрия
X-Gal 5-бромо-4-хлоро-3-индолил-бета-D-галактозид
ВВЕДЕНИЕ
В основе функционирования гуморального иммунитета у млекопитающих лежит сложный комплекс молекулярно-генетических и физиологических механизмов, обеспечивающих реорганизацию, мутагенез и клональную экспрессию генов иммуноглобулинов. Возникновение этой подсистемы иммунитета связывают с появлением хрящевых рыб.
На ранних этапах эволюции гены ИГ были организованы в виде повторяющихся кластеров V-J-C генных сегментов. При подобной организации разнообразие продуцируемых антител основывалось, прежде всего, на количестве имевшихся в геноме кластеров, каждый из которых кодировал один вариант полипептидных субъединиц ИГ. В ходе дальнейшей эволюции произошел переход от кластерной к сегментарной организации, обеспечивающей дополнительный источник разнообразия за счет комбинативной рекомбинации генных сегментов. Предполагается, что этот переход также имел важное значение для регуляции экспрессии генов и осуществления механизмов клонального отбора антителопродуцирующих клеток в ходе иммунного ответа.
Настоящая работа представляет собой часть проекта, направленного на изучение эволюции механизмов изотипического исключения генов легких цепей ИГ у низших позвоночных. Целями работы являлись изучение структуры и организации генов легких цепей ИГ стерляди (Acipenser ruthenus), представителя филогенетически древней группы костно-хрящевых рыб.
ОБЗОР ЛИТЕРАТУРЫ
СТРОЕНИЕ ИММУНОГЛОБУЛИНОВ
Иммуноглобулины выполняют в организме позвоночных функцию гуморальных антител и антиген-связывающих рецепторов В-лимфоцитов. Особенностью этого класса белков является огромное разнообразие, позволяющее им вступать во взаимодействие с фактически любыми биологическими макромолекулами.
Типичная молекула ИГ состоит из двух идентичных тяжелых (H) и двух идентичных легких (L) полипептидных цепей. H- и L-цепи построены из нескольких доменов, каждый из которых состоит примерно из 110 аминокислотных остатков. У млекопитающих существует пять классов H-цепей: g, m, a, d, и e. Каждая H-цепь построена из одного N-концевого и нескольких (трех или четырех) C-концевых доменов. N-концевые домены различаются в разных молекулах и называются вариабельными (V) доменами. C-концевые домены имеют одинаковую структуру у молекул одного класса и называются константными (С) доменами (рис. 1) (Пол, 1987).
Среди L-цепей млекопитающих различают два типа: лямбда и каппа. Каждая L-цепь состоит из одного вариабельного и одного константного доменов. В индивидуальной молекуле ИГ присутствует только один тип L-цепи (Roitt et al., 1993).
Гигантское разнообразие ИГ обеспечивается прежде всего тем, что V и C области кодируются разными генами (генными сегментами), физически разнесенными в зародышевой ДНК.
В формировании вариабельных доменов H-цепей участвуют три генных сегмента: вариабельный (V), D-сегмент (от англ. diversity- разнообразие) и J-сегмент (от англ. joining- соединяющий). С-области Н-цепей разных классов кодируются отдельными генами (Roitt et al., 1993).
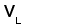
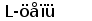

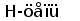






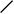
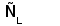

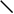
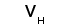








Рис. 1. Схема строения молекулы иммуноглобулина.
Типичная молекула иммуноглобулина содержит две идентичные легкие (L) и две идентичные тяжелые (H) цепи, связанные между собой ковалентно дисульфидными связями. Каждая L-цепь состоит из одного вариабельного (VL) и одного константного (СL) домена. Н-цепь состоит из одного VH и нескольких CН доменов.
В формировании зрелого гена L-цепи участвуют три генных сегмента: V-сегмент и J-сегмент кодируют V-домен, C-сегмент кодирует константный домен. На поздних стадиях развития В-лимфоцита генные сегменты, кодирующие вариабельные домены, объединяются в различных сочетаниях, образуя матрицу для экспрессии L- и H-цепей (Seidman et al., 1979; Durdik et al., 1984).
ГЕНОМНАЯ ОРГАНИЗАЦИЯ И ЭКСПРЕССИЯ ГЕНОВ L-ЦЕПЕЙ ИГ У МЛЕКОПИТАЮЩИХ
Различные виды млекопитающих имеют сходную схему организации и экспрессии генов ИГ. Одним из наиболее изученных в этом отношении видов является человек. Лямбда и каппа цепи ИГ у человека кодируются генами, расположеными в разных локусах и на разных хромосомах. Каппа локус состоит из большого количества Vk генных сегментов, собраных в группы, пяти Jk и одного Сk сегмента. Такой тип организации называется сегментарным (рис. 2). Лямбда локус состоит из группы Vl сегментов, точное количество которых неизвестно, и семи пар Jl-Cl сегментов. Три из них (JCl4 - JCl6) являются псевдогенами (Hieter et al., 1981; Roitt et al., 1993).
В процессе развития В-лимфоцита в кроветворных органах один из V сегментов соединяется с одним из J сегментов посредством сайтспецифической рекомбинации (Schatz et al., 1992). В этот процесс вовлекаются специальные олигомерные последовательности: гепта- и нонамеры, фланкирующие с 3' стороны V сегмент и с 5' стороны J сегмент (рис. 3) (Aguilera et al., 1987; Hesse et al., 1989). Отличительной особенностью лямбда и каппа локусов является конфигурация промежутков между гепта- и нонамерами, называемых спейсерами. С V и J генными сегментами лямбда типа ассоциированы 23 пн и 12 пн спейсеры соответственно, а с V и J сегментами каппа типа - 12 пн и 23 пн спейсеры (Durdik et al., 1984; Stavnezer et al., 1985).
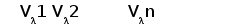


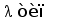
















 л
л



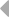
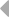
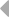
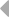
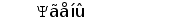













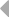
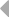
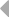
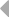
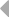
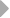
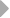
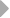
Рис. 2. Схема строения лямбда и каппа локусов генов L-цепей ИГ человека.
Лямбда локус содержит много Vl сегментов и семь пар близкорасположенных Jl-Cl. Три из них яляюся псевдогенами (Y). Каппа локус содержит много Vk пять Jk и один Ck генный сегмент (Hieter et al., 1981; Roitt et al., 1993).
 Обозначения: - сигнальные олигомеры.
Обозначения: - сигнальные олигомеры.
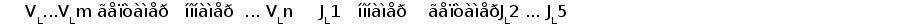
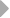
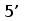
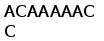



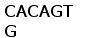




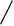

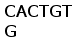
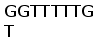
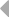

Рис. 3. Схема расположения олигонуклеотидных последовательностей, задействованных в сайтспецифической рекомбинации в каппа локусе млекопитающих. Эти последовательности фланкируют с 3‘ стороны VL сегмент и с 5’ стороны JL сегмент. Во время рекомбинации гептамер и нонамер одного из VL сегмента объединяются с гептамером и нонамером одного из JL сегмента. Это делает возможным соединение VL и JL сегментов без нарушения рамки трансляции (Aguilera et al., 1987; Hesse et al., 1989).
 Обозначения: - сигнальные олигомеры.
Обозначения: - сигнальные олигомеры.
Последовательность, в которой рекомбинируют локусы L-цепей, строго упорядочена во времени. Показано, что первыми перестраиваются локусы каппа типа, причем если в одной хромосоме перестройка оказалась нефункциональной, тоесть не привела к появлению полноценного гена, то рекомбинация происходит в каппа локусе на гомологичной хромосоме. В случае повторной абортивной перестройки аналогично происходят перестройки в лямбда локусах. Если в клетке непродуктивно перестроились все четыре локуса, то она превращатся в 0-клетку и подвергается апоптозу. Если же перестройка одного из локусов привела к образованию функционального гена, то рекомбинация остальных локусов блокируется. Детали механизма блокирования неизвестны, однако установлено, что необходимым условием для него является транскрипция продуктивно перестроенного гена. В результате в каждом индивидуальном лимфоците синтезируется только один тип L-цепей, каппа или лямбда, и экспрессия гена происходит только на одной из двух гомологичных хромосом. Эти феномены, называемые изотипическим и аллельным исключениями лежат в основе ключевого принципа функционирования иммунной системы - принципа клональной селекции (Пол, 1987; Strob, 1987).
В организме млекопитающих генерируется свыше десяти миллионов вариантов антител, хотя в геноме содержится значительно меньшее количество генных сегментов, которые могут участвовать в формировании вариабельных доменов. В случае L-цепей, основным источником разнообразия является комбинативное сочетание V и J сегментов. Дополнительным источником является смещение рекомбинационной рамки в месте их соединения. Кроме того, V генные сегменты могут обмениваться участками ДНК с псевдогенами посредством генной конверсии. Очень существенный вклад в разнообразие специфичностей антител вносит соматическое мутирование вариабельных генных сегментов в сайтах, участвующих в формировании антигенсвязывающего центра. Соматическое разнообразие генерируется при вторичном иммунном ответе путем включения гипермутационного механизма в клетках памяти в зародышевых центрах лимфатических узлов (Tonegawa 1983; Roitt et al., 1993).
ГЕНОМНАЯ ОРГАНИЗАЦИЯ И ЭКСПРЕССИЯ ГЕНОВ L-ЦЕПЕЙ ИГ У НИЗШИХ ПОЗВОНОЧНЫХ
Хрящевые рыбы.
Гуморальный иммунный ответ в виде специфических антител обнаруживается только у позвоночных. Наиболее примитивными видами, у которых обнаружена способность синтезировать ИГ, являются хрящевые рыбы. Представители трех основных таксонов (акулы, скаты и химеры) продуцируют антитела в ответ на введение широкого спектра антигенов. Однако, в отличие от млекопитающих, гетерогенность сывороточных антител у хрящевых рыб выражена очень слабо. Кроме того, у них не обнаружено созревание иммунного ответа - при вторичном введении антигена спектр антител не меняется (Flajnik, 1996). Результаты исследований последних лет продемонстрировали, что организация генов ИГ у хрящевых рыб также имеет ярко выраженные особенности.
У хрящевых рыб обнаружены гены трех типов L-цепей, локализующиеся в разных локусах. В каждом локусе геные сегменты организованы в кластеры, имеющие по одному V, J и C генному сегменту (рис. 4). Таких кластеров содержится несколько десятков или даже сотен в одном локусе на расстоянии 12-15 тпн друг от друга (Rast et al., 1994).
Гены первого типа найдены у разнозубой акулы (Heterodontus francisci) (Shamblott and Litman, 1989) и малого ската (Raja erinacea) (Anderson et al., 1995). У акулы кластеры имеют размер 3-6 тпн. V и J, J и C генные сегменты разделены примерно 0,5 и 4 тпн соответственно. У ската V и J сегменты слиты в зародышевой ДНК.
Гены второго типа обнаружены у пятнистой химеры (Hydrolagus colliei) (Maisey, 1984), песчаной акулы (Carcharhinus plumbeus) (Hohman et al., 1992; Hohman et al., 1993), разнозубой акулы и малого ската (У всех изученных видов в кластерах этого типа V и J генные сегменты соединены уже в зародышевом геноме. V и C гeнные сегменты разделены 2-3 тпн.
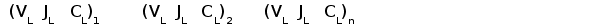








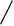
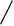





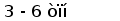






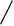







Рис. 4. Схема строения локусов генов L-цепей ИГ у акулы.
Организация генов у акулы имеет кластерный тип. Каждый кластер имеет размер 3 - 6 тпн и содержит по одному VL, JL и CL генному сегменту.
Обнаружено три типа генов L-цепей ИГ. Локусы генов первого и третьего типов имеют схожую организацию. В этом случае VL и JL, JL и CL сегменты разделены примерно 0,5 и 4 тпн соответственно (А) (Rast et al., 1994).
В локусе генов второго типа VL и JL сегменты соединены уже в зародышевом геноме (Б).
Третий тип генов L-цепей найден у акулы-няньки (Gynglimostoma cirratum) (Greenberg et al., 1993) и разнозубой акулы (Rast et al., 1994). В кластерах этого типа V и J, J и C генные сегменты разделены, как и в кластерах первого типа, примерно 0,5 и 4 тпн соответственно. V и J генные сегменты фланкируются сайтами специфической рекомбинации со спейсерами 12 и 23 пн, что соответствует конфигурации спейсеров в локусах каппа типа млекопитающих. По первичной структуре гены третьего типа тоже наиболее близки к генам каппа типа высших позвоночных (гомология по аминокислотной последовательности составляет около 60%).
Гены этих трех типов имеют между собой низкую степень гомологии:40-50% по нуклеотидной последовательности С сегментов и 50-60% по последовательности V сегментов (Hohman et al., 1993).
Полученные данные показывают, что у хрящевых рыб имеется очень большое количество генных сегментов. Однако специфика организации генов исключает комбинативное сочетание сегментов. Все разнообразие антител у хрящевых рыб формируется только за счет экспрессии большого количества кластеров.
Данные о нуклеотидных последовательностях из разных локусов выявили низкую гетерогенность генов (85-95%), что указывает на отсутствие соматического мутагенеза (Rast et al., 1994).
Костистые рыбы.
Анализ сывороточных антител пещерного сомика (Ictalurus punctatus) показал наличие трех типов L-цепей с различными молекулярными массами: 26, 24 и 22 кДа. Два вида антител мыши, 3F12 и 1G7, захватывают более 90% от общего количества иммуноглобулинов в реакции иммунопреципитации. При этом 3F12 антитела связываются с молекулами, содержащими L-цепи массой 24 и 22 кДа, а 1G3 антитела с другой субпопуляцией, содержащей L-цепи массой 26 кДа. На основе этих данных L-цепи разделяют на два класса, называемые F и G (Lobb et al.,1984).
Геномная организация локуса L-цепей G типа имеет кластерный тип (рис. 5). В каждом кластере содержится по одному J и C сегменту и два V сегмена. Вариабельные генные сегменты расположены всегда в противоположной транскрипционной полярности к J и C сегментам . В ряде геномных клонов один V сегмент располагался с 3' стороны от C генного сегмента. Размер кластера равен примерно 3 тпн, расстояние между кластерами около 6 тпн (Ghaffari and Lobb, 1993; Bengten, 1994).
Хотя гены L-цепей сомика имеют низкую гомологию с генами других позвоночных (40-50% по нуклеотидной последовательности), их можно отнести к каппа типу высших позвоночных, так как сходство по первичной структуре с лямбда типом ниже. Кроме того, конфигурация спейсеров имеет характер каппа типа: 12 пн спейсер ассоциирован с V, 23 пн спейсер с J сегментом (Ghaffari and Lobb, 1993).
У радужной форели (Oncorhynchus mykiss), представителя другого семейства костистых рыб, также обнаружены два типа L цепей (Daggfeldt et al., 1993). Один из них (L1) высокогомологичен G типу сомика по структуре V и C областей и соответствующий локус имеет сходную организацию.
По-видимому, у этих видов объединение V и J сегментов происходит только за счет инверсий с восстановлением единой полярности транскрипции. Разнообразие вариабельных доменов образуется в результате комбинативного сочетания V и J сегментов в пределах одного кластера. Не исключается, что в перестройки могут вовлекаться и соседние кластеры.
Интересной особенностью костистых рыб является очень высокая пропорция мРНК, представляющей так называемые стерильные транскрипты (Ghaffari and Lobb, 1993). Эти транскрипты включают в себя только С-сегменты и фланкирующие их 5’и 3’-нетранслируемые участки. Количество стерильных транскриптов у сомика и форели в 5 раз превышает количество полных VJC-транскриптов.
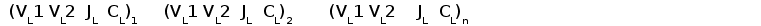






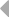
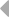


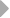
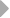







Рис. 5. Геномная организация локуса генов L-цепей ИГ у пещерного сомика.
Генные сегменты организованы в кластеры. Каждый кластер содержит два VL и по одному JL и CL сегменту и имеет размер около 5 тпн. Расстояние между JL и CL около 1000 пн, VL сегменты удалены от 5' конца JL сегмента на 3 тпн. VL сегменты всегда расположены в противоположной транскрипционной полярности по отношению JL и CL сегментам (Ghaffari and Lobb, 1993).
Амфибии.
У шпорцевой лягушки (Xenopus laevis) выявлено три семейства генов L-цепей ИГ, кодирующих три различных изотипа: L1 (ро), L2 (сигма) и L3 (рис. 6).
Все три локуса имеют сегментарный характер организации. L1 локус содержит множественные VL1 сегменты, разделенные в геноме 2.1 - 3.6 тпн, пять JL1 сегментов, три из которых идентичны, и один CL1 генный сегмент (Stewart et al., 1993). JL1 и VL1 сегменты фланкируются каноническими гепта- и нонамерными сигнальными последовательностями, разделенными 12 пн у VL1 и 23 пн у JL1 сегментов (Sakano et al., 1980).
Локус генов второго типа разделяется на два семейства, s1 и s2, которые в геноме располагаются отдельно. Геном лягушки содержит множественные Vs1 и несколько Vs2 геных сегментов, одну пару Js1-Cs1 и пару Js2-Cs2 (Schwager et al., 1991). Расположение генов этого типа друг относительно друга точно не определено.
Недавно был обнаружен третий тип генов L-цепей у лягушки. В геноме лягушки содержится шесть семейств V сегментов этого типа. Общее количество VL3 элементов составляет по меньшей мере 30 копий. Каждый VL3 элемент может рекомбинировать с одной из двух пар JCL3 генных сегментов (Haire et al., 1996).
Гены трех типов значительно различаются: гомология на аминокислотном уровне составляет приблизительно 30% (Zezza et al., 1991). В то же время, ряд признаков позволяет соотнести гены L1 и L3 типа с каппа и лямбда типами млекопитающих.
Семейство генов первого типа можно отнести к каппа типу по нескольким причинам (Zezza et al., 1992): а) высокая гомология первичной структуры (более 50%); б) существенное сходство геномной организации локуса (много VL1 и один CL1 генный сегмент); в) кофигурация спейсеров между гепта- и нонамерыми соответствует каппа типу; г) JL1 и CL1 генные сегменты разделены примерно 3.5 тпн, что приблизительно равно расстоянию между JLk и CLk элементами человека (Sakano et al., 1979; Hieter et al., 1982) и значительно больше чем расстояние между JLl и CLl млекопитающих (Blomberg et al., 1982; Udey, 1987).
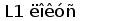




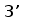
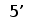
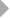
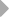
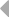
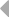










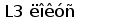
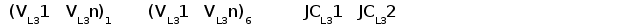


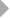
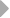
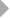
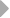
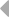
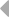









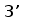

Рис. 6. Геномная организация локуса первого и третьего типов генов L-цепей ИГ у шпорцевой лягушки.
Локус семейства L1 содержит множественные VL1 сегменты, пять JL1 сегментов один CL1 генный сегмент. Расстояние между VL1 равно 2.1 - 3.6 тпн. Локус семейства L3 имеет около 30 VL3 сегментов, располагающихся группами, JL3 и CL3 сегменты располагаются парами: JCL31 и JCL32 (Stewart et al., 1993; Haire et al., 1996).
Третий тип генов L-цепей лягушки более близок к лямбда типу млекопитающих: а) более высокая гомология с генами лямбда типа млекопитающих (около 50% с l- и 30-40% с k-типом по аминокислотной последовательности); б) JL3 и CL3 генные сементы экспрессируются всегда парами JL31-CL31 и JL32-CL32, что напоминает ситуацию в лямбда локусе человека и мыши (Haire et al., 1996).
Гены второго типа L-цепей лягушки незначительное и приблизительно одинаковое сходство с генами каппа и лямбда типов млекопитающих (30-40% и 25-40% по нуклеотидной последовательности, соответствено) (Schwager et al., 1991).
Генетическое разнообразие у лягушки достаточно велико и сравнимо с разнообразием генов у млекопитающих. Однако репертуар антительных специфичностей в сыворотке крови значительно уступает репертуару высших позвоночных (Hsu et al., 1991). Этот парадокс можно объяснить наличием механизма соматической селекции клонов В-лимфоцитов, который элиминирует клетки, несущие антитела, специфичные к собственным антигенам организма, а также те клетки, которые продуцируют несколько типов антител (Wilson et al., 1992).
Основной вклад в формирование разнообразия L-цепей антител у лягушки дают первое и третье семейства генов, имеющие высокий комбинативный потенциал и большое разнообразие зародышевых V генных (Haire et al., 1996). Второе семейство имеет несколько слабо отличающихся друг от друга VL2 элементов и не играет существенной роли в формировании разнообразия (Stewart et al., 1993). Таким образом, разнообразие генов L-цепей у лягушки а создается посредством: а) комбинативного соединения V и J генных сегментов; б) смещения рекомбинационной рамки при соединении V и J сегментов. Нельзя исключить, что определенный вклад в разнообразие может вносить соматический мутагенез. Во всяком случае, наличие этого механизма показано для генов H-цепей лягушки (Zezza et al., 1992).
ЭВОЛЮЦИЯ ГЕНОВ L-ЦЕПЕЙ ИГ
Согласно наиболее популярной в настоящий момент гипотезе гены ИГ и Т-клеточных рецепторов произошли от одного предкового гена, кодировавшего один домен путем различных вариантов последовательных дупликаций (рис. 7).
В эволюции генов ИГ можно выделить три основных события.
1. Разделение предкового V-подобного гена на V и J сегменты и возникновение механизма генерации разнообразия путем соматической рекомбинации. Предпологается, что это событие связано с внедрением транспозона в предковый ген и осуществилось до разделения ИГ и Т-клеточных рецепторов у предков хрящевых рыб (Gilbert, 1990). Наличие в геноме акул и скатов слитых VJ генов в локусах L-цепей классов I и II, является, по-видимому, вторичным событием и, возможно, обусловлено фиксацией генов, кодирующих антитела строго определенной специфичности (Anderson et al., 1995).
2. Возникновение механизмов соматического мутагенеза генов ИГ. У млекопитающих соматический мутагенез обеспечивает как минимум половину разнообразия антител, являясь основой аффинного созревания антител при вторичном иммунном ответе (Пол, 1987). Достаточно выражен соматический мутагенез также у птиц (Thompson and Neiman, 1987; Reynaund et al., 1987).
Ряд данных позволяет предполагать, что соматический мутагенез может осуществляться у хрящевых рыб и у амфибий, но эти результаты нуждаются в более тщательном изучении. В частности, у хрящевых рыб получение достоверных свидетельств затруднено наличием множественых кластеров генов, что не позволяет надежно соотносить данные по геномной структуре и структуре кДНК (Litman et al., 1993).
3. Переход от кластерной к сегментарной организации генных сегментов. Сегментарная организация может иметь несколько преимуществ. Во-первых, увеличивается разнообразие продуцируемых антител за счет дополнительных возможностей комбинирования разных V и J сегментов. Во-вторых, уменьшается размер локуса за счет



















 Вместе с этим смотрят:
Вместе с этим смотрят:
Principala cauza a handicapului
Toma Cerba
РЖсторiя виникнення та розвитку масажу
Абдоминальная травма
Аборты