Нокаут генов
Содержание
Тезисы
Вступление
1. Метод генетического нокаута
1.1 Особенности векторных конструкций
1.2 Внесение вектора в эмбриональные стволовые клетки
2. Роль метилирования ДНК в контроле генома
3. "Программируемый нокаут генов"
4. Линии нокаутных мышей
4.1 ФНО/ЛТ панель
4.2 BALB/cMBD2
4.3 B6SJL-Tg(SOD1-G93A)dl1Gur/J
4.4 C57BL/MUC2
4.5 C57BL/6Kaiso
5. Примеры использования нокаутированных мышей для изучения функций генов и наследственных заболеваний человека
Выводы
Список литературы
Тезисы
Нокаут гена (gene knockout) тАФ это метод молекулярной генетики, при котором из организма удаляют или делают неработоспособными заданные гены. Таким образом получают организм, нокаутный по неработающим генам. Нокаутные организмы помогают узнать функции генов, нуклеотидная последовательность которых известна. Различия между нокаутным и нормальным организмом свидетельствуют о функции выключенного гена.
Эта методика заключается в целенаправленном внесении измененного, мутированного гена в наследственную информацию клеток. Новый ген вносится в получаемые из эмбрионов стволовые клетки, а результат оценивается во взрослом животном, поэтому пока не идет речи о применении данной технологии у людей: многие работы со стволовыми клетками человека почти повсеместно запрещены, да и выращивание мутантных особей Homo sapiens в экспериментальных целях представляется малореальным.
Стандартной биологической моделью, для которой разработана методика, являются лабораторные мыши.
Лауреатами Нобелевской премии 2007 года в области медицины и физиологии стали Марио Капекки, Оливер Смитис и сэр Мартин Эванс тАУ разработчики технологии gene targeting тАУ способа изменить отдельные гены у млекопитающих. Речь идет о передней границе современной науки о живом, настоящей генетической инженерии, о которой мечтал еще Уэллс в "Острове доктора Моро".
Вступление
С первых дней возникновения генетики как науки, ученые мечтали получать направленные мутации, затрагивающие гены изучаемых ими признаков. Первым шагом к осуществлению этой мечты было открытие радиационного и химического мутагенеза. Окончание секвенирования генома человека в 2001 г. [28,12] вывело на новый уровень исследования по обнаружению новых генов и функционально значимых последовательностей генома. В настоящее время биотехнология и биоинформатика в комбинации с классической биохимией и генетикой являются мощным инструментом для анализа уже имеющейся последовательности генома человека и модельных организмов. Но настоящий прорыв в области направленных мутаций был осуществлен благодаря использованию феномена гомологичной рекомбинации между сравнительно небольшим участком экзогенной и клеточной ДНК. Данный метод получил название направленной инактивации гена или нокаут гена (от англ. knockout, синоним тАУ gene targeting). Зная последовательность изучаемого гена человека, стало возможно посредством инактивации гомологичного гена у модельного организма определить биохимическую и физиологическую роль его продукта. Поскольку значительное число болезней человека в своей основе имеет наследственный компонент, модели заболеваний, созданные с использованием этой стратегии, позволяют расширить наше понимание биохимии и физиологии наследственных патологий и приведут к созданию новых подходов к лечению.
Лауреатами Нобелевской премии 2007 года в области медицины и физиологии стали Марио Капекки, Оливер Смитис и сэр Мартин Эванс тАУ разработчики технологии gene targeting тАУ способа изменить отдельные гены у млекопитающих. Речь идет о передней границе современной науки о живом, настоящей генетической инженерии, о которой мечтал еще Уэллс в "Острове доктора Моро".
1. Метод генетического нокаута
Нокаут гена тАУ это молекулярно-генетический метод, в ходе которого задуманные исследователем изменения вносятся в нуклеотидную последовательность изучаемого гена или его регуляторных элементов. Мышь является наиболее адекватным модельным животным для использования технологии инактивации генов. Это обусловлено следующими причинами:
а) мышь тАУ хорошо изученный и доступный объект;
б) геном мыши и человека содержит приблизительно одинаковое число генов;
в) сходство аминокислотных последовательностей всех белков человека и мыши составляет около 90%.
Однако основной причиной использования мыши в качестве модели для инактивации гена является возможность изолирования эмбриональных стволовых клеток, в которых любой ген может быть модифицирован [29]. Клеточные линии, содержащие модифицированный ген, могут быть привнесены в развивающийся зародыш, что позволяет получить химерное животное, несущее искусственно созданную мутацию (рис. 1).
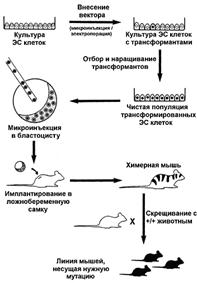
Рис. 1. Стратегия получения линии нокаутированных мышей [5].
Молекулярно-генетическим механизмом, позволяющим осуществлять инактивацию гена, является гомологичная рекомбинация между экзогенной ДНК, несущей задуманные исследователем изменения, и геномной ДНК объекта.
Классическая схема получения нокаутированных мышей включает несколько этапов: получение векторной конструкции, с последующим внесением ее в культуру эмбриональных стволовых клеток (ЭСК) и отбор трансформантов. Трансформированные ЭСК вносят в зародыш, и полученных химерных животных скрещивают для получения линии мышей, гомозиготных по полученной мутации (см. рис. 1).
1.1 Особенности векторных конструкций
В зависимости от поставленной задачи используются два типа векторов: замещающий и вставочный. Первый тип векторов позволяет заменить участок гена мишени, в то время как второй интегрирует в изучаемую последовательность. Строение обоих типов векторов одинаково, кроме ориентации фланкирующих последовательностей (рис. 2). Наиболее часто используются замещающие вектора.
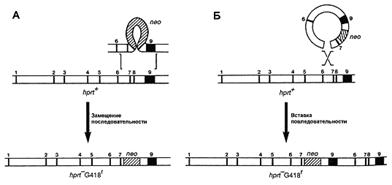
Рис. 2. Два типа векторов тАУ замещающий (А) и вставочный (Б) тАУ и их механизмы интеграции в геном [5].
Вектор для трансформации несет клонированную последовательность изучаемого гена, с внесенными в нее необходимыми изменениями. Это может быть: внесение стоп-кодона, приводящее к синтезу короткого неактивного пептида; делеция одного или нескольких экзонов; делеция промоторной области; вставка, приводящая к нарушению нормального функционирования гена и любые другие изменения, приводящие к отсутствию функционального продукта изучаемого гена или значительно снижающие его активность. Также в эту последовательность вносится положительный селективный маркер (МПС), которым является ген neo. Продукт этого гена дает несущим его клеткам устойчивость к антибиотикам неомицину и канамицину. Модифицированная последовательность должна быть фланкирована неизмененными участками, по которым будет проходить рекомбинация. Эффективность рекомбинации зависит от длины фланкирующих последовательностей [22], что в свою очередь зависит от возможностей вектора (рис. 3). При длине гомологичного плеча около 5 тыс. п.н. процент рекомбинации составляет 0,001.
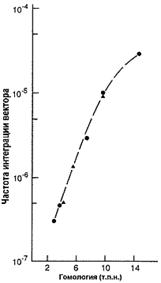
Рис. 3. Зависимость частоты интеграции вектора от длины гомологичных плеч [22].
В качестве вектора можно использовать бактериальные искусственные хромосомы (BAC), со вставками фрагментов генома мыши. В этом случае размер одного плеча может составлять до 150 тыс. п.н., а размер делеции до 25 тыс. п.н. Наилучший процент рекомбинации (8,3%) получен авторами с использованием длины плеча 110 тыс. п.н. [26].
Существует вероятность, что рекомбинация пройдет не по исследуемым нами участкам генома, а в любой другой сходной области. При этом ген neo (МПС) сохранится, и в отобранном пуле ЭСК будут присутствовать рекомбинантные клетки, не несущие необходимых изменений. Эта проблема решается внесением в векторную конструкцию маркера отрицательной селекции (МОС). Им может служить ген тимидин-киназы простого вируса герпеса (HSV-tk) или ген дифтерийного токсина А (DT-A), продукты которых убивают эукариотические клетки. Положение МОС с наружной стороны гомологичного плеча вектора позволяет элиминировать его после прохождения гомологичной рекомбинации (рис. 4). В случае же негомологичной рекомбинации, МОС оказывается интегрированным в геном трансформированной клетки, что приводит к ее элиминации. Наличие двух маркеров селекции (положительного и отрицательного) позволяет быстро и эффективно проводить отбор нужных трансформантов [23,19].

Рис. 4. Действие системы позитивной тАУ негативной селекции: А) интеграция вектора в нужный участок генома, приводящая к нокауту гена, Б) случайная интеграция (синтез тимидин-киназы и гибель клеток) [19].
1.2 Внесение вектора в эмбриональные стволовые клетки
Для трансформации используют эмбриональные стволовые клетки мышей. Помимо того, что культура ЭС клеток способна расти in vitro, при пересадке во взрослую мышь или эмбрион клетки имеют свойство приживаться. ЭС клетки, в отличие от специализированных соматических клеток, сохраняют генетические потенции без тканевой специализации. Эти клетки имеют "минимальный" фенотип: минимум рецепторов и программ для взаимодействия с микроокружением, поскольку лишь 5% из 500 генов транссигнализации экспрессировано в пролиферирующих ЭСК. Второй важнейшей характеристикой ЭСК в культуре является практически неограниченный потенциал пролиферации, обусловленный особенностями фенотипа незрелых клеток. Третьей особенностью ЭСК является рост суспензионными клонами без какой-либо примеси продвинутых клеток, прикрепленных к подложке. Каждый клон в такой культуре является производным одной прародительской ЭСК [1].
Эмбриональные стволовые клетки мыши впервые получены в 1981 году [8], что дало возможность для развития работ по инактивации генов. Внесение линеализированного вектора в ЭС клетки возможно несколькими методами: микроинъекция, трансфекция (электропорация), трансдукция (вирусная инфекция). Перечисленные методы имеют свои преимущества и недостатки.
Микроинъекция позволяет с частотой до 100 процентов вносить экзогенную ДНК в клетку, а частота гомологичной рекомбинации составляет около 0,67%. Этот метод, несомненно, является наиболее эффективным. Однако для осуществления микроинъекции требуется дорогое оборудование и высокая квалификация экспериментатора. Помимо этого, сам метод очень трудоемок и занимает много времени. Векторные конструкции микроинъекцией можно вносить и в зиготу, но отобрать нужные трансформанты в этом случае невозможно.
Наиболее экономичными и достаточно эффективными методами внесения экзогенной ДНК в клетку являются электропорация и ретровирусная инфекция. К их достоинствам, в первую очередь, следует отнести возможность одноразово обработать сотни тысяч клеток, которые благодаря системе позитивной-негативной селекции достаточно быстро проходят отбор. Это существенно упрощает и делает экономически выгодным, по сравнению с микроинъекцией, процедуру получения трансформированных клеток. Оба метода имеют свои недостатки: больший процент негомологичной рекомбинации при внесении векторных систем электропорацией по сравнению с другими методами, ограниченые размеры ретровирусных векторов и т.д. [21]. Наиболее часто внесение векторов в клетку проводят с помощью электропорации. В то же время ретровирусная инфекция позволяет вносить экзогенную ДНК не только в ЭС клетки, но и в эмбрионы. Итак, линия трансформированных клеток получена и поддерживается. Следующий этап тАУ внесение клеток в эмбрион мыши (как правило, на стадии бластулы). Химерный зародыш подсаживают в матку ложно беременной самки. Полученную таким образом химеру скрещивают с нормальным, но имеющим отличия (например, цвет) животным. Если полученные в первом поколении мыши имеют фенотип линии, из которой получены ЭС клетки, то их можно использовать для насыщающего скрещивания. Результатом будет получение линии животных, гомозиготных по созданной мутации.
2. Роль метилирования ДНК в контроле генома
Одним из способов видоизменения гена является его замена на бессмысленную последовательность ДНК тАФ тогда ген "выключается". Исследователи систематически "выключают" гены и наблюдают, к каким последствиям на уровне организма приводит это "выключение". Такая методика называется "генетический нокаут" (gene knockout).
Она позволяет подробно изучить функцию конкретного гена во время эмбрионального развития и после рождения животного. Можно проследить, как каждый ген влияет на развитие организма и возникновение той или иной патологии. В связи с этим, метод ещё получил название "генетическое планирование". К настоящему моменту уже проведены опыты по "выключению" десяти тысяч генов мыши, это половина всего мышиного генома.
Для развития организма достаточно одной клетки с единичной (конечно же, диплоидной) копией ДНК, которая при делении точно воспроизводится от клетки к клетке. Это относится практически ко всем живым многоклеточным существам. У человека все его клетки содержат идентичную ДНК. Клетки крови, печени, мозга, стволовые клетки - все они одинаковы по ДНК. Чем же определяется многообразие имеющихся у человека высокоспециализированных клеток и тканей? Это достигается за счет включения или выключения генов, ответственных за специализацию клетки. Именно механизмы контроля работы, или как принято говорить, экспрессии генов являются основной темой исследований нашей группы. Одним из таких механизмов является метилирование генов - ковалентное присоединение метильной группы в 5 положении пиримидинового кольца цитозина. ДНК, содержащая метилированные цитозины, является транскрипционно неактивной, и гены, располагающиеся вблизи метилированных районов, молчат.
Роль метилирования ДНК и механизм его негативного воздействия на работу генов в процессе жизнедеятельности позвоночных организмов (на моделях лягушки, мыши и клеточных линий человека).
Метилирование ДНК у позвоночных приобретает смысловую нагрузку в виде подавления транскрипции близлежащих генов двумя основными способами: (А) за счет прямого воздействия на ДНК, в составе которой метилированный цитозин ингибирует связывание транскрипционного фактора со своим участком, и (Б) за счет специфического связывания с метилированным районом специализированных метил-ДНК узнающих белков, которые, в свою очередь, привлекают сложные механизмы подавления транскрипции путем модификации близлежащих гистонов.
Как пример охарактеризован белок Каизо. Каизо, с одной стороны, связывается с катенином р120, а с другой - способен подавлять транскрипционную активность метилированных генов. Каизо имеет доменную структуру и состоит из N-концевого BTB/POZ домена и C-концевых цинковых пальцев типа C2H2. Цинковые пальцы специфично связывают 5-метил цитозин содержащую ДНК.
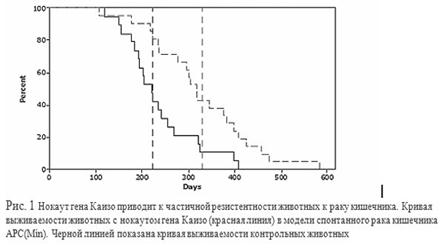
Нокаут гена Каизо приводит к частичной резистентности животных к раку кишечника. Кривая выживаемости животных с нокаутом гена Каизо (красная линия) в модели спонтанного рака кишечника APC(Min). Черной линией показана кривая выживаемости контрольных животных
Проведен генетический нокаут гена Каизо у мышей. Показано, что животные без Каизо (Каизо-КО) развиваются нормально и не имеют выраженных патологий . При переведении Каизо-КО животных на генетический фон с высоким процентом спонтанных опухолей кишечника происходит увеличение срока жизни животных, уменьшается средний размер полипов в кишечнике. Таким образом, установлено, что без Каизо происходит замедление роста опухолей кишечника в APC(Min) моделях Напротив, при выключении гена Каизо в зиготах лягушки происходит апоптотическая смерть клеток эмбрионов на стадии нейрулы. В отличие от мыши, ген Каизо является необходимым для жизнедеятельности земноводных. Эти данные были подтверждены и на рыбах Danio Rerio . Получены линии клеток с множественными генетическими нокаутами генов MBD2, MeCP2 и Каизо. Показано, что белки MBD2, MeCP2 и Каизо оказывают синергетическое действие (репрессируют) метилированный промотор гена Xist . Показано, что мутации в гене Каизо не являются ключевыми в инициировании синдрома Ретта (нейродегенративное заболевание у девочек) , хотя другой метил ДНК связывающий белок MeCP2 напрямую вовлечен в эту патологию.
В геноме позвоночных найдены и охарактеризованы два гена, кодирующих белки ZBTB4 и ZBTB38, которые по своей аминокислотной последовательности и расположению консервативных доменов являются родственниками Каизо. Показано, что эти два белка являются метил ДНК зависимыми транскрипционными репрессорами.
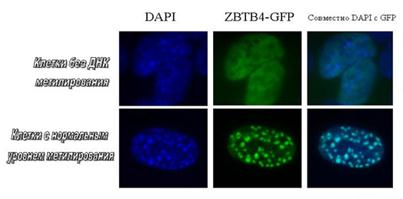
Каизо подобный белок ZBTB4 расположен в метилированных участках гетерохроматина. Клетки без метилирования - мышиные эмбриональные фибробласты с генетической делецией генов dnmt1-/- и p53-/-. Клетки с нормальным уровнем метилирования - мышиные эмбриональные фибробласты p53-/-. В случае dnmt1-/- p53-/- клеток видно отсутствие корреляции между локализацией ZBTB4 в гетерохроматине (DAPI), в то время, как в p53-/- клетках видна полная ко-локализация ZBTB4 и гетерохроматина.
3. "Программируемый нокаут генов"
Следует отметить, что не все гены можно инактивировать на стадии зародыша. И, естественно, нельзя получить клетки или животных, нокаутированных по так называемым генам домашнего хозяйства. Однако для генов, принимающих участие в эмбриональном развитии, разработан подход, позволяющий проводить их инактивацию после развития организма. Данная стратегия позволяет "выключать" гены в определенных условиях ("программируемый нокаут генов", англ. conditional knockout), а именно в необходимой исследователю ткани или группе клеток и/или под воздействием индуцирующего вещества.
Это можно осуществить с помощью методики, сочетающей гомологичную рекомбинацию, как в случае классического нокаута генов, и системы сайт-специфической рекомбинации. Сайт-специфические рекомбиназы тАУ это ферменты, узнающие особые участки ДНК и совершающие обмен между ними. Наиболее часто используются Cre рекомбиназа бактериофага P1 и Flp рекомбиназа (флипаза) дрожжей. Эти ферменты распознают нуклеотидные последовательности в 34 основания, называемые, соответственно, loxP и frt сайты [16]. Если эти последовательности расположены в одной ориентации, рекомбинация по ним приведет к делеции фланкированного участка. Если же ориентация последовательностей различна, то это приведет к инверсии фрагмента между ними (рис. 5).
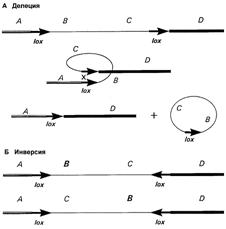
Рис. 5. Схема механизма сайт-специфической рекомбинации. В зависимости от ориентации loxP-сайтов происходит либо делеция, либо инверсия фланкированого фрагмента [20].
Использование стратегии "программируемого нокаута гена" требует создания двух линий мышей. Линия А несет интегрированную в геном последовательность гена Cre под контролем ткане-специфичного или индуцибельного промотора. Линия В содержит два loxP сайта, фланкирующих подлежащую удалению последовательность исследуемого гена (экзон, промотор и т.д.) [25]. Следует отметить, что вставки в геномную последовательность loxP сайтов и гена Cre осуществляются с использованием тех же приемов, что и при классическом нокауте генов, но не должны затрагивать функциональные последовательности (рис. 6).
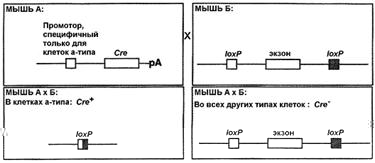
Рис. 6. Схема использования тканеспецифичной Cre-loxP рекомбинации для получения мышей с программируемым нокаутом гена [25].
Полученные таким образом гомозиготные линии мышей скрещивают. У потомков от этого скрещивания исследуемый ген будет инактивирован в ткани или группе клеток, где будет активен промотор, контролирующий активность гена Cre [25]. Используя стратегию "программируемой инактивации гена", можно добиться результатов, недоступных при использовании стандартной процедуры нокаута генов.
4. Линии нок-аутных мышей
4.1 ФНО/ЛТ панель
Окраска шерсти: черные.
Происхождение: линии выведены в лаборатории молекулярной иммунологии ИМБ им. В. А. Энгельгардта РАН методом генетического нокаута и переведены на генетическую основу C57BL/6 путем возвратного скрещивания. Панель содержит линии мышей с модифицированным геном фактора некроза опухолей (ФНО) и лимфотоксина (ЛТ), подготовленные к тканеспецифической делеции гена, а также линии мышей с делецией гена ФНО или ЛТ специфично в макрофагах/нейтрофилах, либо в Т- или В-лимфоцитах, либо в клетках зародышевой линии.
Характеристика линии:
у мышей с полной делецией гена ФНО нарушена защита от ряда патогенов;
у мышей с полной делецией гена ЛТ-бета нарушена структура вторичных лимфоидных органов и антиген-специфическая продукция некоторых классов иммуноглобулинов.
Основные области использования: данные мыши представляют собой уникальную панель для изучения роли тканеспецифической продукции цитокинов семейства ФНО при врожденном и приобретенной иммунодефиците.
Ключевые публикации:
Tumanov et al. Distinct role of surface lymphotoxin expressed by B cells in the organization of secondary lymphoid tissues. Immunity. 2002 Sep;17(3):239-50.
Grivennikov et al. Distinct and nonredundant in vivo functions of TNF produced by t cells and macrophages/neutrophils: protective and deleterious effects. Immunity. 2005 Jan;22(1):93-104.
4.2 BALB/cMBD2
Окраска шерсти: белые.
Происхождение линии: линия получена в Эдинбургском Университете (Великобритания) в лаборатории Эдриана Бёрда (Adrian Bird) путем генетического нокаута гена MBD2 в мышах линии BALB/c.
Характеристика линии:
Особи женского пола имеют ослабленный материнский инстикт. У мышей наблюдается акселерация в развитии в раннем возрасте без акселерации в наборе массы тела. При переведении мутантного MBD2 локуса на генетический фон Min(APC) мышиной модели рака кишечника у животных возникает резистентность к злокачественной трансформации эпителиальных клеток.
Основные области использования:
изучение развития опухолей кишечника;
модель материнского поведения.
Линия BALB/cMBD2 используется в исследованиях, которые проводятся совместными усилиями Эдинбургского Университета и центра "Биоинженерия" РАН.
4.3 B6SJL-Tg(SOD1-G93A)dl1Gur/J
Окраска шерсти: разная: белая, коричневая, чёрная.
Происхождение: линия создана в лаборатории Mark E. Gurney при Северозападном университете США (Northwestern University, USA).
Метод модификации: трансгеноз. Трансгенные мыши G93A, экспрессируют мутантный человеческий ген Cu/Zn-супероксиддисмутазу SOD1 (Gly93/Ala; глицин замещён на аланин в позиции 93).
Характеристика линии: Трансгенные мыши G93A, экспрессирующие мутантный SOD1, характеризуются прогрессирующей дегенерацией мотонейронов, как при боковом амиотрофическом склерозе человека. Мыши становятся парализованными на одну или более конечностей в возрасте 6-7 месяцев. На фоне прогрессирования паралича скелетных мышц животные умирают через 4-6 недель после появления первых клинических признаков заболевания.
Основные области использования:
Боковой амиотрофический склероз
Нейропротекция
Подробности о данной линии животных: Gurney ME, Pu H, Chiu AY, Daly Canto MC, Polchow CY, Alexander DD, Caliendo J, Hentati A, Kwon YW, Deng HX, et al. 1994. Motor neuron degeneration in mice that express a human Cu,Zn superoxide dismutase mutation. Science 264:1772-5.
4.4 C57BL/MUC2
Окраска шерсти: C57BL/MUC2
Происхождение: линия получена в Колледже им. Альберта Эйнштейна (Нью-Йорк, США) в группе Анны Велчич (Anna Velcich) путем генетического нокаута гена Mucin2 в мышах линии C57BL/6. В Питомник "Пущино" линия поступила в 2006 году.
Характеристика: В мышах этой линии нарушена морфология кишечных криптов. В течение 10 месяцев после рождения у мышей развиваются аденомы тонкого кишечника, которые прогрессируют затем в злокачественные аденокарциномы.
Подробности: Velcich et al., Colorectal cancer in mice genetically deficient in the mucin Muc2. Science. 2002 Mar 1;295(5560):1726-9.
Основные области использования: изучение развития опухолей кишечника
4.5 C57BL/6Kaiso
Окраска шерсти: черная.
Происхождение линии: линия получена в Эдинбургском Университете (Великобритания) в группе Егора Прохорчука путем генетического нокаута гена Kaiso в мышах линии C57BL/6.
Характеристика линии:
При переведении мутантного Kaiso локуса на генетический фон Min(APC) мышиной модели рака кишечника у животных возникает резистентность к злокачественной трансформации эпителиальных клеток.
Основные области использования:
изучение развития опухолей кишечника
5. Примеры использования нокаутированных мышей для изучения функций генов и наследственных заболеваний человека
Существует много примеров использования классического нокаута генов для изучения биологических функций индивидуальных генов или семейств генов. Рассмотрим лишь некоторые из них.
Изучение функций генов.
1) Ген Nuk, член семейства рецепторов тиронинкиназы, который был изучен с помощью делеций и модификаций. У мышей с отсутствием продукта этого гена нарушался контроль прорастания нейронов к клетке-мишени. Однако белок Nuk тАУ трансмембранный белок. Чтобы дифференцировать роль внутриклеточных и внеклеточных доменов в миграции аксонов были модифицированы участки гена, кодирующие оба типа доменов. В результате этой работы было показано, что в прорастании аксонов к мишеням основную роль играет внутриклеточный домен белка Nuk [11].
2) Для изучения процессов созревания лимфоцитов была внесена точечная мутация (стоп-кодон) в ген α-цепи рецептора иммуноглобулина. Мутантные мыши имели незначительные дефекты в раннем развитии В-лимфоцитов, но сильные отклонения в созревании и функциях зрелых лимфоцитов [24].
3) Метод классического нокаута гена был использован и для получения партеногенетических мышей. Гены Igf2 и H19 тАУ одни из основных импринтируемых генов млекопитающих, действующих в цис-положении и играющих ключевую роль в развитии организма. При этом для нормального развития необходимо наличие как отцовского, так и материнского набора хромосом. При развитии партеногенетических зародышей, получивших обе хромосомы от матери, ген Igf2 оказывается неактивен, что приводит к терминации развития. Делеция гена H19 в одной хромосоме позволила активировать ген Igf2 и получить условно партеногенетическое животное [17,18].
Модели генетических нарушений и заболеваний человека, созданные с использованием технологии нокаута генов.
1) Мутации гена TnI были обнаружены у пациентов с гипертрофической кардиомиопатией. Чтобы изучить влияние мутации в данном гене на развитие заболевания были созданы мыши с нокаутом по гену TnI. Гомозиготные нокаутированные животные умирали через 18 дней после рождения вследствие развившейся кардиомиопатии. Таким образом была доказана непосредственная связь мутации гена TnI с данным заболеванием [13].
2) Для изучения генетических основ развития алкоголизма было инактивировано 18 генов (альдегиддегидрогеназа, рецепторы дофамина, ГАМК-рецепторы, нейропептид Y и др.), предположительно участвующих в этом процессе. Все мутанты были охарактеризованы по поведенческим и фармакологическим тестам, что позволило оценить вклад изучаемых генов в развитие заболевания [4].
3) Большая работа с использованием методики нокаута генов проводилась с целью изучения функции опиоидной системы мозга. В обзорах [15,10] проанализированы результаты работ по инактивации μ, δ и κ - опиоидных рецепторов, а также опиоидных пептидов (β-эндорфин, препроэнкефалин и препродинорфин).
4) Инактивация гена FMR-1 мыши позволила создать модель синдрома ломкой Х хромосомы и изучить отклонения в поведении животных и молекулярные механизмы заболевания [2,6,9].
5) С помощью нокаута была показана роль рецептора инсулина и внутриклеточных белков-мессенджеров в развитии диабета второго типа [30], роль цитокинов и хемокинов в развитии астмы и др. респираторных заболеваний [27]. Также показано участие генетических факторов в развитии некоторых инфекционных заболеваний [7], участие NO синтазы в развитии атеросклероза [14], влияние продукта гена, кодирующего VI-a рецептор вазопрессина, на формирование социального поведения и поведения беспокойства у мышей [3].
Выводы
Прежде ученые могли просто выявлять те или иные изменения в генетическом материале животных и пытаться с помощью отбора выделить "чистые линии" обладающих теми или иными особенностями мышей. Этот пассивный путь не давал и толики той свободы, которую исследователи обрели, научившись напрямую воздействовать на нужный ген.
Самое продуктивное использование этой технологии тАУ "выключать" те или иные гены и смотреть, какое влияние оказало это выключение на организм животного. Таким образом можно точно установить функцию каждого гена, а значит, понять механизмы нормального развития организма и формирования определяемых наследственностью заболеваний тАУ рака, диабета, болезней сердца и т.д.
Это "выключение" получило название "генетического нокаута" (gene knockout). В наследственном материале мышей, по современным представлениям, функционирует около двадцати тысяч генов, каждый из которых, упрощенно говоря, отвечает за какой-либо признак в организме животного. К моменту присуждения Капекки, Смитису и Эвансу нобелевской премии ученым удалось исследовать последствия выключения половины из них, то есть десяти тысяч. Как говорится в сообщении Нобелевского комитета, в ближайшем будущем генетики надеются провести последовательный нокаут каждого из мышиных генов.
Нокаут, таким образом, дает возможность "препарировать" каждое генетическое заболевание и каждый аспект нормального развития живого существа, что делает его универсальным методом, приложимым практически в любой сфере исследований.
Список литературы
1. Репин В.С. Эмбриональная стволовая клетка: от фундаментальной биологии к медицине // Успехи физиологических наук. - 2001. - Т. 32, №1. - С. 3-18
2. Тронько М.Д., Пушкарьов В.М. Механiзм дii таксолу та перспективи його використання для лiку-вання злоякiсних пухлин щитоподiбноi залози // Ендокринологiя. тАУ 2003. тАУ 8, № 2. тАУ С. 228тАУ243.
3. Пушкарьов В.М., Ковзун О. I., Тронько М.Д. та iн. Участь фосфоiнозитидiв, протеiнкiназ С та А упередачi регуляторного сигналу К+ в адренокортикальних клiтинах людини // Укр. бiохiм. журн. тАУ2005. тАУ 77, № 1. тАУ С. 65тАУ71.
4. Копнин Б.П. Мишени действия онкогенов и опухолевых супрессоров: ключ к пониманию базовых механизмов канцрогенеза // Биохимия. тАУ 2000. тАУ 65, № 1. тАУ С. 5тАУ33.
5. Тронько М.Д., Левчук Н. I., Попадюк I.Д. та iн. Дiя протипухлинного препарату таксолу на клiтинианапластичного раку щитовидноi залози // Доп. НАН Украiни. тАУ 2006. тАУ № 8. тАУ С. 204тАУ206.
6. Фiляк РД., Фiляк О., Афанасьiв С., Стойка Р. Дефiцит гену бiлка секурину (PTTG) знижуi рiвеньактивацii Т лiмфоцитiв, iндукованоi лектином // Експерим. та клiн. фiзiологiя та бiохiмiя. тАУ 2006. тАУ№ 4. тАУ С. 18тАУ24.
7. Фiляк РД., Держко I., Фiляк О., Стойка Р. Втрата гену бiлка секурину (PTTG) веде до пригнiчення активацii Т-лiмфоцитiв // Мед. хiмiя. тАУ 2007. тАУ № 1. тАУ С. 11тАУ19.
8. Анисимов В.Н. Фактор времени в многостадийном канцерогенезе // Вопр.онкол.- 1990.- T. 36.- C. 771-784.
9. Анисимов В.Н. Канцерогенез и онтогенез: основные направления и результаты исследований // Вопр. онкологии. - 1997. - Т. 43, N 1. - С. 88- 94.
10. Анисимов В.Н. Роль индуцируемой 5-бромодезокcиуридином нестабильности генома в механизмах ускоренного старения и канцерогенеза // Успехи геронтологии. - 1997. -- Т. 1. - С. 50-56.
11. Бауэр Э.С. Теоретическая биология. - М.; Л.: Изд.-во Всесоюзного института экспериментальной медицины, 1935. - 206 с.
12. Газиев А.И., Подлуцкий А.Я. Бредбери Р. Увеличение с возрастом частоты спонтанных и индуцированных g-радиацией hprt-мутаций в лимфоцитах селезенки мышей // Докл. РАН. - 1994. - Т. 339. - С. 276-278.
13.
14. Bardoni B., Mandel J.L., Fisch G.S. FMR1 gene and fragile X syndrome // Am. J. Med. Genet. - 2000. - Vol. 97, №2. - P. 153-163.
15. Bielsky I.F., Hu S.B., Szegda K.L., Westphal H., Young L.J. Profound impairment in social recognition and reduction in anxiety-like behavior in vasopressin V1a receptor knockout mice // Neuropsychopharmacology. - 2004. - Vol. 29, №3. - P. 483-493.
16. Capecchi M.R. Altering the genome by homologous recombination // Science. - 1989. - Vol. 244. - P. 1288-1292.
17. Chen L., Toth M. Fragile X mice develop sensory hyperreactivity to auditory stimuli // Neuroscience. - 2001. - Vol. 103, №4. - P. 1043-1050.
18. Evans M.J., Kaufman M.H. Establishment in culture of pluripotential cells from mouse embryos // Nature. - 1981. - Vol. 292, №5819. - P. 154-156.
19. Frankland P.W., Wang Y., Rosner B., Shimizu T., Balleine B.W., Dykens E.M., Ornitz E.M., Silva A.J. Sensorimotor gating abnormalities in young males with fragile X syndrome and Fmr1-knockout mice // Mol. Psychiatry. - 2004. - Vol. 9. - P. 417-425.
20. Henkemeyer M., Orioli D., Henderson J.T., Saxton T.M., Roder J., Pawson T., Klein R. Nuk controls pathfinding of commissural axons in the mammalian central nervous system // Cell. - 1996. - Vol. 86. - P. 35-46.
21. Kawashima S., Yokoyama M. Dysfunction of endothelial nitric oxide synthase and atherosclerosis // Arterioscler. Thromb. Vasc. Biol. - 2004. - Vol. 24, №6. - P. 998-1005
22. Kieffer B.L., Gaveriaux-Ruff C. Exploring the opioid system by gene knockout // Prog. Neurobiol. - 2002. - Vol. 66, №5. - P. 285-306.
23. Kilby N.J., Snaith M.R., Murray J.A.H. Site-specific recombinases: tools for genome engineering // Trends Genet. - 1993. - Vol. 9. - P.413-421.
24. Kono T., Obata Y., Wu Q., Niwa K., Ono Y., Yamamoto Y., Park E.S., Seo J.S., Ogawa H. Birth of parthenogenetic mice that can develop to adulthood // Nature. - 2004. - Vol. 428, №6985. - P. 860-864.
25. Loebel D.A., Tam P.P. Genomic imprinting: mice without a father // Nature. - 2004. - Vol. 428, №6985. - P. 809-811.
26. Mansour S.L., Thomas K.R., Capecchi M.R. Disruption of the proto-oncogene int-2 in mouse embryo-derived stem cells: a general strategy for targeting mutations to non-selectable genes // Nature. - 1988. - Vol. 336, №6197. - P. 348-352.
27. Reeves R.H. Exploring development and disease through germ-line genetic engineering in the mouse // Anat. Rec. - 1998. - Vol. 253, №1. - P. 19-23.
28. Thomas K.R., Capecchi M.R. Site-directed mutagenesis by gene targeting in mouse embryo-derived stem cells // Cell. - 1987. - Vol. 51, №3. - P. 503-512.
29. Vasquez Y.R., Spina D. What have transgenic and knockout animals taught us about respiratory disease? // Respir. Res. - 2000. - Vol. 1, №2. - P. 82-86.
30. Volarevic S., Pende M., Pullen N. Manipulating mammalian genome by gene targeting // Croat. Med. J. - 1999. - Vol. 40, №3. - P. 368-374.
Вместе с этим смотрят:
G-белки и их функция
Австралопитеки - обезьянолюди или человекообезьяны?
Адаптация микроорганизмов в экстремальных условиях космоса
Адвентивна флора Чернiгiвськоi областi: iсторiя формування та сучасний стан
Адсорбция ионных и неионных поверхностно-активных веществ (ПАВ)