Состояние глутатионового звена антиоксидантной системы крови практически здоровых людей с лор-паталогиями, проживающих в различных районах города Красноярска
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ФОУ ВПО ВлСИБИРСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТВ»
ИНСТИТУТ ФУНДАМЕНТАЛЬНОЙ БИОЛОГИИ И БИОТЕХНОЛОГИИ
Кафедра биохимии и физиологии человека и животных
А.В.Тимохина
Студентка V курса
СОСТОЯНИЕ ГЛУТАТИОНОВОГО ЗВЕНА АНТИОКСИДАНТНОЙ СИСТЕМЫ КРОВИ ПРАКТИЧЕСКИ ЗДОРОВЫХ ЛЮДЕЙ И ЛЮДЕЙ С ЛОР-ПАТОЛОГИЯМИ, ПРОЖИВАЮЩИХ В РАЗЛИЧНЫХ РАЙОНАХ ГОРОДА КРАСНОЯРСКА
(дипломная работа)
Допустить к защите: Зав.кафедрой, д.м.н., проф. А.А.Савченко ____________ | Научный руководитель: к.б.н., доцент Т.Н. Субботина ___________ |
Красноярск 2008
СОДЕРЖАНИЕ
Список сокращений. 3
Введение. 4
Глава 1. Обзор литературы. 6
1.1. Уровень антропогенной нагрузки на здоровье населения в условиях промышленного города. 6
1.2. Активные формы кислорода: свойства и механизмы образования. 9
1.3. Характеристика антиоксидантной системы. 15
Глава 2. Материалы и методы. 24
2.1. Объект исследования. 24
2.2. Приготовление эритроцитов. 25
2.3. Определение содержание гемоглобина. 25
2.4. Определение количества восстановленного глутатионатАжтАжтАжтАжтАжтАжтАж26
2.5. Определение активности глутатионпероксидазы. 28
2.6. Определение активности глутатион-S-трансферазы. 29
2.7. Определение активности глутатионпероксидазы. 30
2.8. Статистическая обработка результатов. 32
Глава 3. Результаты исследований и их обсуждение. 33
3.1. Анализ содержания GSH и активности глутатионзависимых ферментов в эритроцитах крови практически здоровых людей и людей с ЛОР-заболеваниями. 33
3.2. Анализ содержание GSH и активность глутатионзависимых ферментов в эритроцитах крови практически здоровых людей, проживающих в различных по уровню загрязнения районах г.Красноярска. 37
3.3. Анализ содержание GSH и активность глутатионзависимых ферментов в эритроцитах крови здоровых мужчин и женщин. 40
3.4. Содержание GSH и активность глутатионзависимых ферментов в эритроцитах крови практически здоровых людей различного возраста. 41
Выводы. 44
Список литературы. 45
Summary. 52
СПИСОК СОКРАЩЕНИЙ
АФК тАУ активные формы кислорода
АОС тАУ антиоксидантная система
ДНК тАУ дезоксинуклеиновая кислота
КрАЗ тАУ Красноярский Алюминиевый Завод
ПОЛ тАУ перекисное окисление липидов
ПДК тАУ предельно допустимая концентрация
РНК тАУ рибонуклеиновая кислота
ТЭЦ тАУ топливо-энергитический центр
цАМФ тАУ цикло-аденозинмонофосфат
GSH тАУ восстановленный глутатион
GPO тАУ глутатионпероксидаза
GR тАУ глутатионредуктаза
GST тАУ глутатион-S-трансфераза
NADP тАУ никотинамидадениндинуклеотидфосфат окисленный
NADFH тАУ никотинамидадениндинуклеотидфосфат восстановленный
СРО тАУ свободнорадикальное окисление
NRF тАУ ядерный респираторный фактор
ВЕДЕНИЕ
В последние десятилетия в связи с огромным развитием промышленности экология индустриальных городов значительно ухудшилась, это результат больших техногенных выбросов предприятий стоящих на территории городов или вблизи них [Иванова с соавт., 2001].
По степени загрязнения атмосферы город Красноярск входит в число наиболее загрязненных городов Российской Федерации. На территории города располагаются крупные предприятия, которые являются основными поставщиками загрязняющих веществ в атмосферу города, к таким предприятиям относятся две ТЭЦ, алюминиевый, цементный, целлюлозно-бумажный, фармацевтический заводы [Симонова, 2002]. Только ОАО ВлКрасноярский Алюминиевый заводВ» имеет объемы выбросов в атмосферу в размере 58,6 тыс. в год. Основными компонентами химического загрязнения окружающей среды от КрАЗа являются: фтористый водород, плохорастворимые неорганические фториды, оксиды алюминия, оксид углерода бенз(а)пирен, сернистый ангидрид [Игамбердиев, 2004]. Превышение ПДК наблюдается по фторидам газообразным - до 2,79 раз; по бенз(а)пирену тАУ до 4,42 раз; по плохо растворимым фторидам тАУ до 3,16 раз. При этом уровень загрязнения атмосферы жилой зоны города по фторидам газообразным составил 1,19-1,57 ПДК на 2003 год [Реброва, 2003]
По данным ряда авторов фтор и его производные в умеренных дозах является необходимым элементом живых организмов, наибольшее его содержание отмечено в зубах и костях, низкие концентрации тАУ повышают устойчивость зубов к кариесу, стимулируют кроветворение, репаративные процессы при переломах костей и реакции иммунитета, участвуют в росте скелета, избыточное поступление фтора в организм вызывает флюороз. При ингаляционном поступлении в организм газообразных соединений фтора и содержащих фтор аэрозолей возникают атрофические изменения слизистой оболочки верхних дыхательных путей и бронхов, возможно развитие ринита, фарингита, ларингита [Богданов, Гембицкий, 1975].
Дыхательная система является входными воротами для попадания в организм поллютантов техногенного происхождения. Действия пылевых частиц на респираторные органы вызывает образование большого числа активных форм кислорода (АФК), и приводят к развитию окислительного стресса. Антиоксидантная система осуществляет защиту организма от пагубного действия прооксидантов и ограничивает развитие окислительного стресса [Ковальчук, 2004].
ЦЕЛЬ: оценить состояние глутатионового звена антиоксидантной системы в эритроцитах крови практически здоровых людей и людей с ЛОР-заболеваниями, проживающих в различных по уровню загрязнённости районах города Красноярска.
ЗАДАЧИ РАБОТЫ:
1. Изучить содержание GSH и активность GPO, GST и GR в эритроцитах крови практически здоровых людей и людей с хроническим ЛОР-заболеваниями.
2. Определить содержание GSH и активность GPO, GST и GR в эритроцитах крови практически здоровых людей проживающих в различных по уровню загрязнения районах г. Красноярска.
3. Провести сравнительный анализ содержания GSH и активности GPO, GST и GR в эритроцитах крови практически здоровых мужчин и женщин.
4. Выяснить содержание GSH и активность глутатионзависимых ферментов в эритроцитах крови практически здоровых людей различного возраста, проживающих в районах с разной техногенной нагрузкой г. Красноярска.
Работа выполнена на базе кафедры биохимии и физиологии человека и животных Института фундаментальной биологии и биотехнологии Сибирского федерального университета.
ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ
1.1. Уровень антропогенной нагрузки на здоровье населения в условиях промышленного города
Анализ исследований за последнее десятилетие показал, что атмосферный воздух загрязняется вследствие образования загрязняющих веществ в концентрациях, превышающих нормативы качества или уровня естественного содержания. Мощность антропогенного воздействия на атмосферу увеличивается с каждым годом. За последние 25 лет ее техногенная запыленность возросла на 70%. Ежегодно, в результате деятельности человека, в атмосферу выбрасываются миллионы тонн загрязняющих веществ: диоксиды серы, оксидов азота, углерода, хлорфторуглероды (фреоны), которые отрицательно действуют на физико-химические свойства атмосферы и на здоровье людей [Пинигин, 1991; Новиков,1999].
Наиболее активными поставщиками поллютантов тАУ веществ, загрязняющих атмосферу, являются автомобили, коксохимические, цементные, нефтеперерабатывающие, сталеплавительные, целлюлозобумажные, металлургические заводы, ТЭЦ, то есть отрасли, без процветания которых современный человек не мыслит своего существования [Онищенко, 2003].
Практически каждый поллютант является высокотоксичным веществом, постепенно разрушающим здоровье человека. Так, например, при сгорании угля и мазута выделяется двуокись серы, она вызывает легочные и аллергические заболевания, окись углерода, образующаяся при сгорании всех видов топлива, поражает сердечно-сосудистую систему, углеводороды, содержащиеся в выхлопных газах автомобилей, канцерогены, пылевидные отходы (цементный завод выбрасывает около 15 тонн пыли в сутки) провоцирует развитие бронхиальной астмы, заболеваний легких [Савин, 2001].
Как известно, человек подвержен экологическому влиянию не только в широком смысле понимания этого термина как окружающей человека среды, но и непосредственно во время его производственно - профессиональной деятельности. Трудовая деятельность человека не только ухудшает качество среды, но и обеспечивает условия труда, которые, являясь существенным фактором части окружающей среды (производственной среды), зачастую оказывают негативное влияние на работающего человека [Haglof, 2003]. Абсолютные величины предельно допустимых концентраций (ПДК) одних и тех же веществ в воздухе рабочей зоны от нескольких десятков до нескольких тысяч раз выше среднесуточных ПДК для атмосферы [Кучма, 2002]. Поэтому суммарная нагрузка вредными веществами на рабочего во столько же выше по сравнению с нагрузкой на население в целом. Наиболее распространенным профессиональным заболеванием рабочих алюминиевого производства является хроническая фтористая интоксикация тАУ профессиональный флюороз, который составляет 70 % всех профессиональных заболеваний в данной области [Коцнельсон с соавт., 2000]. Обязательным проявлением профессионального флюороза является не только остеосклероз, но и дегенеративно-дистрофические изменения опорно-двигательного аппарата по существу возрастного характера, что развиваются они намного раньше и носят не только двухсторонний, но и симметричный характер. Явно опережающей хронологические сроки наступление кардинального признака старения (вероятности смерти по мере взросления) является и демографическая ситуация. Так продолжительность жизни рабочих алюминиевого завода составляет около 44 лет. Сроки развития профессионально флюороза зависят в большей степени от возраста начала работы в контакте с фтористыми соединениями и мышечных нагрузок [Гичев, 2002].
Изучение закономерностей формирования здоровья населения, проживающего в зоне влияния выбросов алюминиевых производств, остается актуальной гигиенической задачей. Как известно, основными вредными факторами алюминиевого производства является фтор, его соли и фтористый водород. По данным ряда авторов уровень загрязнения атмосферного воздуха фтористыми соединениями в зоне влияния выбросов алюминиевого завода превышает ПДК в 1,6-2,1 раза. Фтористые соединения так же обнаруживаются в воде и почве и превышают контрольные в 5 раз [Иванова с соавт., 2001]. Токсичные соединения фтора в значительном количестве поступают через дыхательные пути, с продуктами питания, питьевой водой. Имеется ряд исследований о влиянии фтористых соединений на состояние перекисного окисления липидов мембран клеток и антиоксидантной защиты [Cavalca, et al., 2001]. Длительное воздействие на организм токсичных соединений фтора, фтористоводородной кислоты приводит к формированию выраженных функционально-структурных нарушений, к угнетению биоэнергетического обмена в эритроцитах, белково-образовательной функции печени, усилению пролиферативно-клеточной реакции. Высокая реакционность фтора делает возможным его проникновение через защитные барьеры организма, нарушая целостность мембран, усиливая процессы липопероксидации. Результаты ряда исследований свидетельствую о том, что фтор и его соединения вызывают системное поражение организма, которое проявляется рядом специфических заболеваний [Кацнельсон с соавт., 2000].
В литературе приводятся данные, что для интоксикации фтором характерно разнообразное воздействие на обменные процессы. Этот элемент обладает высоким сродством к некоторым элементам, например, кальцию и магнию, с которыми он комплексуется в клетке [Мамырев, Богатова, 2002]. Фтор способен выступать в качестве регулятора ферментативной активности в клетке. Он обладает ингибирующим действием на металлопротеины. Это, по-видимому, обусловлено тем, что он представляет собой один из наиболее тАЬжесткихтАЭ лигандов, то есть, способен образовывать прочные комплексы с ионами тАЬжесткихтАЭ металлов, к которым относятся почти все металлы в биологических системах [Генкин, Глотов, Ждахина, 1983]. В силу этого обстоятельства при увеличении концентрации фтор способен тАЬвклиниватьсятАЭ в структуру биокоординационных соединений и замешать некоторые ионы-лиганды (например, гидроксил-ионы), в результате чего изменяется конформация соединения, что и приводит к тАЬухудшениютАЭ взаимодействия фермента с субстратом, то есть к ингибированию ферментативной активности [Ройт,1991]. Наибольшей прочностью отличается соединение фтора с ионами магния, в силу чего большинство Мg2+-зависимых ферментных систем по своей чувствительности к ингибирующему воздействию фтора в несколько раз превосходят ферменты, активируемые другими ионами, например Мn2+.Существуют данные о влиянии фтора на активность некоторых энзимов, например липаз, через их лабильный компонент тАУ кофермент [Разумов, 1997]. Из литературных источников известно, что фтор способен оказывать ингибирующее влияние на ферменты цикла трикарбоновых кислот и цепи переноса электронов: НАДН- зависимые дегидрогеназы, цитохромоксидазу, сукцинатдегидрогеназу, a-кетоглутаратдеги-дрогеназу. Наибольшей чувствительностью из них к фтору обладает сукцинатдегидрогеназа [Abiaka, 2000].
1.2. Активные формы кислорода: свойства и механизмы образования
Обязательным атрибутом нормальной аэробной жизни является генерация АФК тАУ прооксидантов. Функционирование и развитие клеток не могло быть возможным без существования защитных систем, к которым относиться специализированные ферментативные и неферментативные актиоксиданты [Меньщикова c соавт, 2006]. Постоянное образование прооксидантов уравновешенно их дезактивацией антиоксидантами, поэтому для поддержания гомеостаза необходимо непрерывная генерация антиоксидантной способности. Отсутствие или сбой этой непрерывности приводят к развитию окислительного стресса, к возникновению и накоплении окислительных повреждений, что сопровождает ряд физиологических процессов тАУ таких как воспаление, реперфузионное поражение тканей, бронхо-легочное заболевание, старение и др.
В живых организмах существует два разных источника АФК: радикальные окислительные реакции и металопротеиновые ферментативные системы. В обоих случаях молекулярный кислород выступает акцептором электронов. Наличие у молекулярного кислорода двух неспаренных электронов существенно ограничивает его реакционную способность. В процессе эволюции у живых организмов выработались специальные ферментативные системы, которые восстанавливают молекулярный кислород, перенося на него один, два или четыре электрона. Главные ферменты, которые осуществляют метаболизм кислорода в организме млекопитающих тАУ оксидазы и оксигеназы. В активных центрах этих ферментов кислород превращается в этих продуктах и не выходит в окружающую среду, но при этом они не подвергают опасности органические молекулы, а опасными являются активные формы кислорода, которые образуются как побочные вещества в ходе этих превращений [Меньщикова c соавт, 2006].
Главные АФК: супероксидный радикал 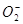 , перекись водорода
, перекись водорода 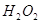 , гидроксильный радикал
, гидроксильный радикал 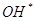 , синглетный кислород
, синглетный кислород 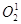 , гипогалоиды алкоксильный радикал
, гипогалоиды алкоксильный радикал 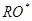 и перекисный радикал
и перекисный радикал 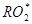 .
.
Характеристика основных форм АФК
Супероксидный радикал. Присоединение одного электрона к молекуле кислорода в основном состоянии приводит к образованию супероксидного анион радикала (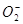 ), который при взаимодействии с протоном переходит в гидроперекисный радикал (
), который при взаимодействии с протоном переходит в гидроперекисный радикал (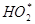 ) [Бурлакова с соавт., 1992]. В живых системах супероксидный анион является промежуточным продуктом многих биохимических реакций тАУ окисление тиолов, флавинов, хинонов, катехоламинов, птеринов, ксонобиотиков. Но основные источники его образование тАУ ферментативные системы: NADFH-оксидаза фагоцитирующих клеток, ксантиноксидаза, митохондриальная цитохром-с-оксидаза и микросомальные монооксигеназы. При активации фагоцитов в очаге воспаления генерация
) [Бурлакова с соавт., 1992]. В живых системах супероксидный анион является промежуточным продуктом многих биохимических реакций тАУ окисление тиолов, флавинов, хинонов, катехоламинов, птеринов, ксонобиотиков. Но основные источники его образование тАУ ферментативные системы: NADFH-оксидаза фагоцитирующих клеток, ксантиноксидаза, митохондриальная цитохром-с-оксидаза и микросомальные монооксигеназы. При активации фагоцитов в очаге воспаления генерация 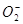 служит пусковым звеном целого каскада реакций, приводящих к образованию других форм АФК. Для регуляции уровня
служит пусковым звеном целого каскада реакций, приводящих к образованию других форм АФК. Для регуляции уровня 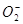 в клетках служит высокоспецифичный фермент тАУ антиоксидант супероксиддисмутаза, которая существенно ускоряет реакции дисмутации
в клетках служит высокоспецифичный фермент тАУ антиоксидант супероксиддисмутаза, которая существенно ускоряет реакции дисмутации 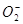 до перекиси водорода [Зенков, Меньщикова, 2004].
до перекиси водорода [Зенков, Меньщикова, 2004].
Перекись водорода. Присоединение двух электронов к молекуле кислорода или одного электрона к аниону 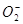 сопровождается образованием двухзарядного аниона
сопровождается образованием двухзарядного аниона 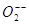 , который в свободном состоянии не существует, присоединяя протоны он переходит в гидроперекисный анион
, который в свободном состоянии не существует, присоединяя протоны он переходит в гидроперекисный анион 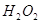 [Brune, Messmer, 1995]. Перекись водорода тАУ слабый окислитель, в отсутствии каталазы и ионов металлов переменной валетности она относительно стабильна и может мигрировать в клетке и ткани. В живых организмах источниками
[Brune, Messmer, 1995]. Перекись водорода тАУ слабый окислитель, в отсутствии каталазы и ионов металлов переменной валетности она относительно стабильна и может мигрировать в клетке и ткани. В живых организмах источниками 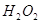 служат ферментативные реакции с оксидазами, реакция дисмутации, катализируемая SOD [Зенков, Меньщикова, 2004].
служат ферментативные реакции с оксидазами, реакция дисмутации, катализируемая SOD [Зенков, Меньщикова, 2004].
Клетки млекопитащих достаточно устойчивы к воздействию 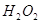 , благодаря наличию глутатионпероксидазной и каталазной ферментативных систем, первая из которых эффективно работает при малых концентрациях перекиси, вторая тАУ при высоких.
, благодаря наличию глутатионпероксидазной и каталазной ферментативных систем, первая из которых эффективно работает при малых концентрациях перекиси, вторая тАУ при высоких.
Гипогалоиды. Образуются главным образом в результате ферментативной реакции перекиси водорода с галидами, катализируемой миелопероксидазой, пероксидазой эозинофилов, которые различаются по структуре и субстратной специфичности. Основным продуктом миелопероксидазы является 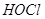 , пероксидаза эозинофилов катализирует образование
, пероксидаза эозинофилов катализирует образование 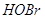 и
и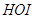 . Гипогалоиды инактивируют
. Гипогалоиды инактивируют 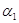 -антитрипсин, переводят коллагеназу в активную форму Б, окисляют лейкотриены, иммуноглобулины, альбумин, церулоплазмин, трансферрин. Вызывают структурную модификацию и инактивацию
-антитрипсин, переводят коллагеназу в активную форму Б, окисляют лейкотриены, иммуноглобулины, альбумин, церулоплазмин, трансферрин. Вызывают структурную модификацию и инактивацию 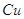 ,
,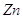 -SOD могут как индуцировать, так и ингибировать процессы ПОЛ.
-SOD могут как индуцировать, так и ингибировать процессы ПОЛ.
Гидроксильный радикалявляется наиболее реакционноспособным АФК, образующимся в биологических системах, он может разрывать любую углеродную связь [Андреев, 1999]. Образование ОН-радикала показано в реакциях окисления арахидоновой кислоты, в реакции Габера-Вейса, при микросамальном окислении, в реакциях с флавиновыми ферментами и убихиноном, но основным источником OH-радикалов в биологических системах служит реакция Фентона с участием металлов переменной валентности, главным образом 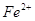 :
:
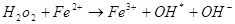
Обратное восстановление 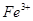 возможно в реакции с
возможно в реакции с 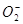 :
:
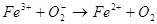
а также при взаимодействии с аскорбиновой кислотой, глутатионом, цистеином и другими окисляющимися соединениями [Зенков, Меньщикова, 2004].
Синглетный кислород. В кислороде внутримолекулярно происходит перестройка электронов и возникает более высокий энергетический уровень [Владимиров, 1998]. Источником синглетного кислорода являются реакции фотосенсибилизированного окисления биологических субстратов, при не фотохимических реакциях не ферментативная дисмутация супероксидных радикалов, протекающие с образованием перекиси водорода.  обладает высокой химической активностью, особенно по отношению к молекулам, содержащим участки повышенной электронной плотности.
обладает высокой химической активностью, особенно по отношению к молекулам, содержащим участки повышенной электронной плотности.
Алкоксильные и перекисные радикалы. При развитии радикальных окислительных процессов взаимодействие органических радикалов молекулярным кислородом приводят к образованию перекисных радикалов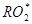 , которые с алкоксильными радикалами
, которые с алкоксильными радикалами 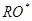 могут образовываться в реакциях разложения перекиси в присутствии ионов металлов переменной валентности. По физико-химическим свойствам алкоксильные и перекисные радикалы это очень гетерогенный класс соединений, включающий высокореакционный OH-радикал и мало активные радикалы фенольных антиоксидантов. Взаимодействие
могут образовываться в реакциях разложения перекиси в присутствии ионов металлов переменной валентности. По физико-химическим свойствам алкоксильные и перекисные радикалы это очень гетерогенный класс соединений, включающий высокореакционный OH-радикал и мало активные радикалы фенольных антиоксидантов. Взаимодействие 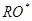 и
и 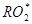 с углеводородами, приводящие к образованию
с углеводородами, приводящие к образованию 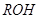 и
и 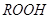 - это наиболее медленная стадия развития радикальных окислительных процессов [Владимиров, 1998].
- это наиболее медленная стадия развития радикальных окислительных процессов [Владимиров, 1998].
Биологический эффект 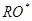 и
и 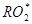 реализуется через повреждающее действие на белки, ферменты, нуклеиновые кислоты, через продукты ПОЛ тАУ органические перекиси, альдегиды, кетоны, эпоксиды, которые высокотоксичны для клеток. Ингибиторы тАУ аскорбиновая кислота, мочевая кислота, убихинон, селен,
реализуется через повреждающее действие на белки, ферменты, нуклеиновые кислоты, через продукты ПОЛ тАУ органические перекиси, альдегиды, кетоны, эпоксиды, которые высокотоксичны для клеток. Ингибиторы тАУ аскорбиновая кислота, мочевая кислота, убихинон, селен,  -токоферол [Андреев, 1999].
-токоферол [Андреев, 1999].
Все формы АФК обладают высокой цитотоксичностью для клеток и клеточных образований. Можно выделить четыре мишени окислительной цитотоксической атаки АФК: индукция процессов ПОЛ в биологических мембранах, повреждение мембрансвязанных белков, инактивация ферментов и повреждение ДНК клеток.
Аминокислоты, из которых состоят белки, подвержены окислительному действию АФК, что приводит к трем вариантам изменения физико-химических свойств белков: фрагментации, агрегации и повышению чувствительности к протеолизу. В первую очередь воздействию кислородных радикалов подвергаются остатки пролина гистидина и аргинина. Окислительное повреждение приводит к денатурации и агрегации белков (хрусталика глаза). Агрегация белков связана со способностью АФК образовывать межмолекулярные сшивки. В результате денатурации белков нарушается их конформация, иони становятся более уязвимыми к действию протеолитических ферментов [Зенков, Меньщикова, 2004].
Окислению АФК в первую очередь подвергаются SН-содержащие группы белков; их окисление приводит к снижению содержания восстановленных и повышению уровня окисленных SН-групп, поэтому соотношение окисленных и восстановленных SН-групп белков может быть использовано в качестве показателя развития окислительного стресса. Наиболее подвержена окислительному стрессу Са2+-АТФаза, ее повреждение приводит к нарушению транспорта кальция через мембрану [Владимиров, 1999].
Карбонильные группы и гидроперекиси, образующиеся при окислении белков, также является показателем свободнорадикального окисления.
Окисление липидных молекул приводит к необратимому изменению мембранных структур, нарушению их проницаемостью для ионов. Наиболее подвержены перекисному окислению входящие в состав мембран ненасыщенные жирные кислоты: линолевая, арахидоновая, докозагексаеновая [Козлов, 2006]. Одним из важнейших следствий избыточного образования АФК является избыточная и неконтролируемая в этих условиях активация процессов ПОЛ. Процессы ПОЛ можно условно подразделить на три последовательных этапа, или фазы развития: процессы зарождения цепей, процессы развития цепных реакций и обрыв цепей. На стадии зарождения цепей под действием свободных радикалов кислорода, ионизирующей радиации, ультрафиолетового облучения и ряда химических веществ, относящихся к прооксидантам, происходит образование органических радикалов (R).
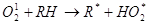
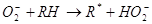
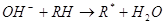
На следующей стадии радикал быстро взаимодействует с кислородом, который выступает в качестве акцептора электронов. В результате происходит образование пероксирадикала (RО2), который атакует ненасыщенные липиды. Возникновение в результате этой реакции органических перекисей и нового радикала (R) способствует продолжению окислительных реакций, приобретающих цепной характер:
R + О2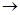 RО2
RО2
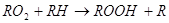
Органические перекиси (RООН) включаются в процесс генерации радикалов, в присутствии металлов переменной валентности (меди, кобальта, марганца, железа) происходит образование реакционного алкоксильного радикала:
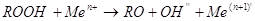
Часть образующихся органических радикалов взаимодействует друг с другом, при этом происходит образование неактивных молекул, что обрывает ход реакций свободнорадикального окисления. Гидроперекиси липидов способны подвергаться нерадикальным окислительным превращениям, что приводит к образованию первичных (диеновые коньюгаты, диальдегиды), промежуточных (основания Шиффа) и конечных продуктов ПОЛ, а также спиртов, кетонов и альдегидов. Обрыв цепных реакций перекисного окисления возможен при взаимодействии радикалов со специализированными ферментными системами, а также с рядом низкомолекулярных веществ, совокупно формирующих биохимический компонент антиоксидантной системы организма [Меньщикова с соавт., 2006].
Одним из конечных продуктов ПОЛ является насыщенные низкомолекулярные углеводороды (этан, гексан, пентан), которые в нормальных условиях переходят в газообразное состояние.
Идентифицировано более 20 типов окислительных повреждений молекул нуклеиновых кислот: различные повреждение оснований, возникновение одно- и двух цепочечных разрывов, сшивок и хромосомных аберраций. Прямое действие и
и  на ДНК не вызывает повреждения оснований или образования сшивок между основаниями. Основным повреждающим агентом выступает OH-радикал, который эффективно взаимодействует с дезоксирибозой, пуриновыми и пиримидиновыми основаниями. Синглетный кислород более специфично, чем
на ДНК не вызывает повреждения оснований или образования сшивок между основаниями. Основным повреждающим агентом выступает OH-радикал, который эффективно взаимодействует с дезоксирибозой, пуриновыми и пиримидиновыми основаниями. Синглетный кислород более специфично, чем 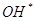 , взаимодействует с гуанином. Перексинитрит вызывает нитрозилирование и дезаминирование аминогрупп в основаниях ДНК, при этом 8-нитрогуанин является индикатором повреждающего действия пероксинитрита. В условиях окислительного стресса в наибольшей степени повреждается ДНК митохондрий, что связано с низкой активностью систем репарации и низким содержание гистоновых белков, оказывающие защитное действие [Зенков, Менщикова, Шергин, 1993].
, взаимодействует с гуанином. Перексинитрит вызывает нитрозилирование и дезаминирование аминогрупп в основаниях ДНК, при этом 8-нитрогуанин является индикатором повреждающего действия пероксинитрита. В условиях окислительного стресса в наибольшей степени повреждается ДНК митохондрий, что связано с низкой активностью систем репарации и низким содержание гистоновых белков, оказывающие защитное действие [Зенков, Менщикова, Шергин, 1993].
1.3. Характеристика антиоксидантной системы
В процессе эволюции в клетках для защиты от АФК выработались специализированные системы: ферментативная антиоксидантная система (АОС) и неферментативная АОС. В качестве неферментативной АОС могут выступать: жирорастворимые антиоксиданты (витамин Е, β-каротин, убихиноны) [Абрамова, 2004], водорастворимые (аскорбат, рутин, глутатион). Гидрофобные антиоксиданты локализованы в биомембраннах, гидрофильные - в цитозоле клетки.
Ферментативная АОС включает: супероксиддисмутазу (SОD), катализирующую реакцию дисмутации О2ˉ в Н2О2, каталазу (CАТ), разлагающей Н2О2, глутатионпероксидазу (GPO), глутатион-S- трансферазу (GSТ), глюкозо-6-фосфатдегидрогеназу (G6FD), глутатионредуктазу (GR), глутатионзависимые ферменты удаляют органические перекиси [Брискин, Рыбаков 2000].
Супероксиддисмутаза имеет несколько изоферментных форм, различающихся строением активного центра. Медь-цинковая форма чувствительна к цианиду и содержится в цитозоле и межмембранном пространстве митохондрий клеток эукариот, марганецсодержащая форма локализована в митохондриях клеток эукариот, а так же бактерий, экстрацеллюлярная высокомолекулярная форма SOD (Э-SOD) [Биленко,1999]. Э-SOD обладает высоким сродством к гепарину и хорошо связывается с гепаринсульфатом гликокаликса эндотелиоцитов. Нативная форма SOD выдерживает нагревание при 100ºС в течение одной минуты, устойчив к колебаниям значений pН в широком диапазоне. SOD существенно ускоряет реакцию дисмутации О2ˉ, обрывая тем самым опасную цепь свободнорадикальных превращений кислорода:
О2ˉ + О2ˉ → H2O2 + O2
HO+ HO. → H2O2 + O2
HO.2 + Н+ → H2O2 + O2
В определенных условиях медьсодержащая форма SOD может взаимодействовать с перекисью водорода и выступать в качестве прооксиданта, инициируя образование радикалов тАУ супероксида и гидроксила:
Cu2+-СОД + H2O2 ←→ Cu+-СОД + 2Н+ + О2ˉ
Cu+-СОД + H2O2 ←→ Cu2+-СОД + ОН. + ОН+
СОД играет важную роль в защите клеток от действия супероксид-анион радикала, стабилизирует клеточные мембраны, предотвращая процессы ПОЛ, снижая уровень О2ˉ, она защищает от его дезактивирующего действия CAT и GPO [Александров,2007].
Регулирующее влияние на активность SOD оказывают глутатион, цистеин, другие SH-содержащие соединения, а также опосредованно ферменты глутатионового обмена [Зенков, Меньщикова, 2004].
Каталаза тАУ фермент, участвующий в детоксикации нерадикальной активной формы кислорода тАУ Н2О2. Эта гемсодержащий фермент, локализованный преимущественно в пероксисомах клеток. Большая молекулярная масса фермента препятствует его проникновению через клеточную мембрану [Биленко, 1999]. Разложение Н2О2 каталазой осуществляется в два этапа.
CAT + Н2О2 → CAT - Н2О2
CAT - Н2О2 + Н2О2 → CAT + 2Н2О + О2
При этом в окисленном состоянии каталаза работает и как пероксидаза, катализируя окисление спиртов или альдегидов:
CАТ - Н2О2 + >CHOH→ CАТ + 2Н2О + >C=O
Каталаза ингибируется азидом, цианидом, пероксидом водорода в высоких концентрациях и некоторыми органическими гидроперекисями. Каталаза может выступать источником образования АФК. 0,5% кислорода, образующегося в результате разложений перекиси водорода, возникает в возбужденном синглетном состоянии.
Глутатионпероксидаза тАУ фермент, служащий для инактивации перекиси водорода в клетках высших животных. GPOтАУ гликопротеин, имеющий в активном центре четыре атома селена. Он является гидрофильным соединением, что затрудняет его проникновение в липидный слой мембран, основная часть фермента локализована в цитозоле, а остальная тАУ в митохондриях. GPO имеет селеновые изоферменты: внеклеточное GPO, обнаруженная в плазме и молоке, GPOтАУ G1, выделенная из цитозоля клеток печени и кишечника, а также неселеновый изофермент, идентичный GSТ.
ВлКлассическаяВ» GPO представляет собой тетрамер, состоящий из четырех идентичных сферических субъединиц. Каждая субъединица содержит по одному атому селена, на тетрамер имеется два активных GSH-связывающих центра. При уменьшении уровня GPO снижается устойчивость организма к окислительному поражению, что может приводить к развитию свободнорадикальной патологии [Белоусов, Суслова, Трунова, 1998].
GPO катализирует реакцию восстановления глутатионом нестойких органических гидропероксидов, включая гидропероксиды полиненасыщенных жирных кислот, стабильные соединения тАУ оксикислоты:
2GSH + ROOH→ GSSG + ROH + H2O
Все GPO, подобно каталазе, способны также утилизировать перекись водорода:
2GSH + H2O2 →GSSG + 2H2O
Также селенсодержащая GPO участвует в обезвреживании пероксинитрита:
2GSH + ONOO- → GSSG + NO + H2O
Сродство GPO к Н2О2 выше, чем у каталазы, поэтому первая более эффективно работает при низких концентрациях перекиси водорода, в то же время в защите клеток окислительного стресса, вызванного высокими концентрациями Н2О2, ключевая роль принадлежит каталазе. В целом же, GPO значительно важнее, чем каталаза, так как каталаза сосредоточена в микросомах, а GPO тАУ в цитозоле и митохондриях, сродство GPO к пероксиду водорода значительно выше, поэтому Н2О2 элиминируется GPO, в некоторых тканях каталаза почти ответствует и GPO играет главную роль в валовом метаболизме Н2О2 [Зубакова, Варакина, Николенко, 1999]. В клетках млекопитающих также обнаружен изофермент GPO, названный ВлGPO гидроперекисей фосфолипидовВ». Изофермент помимо Н2О2 и липидных гидроперекисей способен восстанавливать гироперекиси фосфолипидов, он эффективно взаимодействует с гидроперекисями фосфотидилхолина, холестерина и эфира холестерина в мембранах и липопротеинах низкой плотности. Совместно с токоферолом GPO гидроперекисей фосфолипидов практически полностью подавляет ПОЛ в биомембранах.
Активность GPO в живых клетках увеличивается при действии ионизирующей радиации, интоксикации этанолом, акрилонитрилом, при Е-авитаминозе. Особо важна роль GPO в условиях окислительного стресса, так как он предупреждает возникновение и развитие пероксидации, устраняет ее источники и продукты, GPO тАУ является одним из важнейших компонентов ферментативной АОС [Брискин, Рыбакова, 2000].
Глутатион-S-трансфераза входит в семейство ферментов, нейтрализующих токсическое влияние различных гидрофобных и электрофильных соединений путем их коньюгации с восстановленным глутатионом, GST локализованы преимущественно в цитозоле клеток. Основная функция GST-защита клеток от ксенобиотиков и продуктов ПОЛ посредством их восстановления, присоединения к субстрату молекулы глутатиона или нуклеофильного замещения гидрофобных групп:
ROOH + 2GSH→ ROH + GSSG + H2O
R + GSH→ HRSG
RX + GSH→ RSG + HX
GST способны восстанавливать гидроперокси-группы окисленных фосфолипидов непосредственно в мембранах без их предварительного фосфолипидного гидролиза свободными жирными кислотами. Этот фермент конъюгирует с GSН токсичные продукты ПОЛ (ноненали, децинали, холестерин-α-оксид) и тем способствуют их выведению из организма. Таким образом, GST является важным компонентом антиоксидантной защиты, особенно от эндогенных метаболитов, образующих при окислительном стрессе [Владимиров, 1998].
Глутатионредуктаза. Во многих реакциях, катализируемых GPO и GST, две молекулы GST соединяются дисульфидной связью и образуют окисленный глутатион. Для восстановления GSSG в клетках существует специальный фермент тАУ глутатионредуктаза [Зенков, Меньщикова, 2004].
ГР широко распространенный флавиновый фермент, поддерживающий высокую внутриклеточную концентрацию GSH, катализируя обратимое NFDFHтАУ зависимое восстановление GSSG с образованием двух молекул GSH.
GSSG + NADFH + H+ → 2GSH + NADF+
ГР содержится в основном в растворимой части клетки.
Глюкоза-6-фосфатдегидрогеназа. Для восстановления окисленного глутатиона ГР в качестве донара водорода используется NADFH, который образуется в пентозофосфатном пути в ходе глюкозо-6-фосфатдегидрогеназной реакции [Андреев, 1999]
G6FD тАУ фермент, катализирующий начальную реакцию пентозофосфатного пути: восстановление глюкозо-6-фосфата в 6-фосфоглюконат. Она состоит из двух типов субъединиц, которые состоят из 479 аминокислотных остатков, имеют один и тот же СООН - концевой участок, но разные NH2-концы, Эти субъединицы различаются по длине и последовательности аминокислот. Реакцию, катализируемую G6FD, с кинетической точки зрения можно рассматривать как двухсубстратную реакцию, протекающую с участием субстрата и кофермента, выполняющего роль второго субстрата. Фермент очень сильно ингибируется NAD
Вместе с этим смотрят:
G-белки и их функция
Австралопитеки - обезьянолюди или человекообезьяны?
Адаптация микроорганизмов в экстремальных условиях космоса
Адвентивна флора Чернiгiвськоi областi: iсторiя формування та сучасний стан
Адсорбция ионных и неионных поверхностно-активных веществ (ПАВ)