Участие митохондриального АТФ-ингибируемого калиевого канала в адаптации животного к гипоксическому состоянию
Любое патологическое состояние прямо или косвенно связано с нарушением кислородного гомеостаза организма. Инсульты, инфаркты, ишемические состояния различных органов, инфекционные заболевания - это лишь небольшой перечень тех патологий, в основе генеза которых лежит гипоксия.
В настоящее время многие исследователи склоняются к тому, что активация митохондриального АТФ-ингибируемого калиевого канала является важным моментом в адаптации к гипоксии. [23, 30, 51].
Следует отметить, что этот канал был впервые изолирован из внутренней митохондриальной мембраны в лаборатории митохондриального транспорта [4], и в настоящее время проводится изучение его свойств [42].
В данной работе приводятся доказательства участия митохондриального АТФ-ингибируемого калиевого канала в адаптации животного к гипоксическому состоянию. Нами впервые обнаружено, что адаптация ведет к активации калиевого цикла в митохондриях.
В настоящее время обнаружен ряд модуляторов канала, влияющих на его активность. В связи с этим, существует перспектива использования этих модуляторов для повышения адаптации организма к гипоксическому состоянию.
Полученные данные были представлены на Всероссийской конференции молодых ученых ВлФундаментальная наука и клиническая медицинаВ» (Санкт-Петербург 2007), на конференции. (Пенза 2007), а также в сборнике научных работ ВлСовременный мир, природа и человекВ» т.4 № 1 с. 40.(Томск, 2007)
Глава 1. Обзор литературы
1.1. Системы транспорта ионов калия в митохондриях
Известно, что во внутренней мембране митохондрий локализуются ферменты синтеза АТФ, системы транспорта ионов и субстратов дыхания, а также переносчики электронов дыхательной цепи. При работе последних на мембране митохондрий создается потенциал (DY) около 190 мВ, который используется для синтеза АТФ. Существование высокого отрицательного DY создает предпосылки для входа в митохондрии катионов, среди которых основным является калий. Вход катионов К+ ведет к набуханию митохондрий и нарушению их структуры. Поэтому было предположено, что для поддержания объема митохондрий в них, наряду с системой потенциалозависимого входа, должна существовать система выхода катиона [44]. В дальнейшем это было подтверждено экспериментально [24, 56].
Так как скорость входа калия в митохондрии мала [14], первоначально полагали, что он осуществляется лишь благодаря диффузии иона через мембрану, проявляющейся в незначительных токах утечки [25]. Действительно, кажется маловероятным, что на внутренней мембране митохондрий, при наличии столь высокой электродвижущей силы, природа создала специфические каналы для калия. Однако, еще в 1981 году в лаборатории митохондриального транспорта Г. Д. Мироновой [4], а в дальнейшем и другими исследователями [17], из внутренней мембраны митохондрий был выделен селективный для калия канал, выполняющий функцию унипортера, причем антитела к этому белку-каналу специфически ингибировали работу данного канала, не влияя на другие функции митохондрий [6]. В настоящее время уже общепринято, что в митохондриях существует две системы транспорта калия: система унипортера, осуществляющего вход калия по электрохимическому потенциалу, и K+/H+-обменник, транспортирующий калий из митохондрий в обмен на Н+ [26,27]. То есть, в митохондриях существует так называемый калиевый цикл (рис 1).
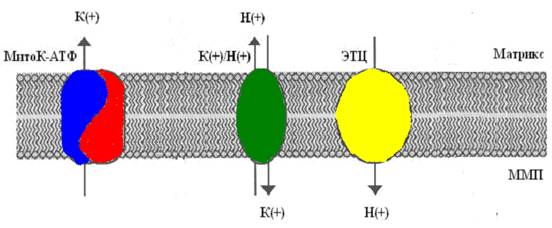
Рис 1. Митохондриальный калиевый цикл
(по Garlid and Paucek, 2003).
ЭТЦ тАУ электрон-транспортная цепь; ММП тАУ межмембранное пространство.
Первым компонентом этого цикла, выполняющим функцию унипортера, является белок-канал с молекулярной массой 55 кДа [3, 4, 43]. Этот белок, при встраивании в бислойные липидные мембраны (БЛМ), формирует селективные для ионов калия каналы. Позднее было обнаружено, что данный канал ингибируется АТФ [53]. Существование природного ингибитора канала вполне логично, так как закрытие канала предотвращает неконтролируемое набухание митохондрий. К настоящему времени митоКАТФ был обнаружен во внутренней мембране интактных митохондрий методом петч-кламп в нескольких лабораториях [12, 15, 20, 31, 45, 64].
Другим компонентом калиевого цикла является К+/Н+ - антипортер, который в настоящее время также выделен из внутренней мембраны митохондрий и молекулярная масса которого, по данным профессора Гарлида, равна 82 кДа [37]. Предполагается, что антипортер ответственен за поддержание объема митохондрий при увеличении скорости входа калия через внутреннюю митохондриальную мембрану. Открытие митоКАТФ кратковременно сдвигает баланс между К+ - унипортером и К+/Н+ - антипортером до тех пор пока скорость выхода К+ через последний не достигает скорости входа К+.
В настоящее время установлено, что митоКАТФ участвует не только в поддержании объема митохондрий, но и в адаптации животных к экстремальным воздействиям. По результатам, полученным на моделях гибернирующего суслика и адаптированных к холоду животных, в лаборатории митохондриального транспорта было высказано предположение об участии митоКАТФ в несократительном термогенезе [2,18]. Продолжение исследований в этом направлении может иметь значение для решения проблем анабиоза и гипотермического наркоза. Кроме того, в настоящее время стала широко изучаться роль митоКАТФ в кардиопротекции, что будет обсуждаться ниже.
1.2. Свойства и регуляция митохондриального АТФ-зависимого калиевого канала
Изучение свойств митоКАТФ показало, что он относится к семейству АТФ-зависимых калиевых каналов, впервые обнаруженных в цитоплазматических мембранах [46]. Основное общее свойство всех каналов, относящихся к этому семейству, состоит в том, что они ингибируются физиологическими концентрациями АТФ [31, 49, 53] и, являясь селективными для калия, обладают выпрямляющими свойствами, т.е. имеют разные скорости транспорта калия в зависимости от направления переноса ионов [31, 49].
Функционирование как митоКАТФ, так и цитоКАТФ зависит от редокс состояния активных групп белков-каналов. Установлено, что окислительно- восстановительные агенты модулируют работу митоКАТФ. Донор электронов п-диметиламиноэтилбензоат (ДЕБ) активирует митоКАТФ, а акцептор электронов - пеларгонидин ингибирует канал [29]. Эти реагенты влияют, вероятно, на SH-группы канала.
При гипоксии, как известно, в клетках значительно изменяется редокс баланс: наблюдается увеличение концентрации активных форм кислорода, изменение соотношений GSH/GSSG и НАД+/НАДН. Такие сдвиги могут привести к модификации тиоловых групп цистеинов.
Хорошо известно, что АФК образуются и накапливаются в организме при различных патологических состояниях, в частности, при ишемии. Однако, они могут образовываться в клетке при нормальном функционировании [48, 52] как побочные продукты аэробного метаболизма и играть значительную роль в работе дыхательной цепи [33], а также в процессах внутриклеточной сигнализации [22, 50].
В экспериментах со встроенным в БЛМ митоКАТФ было показано, что добавление в среду инкубации системы генерации радикала супероксид аниона тАУ ксантин/ксантин оксидазы, приводило к активации канала уже в течение первой минуты инкубации [64]. При этом вероятность открытого состояния митоКАТФ возросла приблизительно в три раза. По-видимому, действие свободных кислородных радикалов на канал опосредовано различными механизмами и направлено на его сульфгидрильные группы.
Другим универсальным фактором регуляции метаболизма является оксид азота II (NО).
Недавно стало известно, что синтез NO может происходить локально в митохондриях, возможно, за счет существования специфичной митохондриальной NO-синтетазы тАУ mtNOS [59]. Было показано, что образованный в тканях NO обладает активирующим действием на митоКАТФ [15, 36, 57]. Так как дыхательная цепь митохондрий является постоянным источником супероксид аниона, который легко вступает в реакцию с NO, вполне вероятно, что в митохондриях происходит образование пероксинитрита ONOO- [38]. Предполагают, что активирующий эффект NO и пероксинитрита (ONOO-)на митоКАТФ осуществляется через активацию протеинкиназы С [35].
1.3. Фармакологическая модуляция митохондриального
АТФ-зависимого калиевого канала
Классификация митоКАТФ как селективного К+ канала, напоминающего изоформу цитоКАТФ, следует, в основном, из того, что оба канала имеют общие активаторы и ингибиторы. В настоящее время обнаружено большое количество подобного рода фармакологических агентов [51]. Эти данные обобщены в таблице 1.
Таблица 1. Модуляторы цитоплазматического и митохондриального КАТФ каналов.
| Модуляторы | митоКАТФ | митоКАТФ и цитоКАТФ | цитоКАТФ |
| Активаторы | диазоксид никорандил BMS-180448 BMS-191095 ДЕБ Тестостерон УДФ | кромакалим пинацидил Р-1060 силденафил изофуран EMD60480 априкалим P-1075 β- эстрадиол | МСС-134 |
| Ингибиторы | 5-HD МСС-134 | глибенкламид | HMR1098(1833) Глимепирид |
Селективность действия модулятора зависит от типа изучаемых клеток, условий эксперимента и, в основном, от используемых концентраций. Диазоксид и никорандил, например, активируют не только митоКАТФ, но в более высоких концентрациях также активируют и цитоКАТФ [16,58]; 5-HD помимо митоКАТФ ингибирует при низких значениях рН цитоКАТФ, активируемый АДФ [47].
Известно, что MCC-134, аналог априкалима, в поджелудочной железе ингибирует, а в гладкой мускулатуре активирует КАТФ каналы. Недавно было показано, что этот препарат ингибирует митоКАТФ, но активирует цитоКАТФ в кардиомиоцитах.
Недавно, в лаборатории митохондриального транспорта было показано, что дифосфонуклеотиды являются активаторами канала, причем наиболее выраженный эффект наблюдался при активации канала УДФ.
Было показано, что дифосфонуклеотиды, такие как АДФ и ГДФ активируют реконструированную в БЛМ канальную субъединицу [29,43]. Данные по активирующему действию ГДФ в дальнейшем были подтверждены и другими исследователями [12]. Недавно было показано, что в ряду дифосфонуклеотидов наиболее эффективным является уридиндифосфат (УДФ) [42]. Этот фосфонуклеотид в микромолярных концентрациях активирует митоКАТФ. Для активации цитоКАТФ нужны значительно большие концентрации УДФ [8]. Реконструированный в БЛМ канал (митоKIR), после ингибирования АТФ, полностью реактивируется 20 мкМ УДФ. В интактных митохондриях, где присутствуют обе субъединицы, канал реактивируется теми же концентрациями УДФ, и эта активация снимается глибенкламидом и 5-НD [42]. Следовательно, участок связывания УДФ локализуется на канальной субъединице.
Функцию метаболических регуляторов могут выполнять также гормоны. Еще на первых этапах исследования митоКАТФ в лаборатории митохондриального транспорта обнаружено, что прогестерон ингибирует его канальную субъединицу. В настоящее время появились данные о том, что женский половой гормон b-эстрадиол является, вероятно, активатором митоКАТФ, так как он обладает кардиопротекторным действием, которое снимается 5-НD [61].
Мужской половой гормон тАУ тестостерон, также оказывал как активирующее митоКАТФ, так и кардиопротекторное действие [20]. При измерении активности митоКАТФ по флуоресценции флавопротеидов в митохондриях сердца, а также методом петч-кламп по регистрации электрических характеристик мембран митопластов было установлено, что тестостерон вызывал окисление флавопротеидов и активацию каналов. Оба эффекта зависели от присутствия в среде К+ и были чувствительны к АТФ. Показано, что тестостерон оказывал эффект только на митоКАТФ и не влиял на цитоКАТФ [20].
Каналы, образованные в БЛМ белком с молекулярной массой 55 кДа, регулируются АТФ, как было ранее показано [3], который способен значительно снижать проводимость модифицированной белком мембраны. Ионы Mg2+ не оказывали значительного влияния на ингибирование канала АТФ.
В интактных митохондриях можно также наблюдать АТФ-зависимый транспорт калия, используя модель энергозависимого входа калия. АТФ в присутствии MgCl2 способен был подавлять энергозависимый вход калия в митохондрии. Однако, в отличие от данных, полученных при реконструкции этого белка в искусственные мембраны, действующая концентрация АТФ значительно ниже. Другим отличием является абсолютная необходимость Mg2+ для ингибирования АТФ в случае интактных митохондрий, в то время как при реконструкции белка с Мr55 кДа в БЛМ, Mg2+ не оказывает существенного влияния на эффект ингибирования калиевого канала АТФ.
Различия в действии Mg2+, возможно, объясняются тем, что Mg2+ - связывающий участок локализован на регуляторной субъединице канала. Связывание регуляторной субъединицы с магнием увеличивает, вероятно, сродство к АТФ каналообразующей субъединицы.
Ингибирование нуклеотидом, вероятнее всего, осуществляется за счет его связывания в специфическом участке, а не в результате фосфорилирования белка, хотя таковое может иметь место. Интересно, что присутствие магния не является необходимым условием для ингибирующего эффекта АТФ при реконструкции митоKir (белка с Мr 55 кДа) в искусственные мембраны, следовательно, Mg2+ проявляет свой эффект только в интактных митохондриях, то есть при наличии двух субъединиц.
Так как ингибирующий эффект АТФ проявляется и при реконструкции только каналоформирующей субъединицы (митоKir) в БЛМ и липосомы, логично предположить, что нуклеотидсвязывающий участок расположен на каналообразующей субъединице, однако регуляторная субъединица (митоSUR) повышает сродство каналов к нуклеотиду.
В исследовании по регуляции транспорта калия адениновыми нуклеотидами с использованием модели выхода ионов K+ из митохондрий в присутствии разобщителя окислительного фосфорилирования было обнаружено, что ингибитор адениннуклеотидтранслоказы ― атрактилозид в концентрации 1 мкМ полностью предотвращал ингибирующее действие АТФ. Следовательно, можно предположить, что для ингибирования канала АТФ должен транспортироваться внутрь митохондрий, где и происходит его связывание с каналом. Исходя из этого, представляется, что нуклеотидсвязывающий участок митохондриального АТФ-чувствительного калиевого канала располагается на обращенной в сторону матрикса части белка-канала.
1.4. Структура митохондриального АТФ-зависимого
калиевого канала
Структура цитоКАТФ и ген ее кодирующий к настоящему времени известны. Установлено, что этот канал состоит из двух субъединиц: канальной и регуляторной. Канальная субъединица имеет Мr 43-46 кДа и формирует АТФ-зависимый калиевый канал, который не регулируется специфическими модуляторами канала. Регуляторная субъединица имеет Мr от 60 до 174 кДа, в зависимости от ткани, и придает каналу чувствительность к модуляторам [7].
Несмотря на то, что свойства, регуляция и физиологическое значение митоКАТФ в настоящее время широко изучаются, солюбилизация его из митохондриальных мембран и изучение структуры проводятся лишь в отдельных лабораториях. Так как митоКАТФ имеет ряд общих свойств с цитоКАТФ и регулируется общими регуляторами, было предположено, что по структуре он близок к цитоплазматическому каналу [43] и состоит из канальной субъединицы [42] и регуляторной [10]. МитоКАТФ, также как и клеточный, является, по всей вероятности, гетеромультимером, состоящим из калиевого канала, белка с молекулярной массой 55 кДа, который имеет выпрямляющие свойства и который, по аналогии с цитоплазматическим каналом, назвали митоKIR [42] и рецептора, чувствительного к сульфонилмочевинам и поэтому названного митоSUR (Рис. 2) [10, 43].
Рис 2. Рабочая модель структуры митохондриального АТФ-зависимого калиевого канала (по Mironova et al., 2004)
Белок, выделенный из внутренней мембраны митохондрий печени крысы, который формирует в БЛМ АТФ-зависимые каналы и имеет Мr 55 кДа (митоKIR), не ингибируется глибенкламидом и специфическим ингибитором митоКАТФ 5-HD, и не активируется кромакалимом и диазоксидом. В то же время эти препараты влияли на АТФ-зависимый калиевый транспорт в изолированных митохондриях [42].
Константа ингибирования АТФ на реконструированном в БЛМ митоKIR была значительно выше, чем в интактных митохондриях и Mg2+ для этого ингибирования не требовался. В то же время, для ингибирования фосфонуклеотидом канала, локализованного в интактных митохондриях, присутствие ионов магния было необходимо [42]. Те же различия были обнаружены при сравнительном изучении влияния АТФ и сульфонилмочевины на цитоKIR и целый цитоКАТФ [62]. Целый цитоКАТФ ингибировался значительно меньшими концентрациями АТФ, чем канальная субъединица и был чувствителен к сульфонилмочевине и активаторам, в то время как канальная субъединица такой чувствительности не проявляла. Из этих данных был сделан вывод, что основной участок связывания АТФ в цитоКАТФ локализован на канальной субъединице, а регуляторная субъединица повышает сродство канальной субъединицы к АТФ и обеспечивает чувствительность целого канала к активаторам и ингибиторам [62].
Приведенные выше результаты исследований митоКАТФ подтверждают предположение о том, что белок с Мr 55 кДа является канальной субъединицей целого митоКАТФ. Однако, для более прямого подтверждения этого предположения нами были получены антитела (АТ) на этот белок и показано, что они ингибируют АТФ-зависимый калиевый транспорт в интактных митохондриях, не влияя при этом на другие функции митохондрий, такие как окислительное фосфорилирование и транспорт кальция [6]. Функцию регуляторной субъединицы выполняет, вероятно, белок с Мr 63 кДа, связывающийся с меченым глибенкламидом [10].
1.5. Нарушения гомеостаза, вызванные гипоксией и механизмы его восстановления
Известно, что при гипоксии недостаток кислорода приводит к восстановлению переносчиков дыхательной цепи [1]. Восстановление переносчиков I и III комплексов цепи, приводит к увеличению образования АФК, которые активируют свободнорадикальные процессы в клетке [19, 32].
Можно выделить две основные физиологические роли свободнорадикального окисления в организме. Во-первых, этот процесс имеет место при катаболизме многих липидов и белков, что облегчает дальнейшее действие фосфолипаз и протеаз, сродство которых намного выше именно к окисленному субстрату [63], а также при синтезе физиологически активных веществ липидной природы (лейкотриены, тромбоксаны, простагландины). Во-вторых, АФК участвуют в начальных этапах клеточной сигнализации (редокстАУсигнализация) в условиях стресса, гипоксии, воспаления, воздействия высоких и низких температур, физической нагрузки, и других патологических состояниях. Характер клеточного ответа будет зависеть от продолжительности и интенсивности воздействия вышеперечисленных факторов. При умеренном воздействии формируется неспецифический ответ, повышающий адаптацию организма к новым условиям. При воздействии высокой интенсивности, например, при глубокой гипоксии наступает некроз тканей, в том числе и за счет повреждающего действия АФК, активирующих перекисное окисление липидов и других биологических молекул [5].
Механизм протекторного действия заключен, по-видимому, в окислительно-восстановительных модификациях сульфгидрильных групп сенсорных белков, что приводит к активации тирозинкиназного пути клеточного ответа [5].
Одним из важнейших следствий инициации редокс-сигнализации и АФК-опосредованной передачи сигнала является активация ядерных факторов транскрипции, которые находятся в неактивном состоянии до тех пор, пока в их молекуле не произойдет отщепление ингибиторного домена. После этого, ядерные факторы транскрипции оказываются способными индуцировать многочисленные гены. Важную роль в настоящее время придают таким факторам транскрипции, как NF-kB [21], AP-1[41].
Среди известных к настоящему времени белков, которые синтезируются в ответ на редокс-сигнал от адаптирующего фактора, наибольшее значение имеет, прежде всего, ряд неспецифических молекул, таких как ферменты антиоксидантной защиты, белки семейства HSP и другие белки срочного ответа, которые могут синтезироваться в ответ на гипоксию, стресс, ишемию, реперфузию и т.д. [41]. Кроме того, синтезируются специфические молекулы с шапероновой активностью по отношению к конкретным белкам клетки, как показано, например для специфического шаперона Са-насоса саркоплазматического ретикулума [13], либо белки, специфически синтезирующиеся в ответ на действие конкретного фактора, например, в ответ на гипоксию [28].
Следует отметить, что на сегодняшний день одним из наиболее эффективных способов предотвращения повреждений тканей, вызванных гипоксическим состоянием, является интервальная гипоксическая тренировка. До настоящего времени считалось, что основной механизм адаптационного эффекта всех видов гипоксической тренировки обусловлен активацией антиоксидантных ферментов, усиливающих защиту организма от воздействия активных форм кислорода [28,41]. Недавно в лаборатории Скулачева было показано, что незначительное снижение мембранного потенциала (~ на 13%) ведет к существенному (до 80%) уменьшению продукции супероксид-анионов [34]. Следует отметить, что в митохондриях образуется до 95% супероксид-анионов клетки [11,54,60].
Ранее было высказано предположение, что активация митоКАТФ и увеличение экспрессии гена, кодирующего этот белок, играют роль в формировании устойчивости организма к кислородному голоданию [39,55,65], однако прямых доказательств этому предположению получено не было, поэтому в данной работе была поставлена цель тАУ выяснить роль митоКАТФ в адаптации к гипоксии.
Глава 2. Материалы и методы
2.1. Выделение белка с молекулярной массой 55 кДа из митохондрий печени крыс
В работе использовали самцов крыс линии Вистар.
Для выделения белка проводили выделение митопластов, экстракцию белков из митопластов, отделение водорастворимых белков от нерастворимых в воде. Дальнейшее разделение водорастворимых белков осуществляли методом ионообменной хроматографии, с повторным проведением хроматографии фракций, где был обнаружен белок с Мr 55 кДа. Фракции после хроматографии проверяли с помощью SDS-электрофореза и, если было необходимо, на приборе для определения проводимости бислойных липидных мембран. Далее проводили нативный форез фракций после повторной хроматографии, в которых с помощью SDS-фореза был обнаружен белок с Мr 55 кДА и концентрирование белка методом обратного диализа с помощью полиэтиленгликоля (ПЭГ).
2.1.1. Выделение митопластов из митохондрий печени крыс
Для одного выделения обычно декапитировали 10 крыс, у которых извлекали печень.
Печень измельчали в специальном прессе, затем гомогенизировали в десятикратном объеме 300 мМ раствора сахарозы в 10 мМ Tris-HCl, рН 7.4 с использованием автоматического гомогенизатора при 240 об/мин.
Далее гомогенат центрифугировали на центрифуге К-70: 4 мин при 1200 об/мин (400g), затем 6 мин при 1500 об/мин (600g). В этих условиях осаждаются ядра и мембранные структуры.
Супернатант центрифугировали на РС-6 20 мин при 4800 об/мин (3500g). В этих условиях осаждается митохондриальная фракция. Осадок собирали и промывали в 300 мМ раствора сахарозы в 10 мМ Tris-HCl рН 7.4, затем ресуспендировали.
Повторное центрифугирование проводили на РС-6 20 мин. при 4800 об/мин (3500g). Осадок собирали, мерили его объем.
Доводили полученные митохондрии Tris-HCl (10 мМ, pH 7.4) до 500 мл.
Оставляли при перемешивании и температуре 4В°С на 30 мин. В результате получались митопласты.
Митопласты центрифугировали при 5500 об/мин на РС-6 (4000g) в течение 20 мин.
Осадок объединяли. Измеряли его объем и концентрацию белка. Концентрацию белка измеряли спектрофотометрически (длина волны 750 нм) по методу Лоури (Лоури, 1965). Исходя из полученных данных, митопласты разводили бидистиллированной водой до концентрации 44 мг/мл.
2.1.2. Экстрагирование белков из митопластов
К полученной суспензии митопластов добавляли 9 объемов 66%-го этилового спирта. Экстракцию белков вели при перемешивании суспензии в течение 30 мин при 4В°С. После экстракции суспензию центрифугировали при 5500 об/мин (4000g) в течение 15 мин.
2.1.3. Отделение водорастворимых белков от нерастворимых
Полученный супернатант диализовали против 5 мМ Tris-HCl pH 7.4 (c 2-меркаптоэтанолом тАУ 0,0005%). Объем буфера составлял 2 л. Затем центрифугировали при 100000g 30 мин.
2.1.4. Ионообменная хроматография на DEAE-целлюлозе
Буфер ВлАВ» (Tris 50 mM, EDTA 0.5 mM pH 7.4; 125 мкл 2-меркаптоэтанола на 250 мл буфера после доведения рН)
Буфер ВлБВ» (1М КСl в буфере ВлАВ»). Из него готовили ступенчатый градиент: 50, 100, 150, 200, 250, 300, 500 мМ КСl.
Взвешивалили DEAE-целлюлозу из расчета 1 г целлюлозы на 1 мл колонки. Целлюлозу промывали три раза деионизированной водой, затем буфером ВлАВ». Наносили на колонку. Промывали буфером ВлАВ» после нанесения.
Супернатант наносили на колонку c DEAE-целлюлозой (высота 2 см, объем 2 мл), предварительно уравновешенную буфером ВлАВ». После нанесения белков колонку промывали двойным объемом буфера ВлАВ» (Tris 50 мM, EDTA 0.5 мM pH 7.4).
Белки элюировали градиентом KCl: 50, 100, 150, 200, 250, 300, 500 мМ. Собирали по две фракции каждой концентрации соли. Каждая фракция по 2 мл. Полученные фракции проверяли на электрофорезе в ПААГ.
2.1.5. SDS-электрофорез в ПААГ
Белки разделяются по их молекулярным массам. Додецилсульфат натрия (SDS), связываясь с заряженными молекулами, компенсирует различия между зарядами белков.
Приготовление проб: в 30 мкл каждой фракции с DEAE-cell колонки добавляли по 15 мкл SLB.
Приготовление SLB:
1) SLB без меркаптоэтанола: 1.4 г SDS + 6 г глицерина + буфер, pH 6.8, без SDS - 7.5 мл, доводили деионизированной водой до 20 мл.
2) SLB для проб: 1 мл SLB без МЭ (1); 45 мкл МЭ; 45 мкл бромфеноловый синий .
Приготовление маркера:
10 мкл маркера (0.1 мг/мл) + 120 мкл SLB (1)
Приготовление кумасси: 600 мгкумасси голубого; 200 мл 96% этанола; 40 мл ледяной уксусной кислоты растворить в 200 мл воды.
Концентрированный буфер для форезной камеры: 7.6 г Tris-HCl + 36 г глицина доводили дистиллированной водой до 800 мл и рН 8.3-8.8. После этого в буфер добавляли 2.5 г додецилсульфата натрия.
Рабочий буфер для форезнойкамеры: Разводили концентрированный буфер в 5 раз.
Буфер для разделяющего геля: Tris-HCl 1.5 M (9.1 г на 50 мл воды доводили до рН 8.8), затем добавляли 200 мг SDS на 50 мл.
Буфер для концентрирующего геля: Tris-HCl 0.5 М (3 г на 50 мл). После доведения рН до 6.8 добавляли 200 мг SDS на 50 мл.
40% - бис-акриламид (60 мл): акриламид 23.34г.; бис-акриламид 0.64г.
Приготовление гелей: сведения представлены в таблице 2.
Таблица 2. Приготовление гелей для SDS-электрофореза в ПААГ.
| Вещество | Разделяющий 10 % (20 мл) | Концентрирующий 5% (5 мл) |
| 40% бис-акриламид | 5 мл | 0,72 мл |
| Буфер для геля | 5 мл | 1,6 мл |
| Вода | 9,3 мл | 3,95 мл |
| Персульфат аммония (1%) | 0,7 мл | 0,6 мл |
TEMED* | 10 мкл | 15 мкл |
П р и м е ч а н и е: TEMED вносится непосредственно перед заливанием геля.
После полимеризации гелей пробы (в т.ч. метчик) кипятили на водяной бане в течение 5 минут и горячими наносили в карманчики геля. Маркер (рабочий) наносили в объеме 1/6 от объема проб.
Электрофорез проводили при силе тока 20 мА на одну пластинку. Когда пробы входили в разделяющий гель, силу тока увеличивали в 2 раза и оставляли до тех пор, пока краска не доходила до конца геля (1.5-2 часа).
Красили кумасси примерно 15 мин. Затем отмывали 7.5 % уксусной кислотой в течение ночи на шейкере. Если было необходимо, окрашивали серебрением (таблица 3).
Таблица 3. Окрашивание серебрением (Silver staining, Shevchenko at al., 1996)
| Реагент | Экспозиция |
| 50 % метанол + 10% уксусная кислота | 2*20 мин |
| 20% этанол | 10 мин |
| Вода | 10 мин |
| Тиосульфат натрия (0.2 г/л) | 1 мин |
| Вода | 2*20 сек |
| Нитрат серебра (2 г/л) | 30 мин |
| Вода | 20 сек |
| Проявитель: карбонат натрия (30 г/л); 37% формалин 1.4 мг/л; тиосульфат натрия 10 мг/л | Пока не проявится (около 20 мин) |
| 1% уксусная кислота | Минимум 20 мин |
Фракции, в которых при электрофорезе обнаружен белок с Mr 55 кДа, диализовали против 5 мМ Tris-HCl, pH 7.4.
Диализат наносили на вторую колонку с DEAE-целлюлозой (высота 1 см, объем 1 мл).
Смывали белки таким же градиентом по два объема колонки.
Фракции после первой и второй колонки проверяли на приборе для определения проводимости бислойных липидных мембран (БЛМ).
2.1.6. Определение проводимости бислойных липидных мембран (БЛМ)
Электрическая часть прибора для измерения проводимости бислойных липидных мембран представляет собой амперметр, измеряющий силу тока при определенной разности потенциалов между электродами. Сила тока зависит от проницаемости (сопротивления) мембраны, разделяющей раствор электролита в кювете. Исходя из этого, можно определить проводимость мембраны (проводимость = 1/ сопротивление).
Проводимость билипидного слоя очень близка к нулю (10-12 пСм) при умеренном напряжении. Абсолютное значение напряжения более 150 мВ ВлрветВ» билипидный слой.
Проводимость отличная от нуля определяется белками, встроенными в билипидный слой.
Проводимость нелинейно зависит от напряжения (в случае БЛМ), поэтому определяется проводимость при различных напряжениях.
Подготовка кювет: до и после работы кюветы отмывали детергентами, затем 10-15 минут споласкивали в струе воды (в стакане). Промывали дистиллятом, протирали спиртом, промывали дистиллятом от спирта. Ставили сушиться. Когда кюветы высыхали, смазывали отверстие в меньшей кювете липидами снаружи и внутри и давали высохнуть. Вставляли меньшую кювету в большую. Наливали в каждую кювету по 1 мл среды.
Среда для БЛМ: 3 M KCl; 20 мМ Tris, pH 7.4.
Приготовление липидов: 20 мкл общих липидов мозга и 26 мкл кардиолипина (Blight et al., 1959). Смесь близка по составу к митохондриальным липидам.
Затем эту смесь сушили аргоном, чтобы испарился хлороформ и метанол.
В пробирку с высушенными липидами добавляли 80 мкл н-декана, чтобы растворить липиды перемешивали.
Работа на приборе: наливали в каждую кювету по 800 мкл буфера; вставляли два электрода в кюветы; включали приборы; наносили липиды на отверстие в меньшей кювете, используя микроскоп. Ждали, пока цветная (полислойная) мембрана станет черной (бислойной).
В одну из кювет (обычно транс-) добавляли необходимое количество белка, а в другую (цис-) такое же количество среды для БЛМ, причем с расчетом, чтобы содержание KCl в обеих кюветах было изоосмотическим.
В случае появления проводимости, ее регистрировали две-три минуты, затем меняли напряжение, и ингибировали проводимость АТФ.
2.1.7. Нативный электрофорез
При нативном электрофорезе не используются детергенты, белки разделяются как по заряду, так и по молекулярной массе. При обнаружении (возможном) не одной, а нескольких полос (загрязнение) проводится элюция с геля всех полос, затем белки идентифицируются на SDS-форезе.
Концентрированный буфер для элюции (рН=8.8): 3г Tris на 500 мл воды; 14.4 г глицина на 500 мл воды.
Буфер для элюции: концентрированный буфер развести в 10 раз.
Приготовление гелей: сведения представлены в таблице 4.
Таблица 4. Приготовление гелей для нативного электрофореза.
| 10% гель: | 2.5% гель: |
| 30% акриламид тАУ 3.3 мл | 30% акриламид тАУ 0.5 мл |
| 1% бис-акриламид - 1.3 мл | 1% бис-акриламид тАУ 0.5 мл |
| 1.5 М трис (рН=8.7) тАУ 2.5 мл | 0.5 М трис (рН = 6.8) тАУ 1.25 мл |
| вода - 2.73 мл | вода тАУ 2.67 мл |
| персульфат аммония - 0.035 мл | персульфат аммония - 0.025 мл |
| ТЕМЕД тАУ 0.003 мл | ТЕМЕД тАУ 0.0025 мл |
Пластинки заливали рабочим буфером для фореза. Проводили префорез: 30 мА 30 мин.
Бромфеноловый синий в кислой среде бурый, при рН 8.3 синеет. Краску наносили на гель ровным слоем и устанавливали силу тока 30 мА на 1 мин, чтобы краска вошла в гель.
Добавляли сахарозу и глицерин для увеличения плотности раствора. В краску тоже добавляли сахарозу.
Когда краска входила в гель, наносили пробу ровным слоем. Устанавливали силу тока 30 мА (примерно на 3 часа).
После этого, вырезали боковые части геля, окрасили их 30 минут бромфеноловым синим, отмывали в 7.5% уксусной кислоте. Вырезали полосу геля, соответствующую полосе белка (должна быть чуть шире, чем полоса белка), измельчали, помещали в трубку для элюции.
Пробирки заполняли буфером, потом заливали буфер в верхнюю камеру, чтобы покрыло пробки. В наружной камере буфер должен покрывать мембрану.
Камеру ставили в холодильник, проводили элюцию при 8 мА (для двух трубок) 12 часов. Доэлюцию (если было необходимо) проводили при 10 мА 1 час.
После этого, сливали буфер из внутренней камеры во внешнюю. Из трубок пипеткой вытягивали буфер. Аккуратно снимали пробку тАУ в ней препарат. Осторожно, чтобы не повредить мембрану, вытягивали пипеткой элюат.
2.1.8. Концентрирование белка методом обратного диализа с помощью полиэтиленгликоля
Фракцию помещали в диализный мешочек (его можно ставить вертикально, тогда ПЭГ должен покрывать мешочек на 1/3). Мешочек клали в бюкс или чашку Петри и засыпали ПЭГ.
2.2. Выделение митохондрий из печени крыс
Среда выделения (200 мл, рН 7.4): маннитол 210 мМ; сахароза 70 мМ; HEPES (N-2-гидроксиэтилперазинтАУNтАЩ-этансульфоновая кислота) 10 мМ. Среду разделяли на три части. В одну 37 мг ЭДТА на 100 мл среды, в другую 45 мкл 0,1 М ЭГТА на 100 мл среды. Третью (три миллилитра) оставляли без изменений.
Все процедуры проводили при 4 В°С. Взвешенный физраствор предварительно охлаждали. Затем взвешивали вместе с печенью. Измельчали печень в прессе, затем гомогенизировали, разбавив средой с ЭДТА в девять раз.
Центрифугировали 4 мин при 250 g, затем 6 мин при 600 g. В результате этого осаждались ядра и обрывки мембран.
Супернатант центрифугировали 20 мин при 4500 g.
Осадок ресуспендировали в среде с ЭГТА и центрифугировали 20 мин при 4500 g.
Осадок ресуспендировали в среде без ЭГТА и без ЭДТА в соотношении 100 мкл среды на каждый грамм ткани и ставили в лед.
2.4. Выделение митохондрий из сердца крыс
Среда выделения (150 мл, рН 7.4): сахароза 70 мМ; маннитол 210 мМ; хепес 10 мМ; ЭГТА 2 мМ. Среду разделяли на три части. В одну (10 мл) добавляли 1 мг протеазы (непосредственно перед выделением). В другую (70 мл) - добавляли 140 мг БСА. В третью (70 мл) ничего не добавляли.
Все процедуры проводили при 4 В°С.
Сердце помещали в предварительно охлажденный физраствор и взвешивали. Затем клали сердце в среду с протеазой на 10 минут, измельчая сердце ножницами. Через 10 минут часть жидкости сверху сливали, чтобы удалить частички жира и связки. Далее разводили средой с альбумином в 9 раз и гомогенизировали.
Гомогенат центрифугировали пять минут при 650g (осаждаются ядра и
Вместе с этим смотрят:
G-белки и их функция
Австралопитеки - обезьянолюди или человекообезьяны?
Адаптация микроорганизмов в экстремальных условиях космоса
Адвентивна флора Чернiгiвськоi областi: iсторiя формування та сучасний стан
Адсорбция ионных и неионных поверхностно-активных веществ (ПАВ)