Изучение токсического влияния кадмия на активность аминотрансфераз у потомства белых крыс
Известно, что тяжелые металлы обладают выраженными кумулятивными свойствами, высокой биохимической активностью по отношению к сульфгидрильным, тиоловым, карбоксильным и другим активным группам белков и аминокислот. Принимая во внимание способность тяжелых металлов к трансплацентарному переходу и высокую чувствительность организма на ранних этапах онтогенеза, становиться очевидным, что новорожденные и дети грудного возраста составляют группу риска развития предпатологических и патологических состояний/1/.
Кадмий (Cd) является одним из опасных загрязнителей природной среды. Адсорбируясь через легкие и желудочно-кишечный тракт, уже через несколько минут он обнаруживается в крови. Кадмий обладает канцерогенным, гонадотропным, эмбриотропным, мутагенным и нефротоксическим действием. Реальная угроза неблагоприятного воздействия на население даже при низких уровнях загрязнения связана с высокой биологической кумуляцией этого металла. Последствия короткого контакта с высокими концентрациями кадмия в воздухе приводят к легочному фиброзу, стойкому нарушению легочных и печеночных функций. В легких оседает до 50% Cd, попавшего в организм ингаляционным путем. В желудочно-кишечном тракте адсорбция Cd в среднем состовляет 5%. Органами тАУ мишенями Cd являются печень, почки, костный мозг, сперма, трубчатые кости и отчасти селезенка. Кадмий депонируется в печени и почках, где его содержится до 30% от общего количества в организме/2/.
Токсическое влияние Cd сказывается, прежде всего, на потомстве, поскольку, проникая через плаценту, кадмий способен изменять ее ферментативный статус/3/. систем. При введении Cd per os беременным и кормящим крысам, у потомства обнаруживают повреждения репродуктивной системы и задержке физического развития/4/. Результатом пренатального и постнатального воздействия Cd является скелетные нарушения, нарушения обмена белков, липидов, ингибирование ряда ферментативных
Одним из наиболее распространенных видов биологического действия химических веществ является их способность влиять на белковый и аминокислотный обмен в организме. Наиболее важными с практической точки зрения и хорошо изученными ферментами являются аспартатаминотрансфераза и аланинаминотрансфераза тАУ ферменты, катализирующие межмолекулярный перенос аминогрупп между амино - и кетокислотами/5/.
Целью данной работы являлось изучение влияния азотнокислого кадмия на активность аланинаминотрансферазы и аспартатаминотрансферазы в сыворотке крови и тканях органов у потомства белых крыс, подвергшихся токсическому действию в неонатальный период.
В соответствии с целью были поставлены следующие задачи:
1) определить активность АСТ и АЛТ в сыворотке крови, тканях печени, головного мозга, сердца, почках потомства крыс, подвергшихся хроническому действию ионами кадмия в период лактации;
2) изучить влияние различных доз токсиканта на активность АСТ и АЛТ в сыворотке крови и тканях.
1. Литературный обзор
1.1 Кадмий, как основной источник загрязнения, пути поступления в окружающую среду и действие на метаболические процессы в организме
Современный уровень развития промышленных технологий не позволяет перейти к экологически чистому производству/6/.Одним из наиболее распространенных загрязнителей окружающей среды являются ионы тяжелых металлов, в частности кадмий. Индустриальное загрязнение кадмием характерно для многих промышленных районов России. Кадмий способен адсорбироваться на твердых частицах и переноситься на большие расстояния.
Источниками большинства антропогенных загрязнений являются отходы от металлургических производств, со сточными водами гальванических производств (после кадмирования), других производств, в которых применяются кадмийсодержащие стабилизаторы, пигменты, краски и в результате использования фосфатных удобрений. Кадмий присутствует в воздухе крупных городов вследствие истирания шин, эрозии некоторых видов пластмассовых изделий, красок и клеящих материалов /1/. Однако больше всего в окружающую среду кадмий поступает в виде побочного продукта металлургического производства (например, при выплавке и электролитической очистке цинка), а также при хранении и переработке бытовых и промышленных отходов /7/. Даже в незагрязненных районах с содержанием кадмия в воздухе менее 1 мкг/м, его ежедневное поступление в организм человека при дыхании составляет около 1% от допустимой суточной дозы /2/.
Дополнительным источником поступления кадмия в организм является курение. Одна сигарета содержит 1-2 мкг кадмия, и около 10% его поступает в органы дыхания. У лиц выкуривающих до 30 сигарет в день, за 40 лет в организме накапливается 13-52 мкг кадмия, что превышает его количество, поступающее с пищей /7/.
В питьевую воду кадмий попадает вследствие загрязнения водоисточников производственными сбросами, с реагентами, используемыми на стадии водоподготовки, а также в результате миграции из водопроводных конструкций. Доля кадмия, поступающего в организм с водой, в общей суточной дозе составляет 5-10% /8/. Среднесуточное потребление кадмия человеком составляет примерно 50 мкг с отдельными отклонениями в зависимости от индивидуальных и региональных особенностей /2/.Предельно допустимая концентрация (ПДК) кадмия в атмосферном воздухе составляет 0,3 мкг/м, в воде водоисточников тАУ 0,001мг/л, в почвах песчаных и супесчаных кислых и нейтральных 0,5, 1,0 и 2,0 мг/ кг соответственно /2/.
Всемирной организацией здравоохранения (ВОЗ) установлен допустимый уровень содержания кадмия в организме 6,7- 8 мкг/кг /2,8/. Обмен кадмия в организме характеризуется следующими основными особенностями/9/: отсутствием эффективного механизма гомеостатического контроля; длительным удержанием (кумуляцией) в организме. На задержку кадмия в организме оказывает влияние возраст человека. У детей и подростков степень его всасывания в 5 раз выше, чем у взрослых /2/. Выведение кадмия происходит медленно. Период его биологической полужизни в организме колеблется, по разным оценкам, в пределах 10-47 лет /10,11/. От 50 до 75% кадмия от попавшего количества удерживается в организме. Основное количество кадмия из организма выводится с мочой (1-2 мкг /сут) и калом(10-50 мкг/сут) /2/.
Хроническое воздействие кадмия на человека приводит к нарушениям почечной функций легочной недостаточной, остёомаляций, анемий и потери обоняния. Существует данные о возможном канцерогенном эффекте кадмия и о вероятном участии его в развитии сердечно-сосудистых заболеваний /12/. Наиболее тяжелой формой хронического отравления кадмием является болезнь тАЬитай-итайтАЭ характеризующаяся деформацией скелета с заметным уменьшением роста, поясничными болями, болезненным явлениями в мышцах ног, утиной походкой. Кроме того, отмечаются частные переломы размягчённых костей, а также нарушение функций поджелудочной железы, изменения в желудочно-кишечном тракте, гипохромная анемия, дисфункция почек и др./9/. Кадмий способен накапливаться в организме человека и животных, так как сравнительно легко усваивается из пищи и воды и проникает в различные органы и ткани. Токсическое действие металла проявляется уже при очень низких концентрациях /6/. В современной научной литературе изучению токсического действия кадмия посвящено немало работ. Наиболее типичным проявлением отравления кадмием является нарушение процессов поглощения аминокислот, фосфора и кальция в почках. После прекращения действия кадмия повреждения, вызванные его действием в почках, остаются необратимыми. Показано, что нарушение процессов обмена в почках может привести к изменению минерального состава костей /8/. Известно, что кадмий накапливается преимущественно в корковом слое почек, а его концентрация в мозговом слое и почечных лоханках значительно ниже /13/, что связано с его способностью депонироваться в паренхиматозных органах и медленным выведением из организма.
Предположительно проявление токсического действия ионов кадмия связано синтезом в организме белка металиотеонеина, который связывает и транспортирует его в почки. Там белок почти полностью реадсорбируется и быстро деградирует с освобождением ионов кадмия, стимулирующих металлиотионеина в клетках эпителия проксимальных канальцев. Деградация комплекса кадмий-металлиотионеин приводит к повышению уровня ионов кадмия вначале в лизосомальной фракций, а затем в цитозоле, где происходит связывание с почечным металлиотионеином. При этом в клетках появляются везикулы, и повышается число электронно-плотных лизосом, появлением низкомолекулярной протеинурии и кальцийурией /9,14/.
Роль белка металиотинеина в снижении токсичности кадмия весьма значительна. Экспериментальное внутривенное введение кадмия, связанного с данным белком, предотвращает развитие некроза в почечной ткани у мышей, тогда как аналогичные дозы неорганического кадмия вызывает развитие некроза в почках. Это доказывает участие металиотионеина в снижении токсичности металла. Однако этот механизм ограничен в количественном отношении, потому что при длительном поступлении кадмия также развивается повреждение тубулярного эпителия /14/.
Многочисленными исследованиями была показана возможная связь между кадмийиндуцированным повреждением клеток почек, межклеточным изменением содержания ионов кадмия и индукцией синтеза стрессовых белков. Первым кандидатом на роль стрессового белка является кальмодулин, так как in vitro показано, что кадмий активирует секрецию этого гормона, который через усиление потока кальция в клетку может повреждать цитоскелет /9/.
Кадмий вызывает развитие протеинурии, глюкозурии, аминоацидурии и другие патологические процессы. При длительном поступлении кадмия в организм развивается почечный тубулярный ацидоз, гиперкальцийурия и формируются камни в мочевом пузыре. В тяжелых случаях хронической кадмиевой интоксикации может также наблюдаться нефрокальцидоз. Накопление кадмия в клетках культуры почек происходит параллельно повышению степени его токсичности. Однако характер распределения его в клетке не зависит от выраженности цитотоксического действия: более 90% металла связано с цитозолем, остальная часть тАУ микросомной, митохондриальной, ядерной фракциями и клеточными фрагментами /8/.
Изучение субклеточного распределения кадмия в печени позволило расшифровать механизм возникновения толерантности к данному металлу. Установлено, что снижение чувствительности к кадмию обусловлено изменением его распределения не в тканях, а цитозольной субклеточной фракции печени, являющиеся органом тАУ мишенью, где происходит связывание его с металиотионеином. В дозе 2,4 мг/кг кадмий снижает синтез белка в микросомальной фракции печени крыс, не нарушая его в ядрах и митохондриях. Накапливаясь на внутренних мембранах митохондрий, данный металл уменьшает энергоснабжение и стимулирует перекисное окисление липидов (ПОЛ) при концентрациях 10 тАУ 100 мкмоль /15,16/.
В первые сутки после введения кадмия в дозе 4 мг/кг в мышце сердца крыс по сравнению с контролем увеличились содержание диеновых коньюгантов в 2,1 раз, активность глутатионпероксидазы тАУ на 3,2%. В коре больших полушарий головного мозга содержание шиффовых оснований возрастало в 2,2 раза. На седьмые сутки наблюдения у животных, получавших кадмий, концентрация шиффовых оснований в неокортексе оставалась повышенной на 59,3%, в сердце тАУ увеличилось в 2,4 раза по сравнению с контролем; содержание коньюгантов в миокарде в дозе 1 мкмоль происходит нарушение целостности мембран митохондрий, но стимуляция ПОЛ не наблюдается /16/.
При хроническом ингаляционном воздействии кадмий вызывает тяжелые поражения легких. Как показали проведенные Шоповой В. Л. с сотрудниками исследования /17/, процент альвеолярных макрофагов (АМ) при воздействии кадмия в первый день значительно понижался (до 11,5%). Этот эффект наблюдался и на пятнадцатый день тАУ АМ составил 45,5% от исходных значений. Одновременно резко повышался процент полиморфонуклеарных лейкоцитов (ПНЛ), среди некоторых встречались и незрелые формы. Средняя площадь АМ после химического воздействия увеличивалась за счет повышения процента очень крупных клеток, а не за счет равномерного увеличения площади всех клеток. При этом крупные АМ имели вакуолизированную пенистую цитоплазму. Встречались и клетки с пикнотическими ядрами, кариолизисом и кариорексисом. Все это указывает на то, что соединения кадмия существенно понижают содержание внутриклеточного АТФ и ингибируют клеточное дыхание.
В основе механизма токсического действия ионов тяжелых металлов, в том числе кадмия, лежит их взаимодействие с компонентами клеток, молекулами клеточных органелл и мембран.
Ионы металлов могут влиять на процессы, протекающие в клетке, только проникая внутрь ее и фиксируясь в субклеточных мембранах. Кадмий проникает в клетку через потенциал зависимые кальциевые канальцы. Воздействие кадмия на внутриклеточные процессы весьма разнообразны. Так, металл оказывает заметное влияние на обмен нуклеиновых кислот и белка. Он ингибирует in vivo включение тимидина в ДНК регенерирующей печени, угнетает синтез белка в печени крыс на стадии инициации трансляции, нарушая образования полирибосом, тогда как процесс элонгации, напротив, ускоряется в результате активирования факторов EF тАУ 1 и EF тАУ 2 /9/. Избыток ионов кадмия ингибирует синтез ДНК, белков и нуклеиновых кислот, влияет на активность ферментов, нарушает усвоение и обмен ряда микроэлементов (Zn, Cu, Se, Fe), что может вызывать их дефицит. Следует заметить, что при достаточном поступлении цинка в организм токсичность кадмия снижается/8/.
С помощью электронной микроскопии было установлено, что кадмий вызывает ультраструктурные изменения клеточных мембран, митохондрий, цистерн аппарата Гольджи, сети трубочек, хроматина, ядрышка, микрофиламентов и рибосом/18/.
Поражение клеточной оболочки является наиболее ранним признаком действия данного металла, особенно при длительном поступлении, хотя клетки могли переносить поражения клеточной оболочки, а также митохондрий и в некоторой степени тАУ аппарата Гольджи/16/.
При исследовании воздействия кадмия in vitro на митохондриальную мембрану выявили, что ионы кадмия повышают проницаемость мембраны к ионам H, K, Mg, а это приводит к активации дыхания энергизованных нефосфорилирующих митохондрий/15/.
Известно, что некоторые ферменты в своей структуре имеют ионы металлов. Существует группа ферментов, в состав простетической части которых входят ионы металлов IV периода таблицы химических элементов, которые способны замещаться на любой двухвалентный ион металла (близкий по положению в таблице Д. И. Менделеева) /12/, в частности, к таким ферментам относятся щелочная фосфатаза и ряд протеаз /19/. На основании проведенных экспериментов можно предположить, что в результате замещения ионов в простетической части фермента один на другой происходит изменение пространственной конфигурации активного центра фермента, что приводит к изменению уровня его активности.
Свое токсическое влияние кадмий оказывает и на репродуктивные функции организма /20/. Эффект зависит от дозы вещества и времени воздействия. Основываясь на экспериментальных данных, полагают, что тератогенное действие кадмийсодержащих веществ может быть связано с ингибированием активности карбоангидразы /16/. Так, воздействуя на ткани семенников, кадмий вызывает уменьшение синтеза тестостерона /20/. Данный металл может приводить к гормональным нарушениям у самок, предотвращает оплодотворение, может вызывать кровотечения и даже приводить к смерти эмбрионов/9,21/. Установлено также, что кадмий способен накапливаться в плаценте и вызывать ее повреждение /7/. В исследованиях /9,21/ было выяснено влияние различных доз кадмия на эмбриональную смертность. Так, при введении металла в дозе 5 мг/кг впервые обнаруживаются мертвые эмбрионы, при 10 мг/кг наблюдается снижение средней массы плода, увеличение эмбриональной смертности в 2,8 раза, а при дозе 20 мг/кг тАУ максимальное число мертвых эмбрионов на одно животное/20,22/.
В литературе описано также отдаленное воздействие кадмия на развитие потомства. В частности, в результате введения самкам раствора кадмия во время беременности и в период лактации, у потомства, подвергавшегося действию металла в эмбриогенезе, наблюдались нейрохимические изменения в мозжечке и в полосатом теле, и изменения моторной активности во взрослом состоянии/23/.
Таким образом, основываясь на литературных данных, можно отметить, что токсичность соединений кадмия следует рассматривать двояко. С одной стороны тАУ это непосредственное действие ионов на организм. С другой стороны тАУ влияние на потомство особей, подвергшихся действию соединений этого тяжелого металла.
1.2 Роль и структура аспартатаминотрансферазы и аланинаминотрансферазы
1.2.1 Краткая история открытия реакции переаминирования аминокислот
Реакция переаминирования аминокислот была открыта учёными А.Е.Браунштейном и М.Г. Крицман в 1937 году при изучении дезаминирования глутаминовой кислоты в мышечной ткани /24/. Было замечено, что при добавлении к гомогенату мышц глутаминовой и пировиноградной кислот образуется L-кетоглутаровая кислота и аланин без промежуточного образования аммиака; добавление аланина и 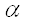 - кетоглутаровой кислоты приводило к образованию пировиноградной и глутаминовой кислот. В последующих исследования было показано, что реакции переаминирования широко распространены в живой природе и играют важную роль в сопряжении азотистого и энергетического обмена /25/.
- кетоглутаровой кислоты приводило к образованию пировиноградной и глутаминовой кислот. В последующих исследования было показано, что реакции переаминирования широко распространены в живой природе и играют важную роль в сопряжении азотистого и энергетического обмена /25/.
Реакции переаминирования протекают при участии специфических ферментов, названых А.Е. Браунштейном аминоферазами (или по современной классификации, трансаминазами). Теоретически эти реакции возможны между любой амино - и кетокислотой, но наиболее интенсивно они протекают в том случае, когда один из партнеров представлен дикарбоновой амино - или кетокислотой. В тканях животных и у микроорганизмов доказано существование реакции переаминирования также между монокарбоновыми амино - и кетокислотами/26/.
В первых же работах, посвященных к открытию ферментативного переаминирования, А.Е. Браунштейн и М.Г. Крицман высказали предложение об образовании в ходе этой реакции основания Шиффа, подвергающегося таутомерному превращению и гидролизу; при этом указывалось на возможность участия в реакции промежуточного акцептора аминогруппы. Это предположение получило повреждение после открытия в 1944 году американским биохимиком Э. Снеллом новых биологически активных форм витамина 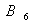 - пиридоксаля и пиридоксамина, которым была приписана роль переносчика аминогруппы. В 1945-47г.г. были получены доказательства того, что фосфорилированное производное пиридоксаля- пиродоксаль -
- пиридоксаля и пиридоксамина, которым была приписана роль переносчика аминогруппы. В 1945-47г.г. были получены доказательства того, что фосфорилированное производное пиридоксаля- пиродоксаль -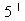 -фосфат является коферментом аспартат-трансаминаз бактериальной и животного происхождения/27/. В 1954 году А. Майстер и соавторы установили, что частично очищенная апотрансаминаза активируется при помощи пиродоксаль тАУ
-фосфат является коферментом аспартат-трансаминаз бактериальной и животного происхождения/27/. В 1954 году А. Майстер и соавторы установили, что частично очищенная апотрансаминаза активируется при помощи пиродоксаль тАУ 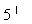 тАУ фосфата в равной мере. Эти данные согласовались с ранее высказанными предложениями, согласно которым пиридоксальфосфат и пиридоксаминфосфат подвергаются взаимопревращению в ходе катализируемой ферментом реакции, которая может быть представлена в виде суммы двух полуреакций /28/:
тАУ фосфата в равной мере. Эти данные согласовались с ранее высказанными предложениями, согласно которым пиридоксальфосфат и пиридоксаминфосфат подвергаются взаимопревращению в ходе катализируемой ферментом реакции, которая может быть представлена в виде суммы двух полуреакций /28/:
L-аппарат + ПЛФ 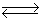 оксалацетат+ПМФ
оксалацетат+ПМФ
ПМФ + 2 тАУ оксоглутарат  L тАУ глутамат + ПЛФ
L тАУ глутамат + ПЛФ
ПЛФ тАУ пиридоксальфосфат, ПМФ- пиридоксаминфосфат.
Окончательные доказательства этого механизма были получены в конце 50-х годов получения высокоочищенных препаратов аспартат-трансаминазы из сердца свиньи. Исследуя эти препараты, удалось подтвердить наличие прочно связанного пиридоксальфосфата в трансаминазе и доказать при помощи химических и спектрофотометрических методов, что L- глутамат или L- аспартат вызывает превращение обращается при добавлении 2 тАУ оксоглутарата или оксалацетата/25/. В реакции переаминирования участвует 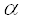 - аминокислота как донор аминогруппы и
- аминокислота как донор аминогруппы и 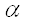 -кетокислота как акцептор аминогруппы. Донорами могут служить также
-кетокислота как акцептор аминогруппы. Донорами могут служить также 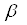 -,
-,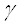 -,
-,  - и
- и 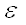 - аминогруппы ряда аминокислот (например, у орнитина
- аминогруппы ряда аминокислот (например, у орнитина 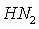 - группа находится в
- группа находится в 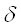 - положении, у
- положении, у 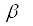 -аланина - в
-аланина - в 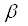 -положении/13/.
-положении/13/.
1.2.2 Структура аспартат-трансаминазы
Трансаминазы имеются во всех животных и растительных клетках, а также в микроорганизмах. В настоящее время известно около 60 трансаминаз, различающихся по субстратной специфичности. Из них лучше всего исследована аспартат-трансаминаза, при изучении которой удалось наиболее близко подойти к раскрытию молекулярного механизма переаминирования. Важным этапом в изучении аспартат-трансаминазы явилось определение её пространственной структуры при помощи метода рентгеноструктурного анализа/29/.
В начале 60-х годов было обнаружено, что в тканях животных содержатся два изофермента аспартат-трансаминазы: цитозольный и митохондриальный; их изоэлектрические точки равны соответственно ~6 и 9/30/. Несмотря на идентичность основного каталитического механизма, цитозольный и митохондриальный изоферменты различаются по многим каталитическим параметрам: удельной активности и сродству к пиродоксальфосфату, сродству к субстратам и PH-оптимуму активности. Оба изофермента имеют большее сродство к субстратам с четырёхуглеродной цепочкой, чем к пятиуглеродным субстратам. Но митохондриальный изофермент связывает L-аспартат в несколько раз лучше, а 2-оксоглутарат существенно хуже по сравнению с цитозольным изоферментом. Изоферменты различаются по способности катализировать переаминирование ароматических аминокислот, сродству к анионам, доступности инактивации трипсином и некоторыми реагентами, термостабильности и ионизации фосфатной группы кофермента.
В 1972 году под руководством Ю.А. Овчинникова и А.Е. Брауцштейна была завершена работа по определению первичной структуры цитозольной аспартат-трансаминазы из сердца свиньи/31/. К настоящему времени определены полные аминокислотные последовательности двух цитозольных изоферментов (из сердца свиньи, курицы, из печени крысы и индюка). Молекулы обоих изоферментов построены из двух идентичных полипептидных цепей (субъединиц), каждая из которых содержит одну молекулу прочно связанного с белком пиридоксальфосфата. Полипептидная цепь цитозольных аспартат-трансаминаз свиньи и курицы состоит соответственно из 412 и 411 аминокислотных остатков и имеет молекулярную массу около 46,5 кДа. Полипептидная цепь митохондриальных изоферментов свиньи и курицы состоит из 401 аминокислотного остатка и имеет молекулярную массу около 45 кДа. Оба изофермента синтезируются на рибосомах в цитоплазме клетки, причём митохондриальный фермент-в виде профермента, который содержит на NH2 тАУконце дополнительный пептид (тАЬсигнальныйтАЭ), состоящий из 29 аминокислотных остатков. Образование активной формы фермента связано с отщеплением этого пептида/28/.
В 1977 году была определена трёхмерная структура трансаминазы. Позже за рубежом были начаты рентгеноструктурные исследования других изоферментных форм аспартат-трансаминазы/29/. Определение трёхмерной структуры позволяет выявить связи между особенностями структуры и функции изоферментов. Рассмотрим результаты изучения трёхмерной структуры цитозольной куриной аспартат-трансаминазы.
Молекула состоит из двух идентичных субъединиц. Максимальные размеры молекулы составляют 110×70×60А. Белок характеризуется высоким содержанием вторичной структуры; на долю α-спиралей, β-слоя и реверсивных поворотов приходится соответственно 47,13 и 9% аминокислотных остатков. Субъединицу аспартат-трансаминазы можно условно разделить на 3 части: большой домен, малый домен и переходные участки между ними. Большой домен образован остатками с 75 по 300; его основу составляет сильно изогнутый слой (β-слой), состоящий из 7 β-цепочек, окружённых α- спиралями. Большой домен является наиболее стабильной частью субъединицы, к нему присоединён пиридоксальфосфат. Малый домен состоит из тесно сближенных NH2 тАУи СООН тАУ концевых участков полипептидной цепи, а именно из остатков с 15 по 50 и с 360 по 412. Из малого домена выходит NH2 тАУ концевой фрагмент цепи, который пересекает вход в активный центр и затем вплотную прилегает к поверхности большого домена смежной субъединицы. Большой и малый домены связаны двумя переходными участками: с NH2 тАУ конца тАУ участком цепи, состоящим из остатков 300-360. Оба переходных участка образованы преимущественно - спиралями, лежащими на поверхности молекулы/29/.
Оба активных центра аспартат-трансаминазы расположены в глубоких впадинах на противоположных сторонах молекулы на границе между субъединицами. Стенки каждого из активных центров образованы большим и малым доменом одной субъединицы и краем большого домена другой смежной субъединицы. В состав активного центра входят аминокислотные остатки, принадлежащие обеим субъединицам; этим объясняется отсутствие каталитической активности у мономера, кофермент связан в глубине щели активного центра на расстоянии ~8-10 АВ° от поверхности молекулы. Сторона А пиридированого кольца обращена к β - слою и метильной группе остатка Тrp-140 (стороны пиридинового кольца обозначены в соответствии номенклатурой JUPAC). Угол между плоскостями пиридинового и индольного колец составляет ≈40-45В°, между кольцами возможно стэкинг-взаимодействие. Остаток пиридоксальфосфата связан альдиминной связью с ε-NH2-группой лизина-258. Коферментами трансаминаз являются производные пиридоксина-пиридоксальфосфат и пиридоксаминфосфат. Оба кофермента обратимо переходят друг в друга в ходе реакции переаминирования. Трансаминазы для катализа требуют оба кофермента, в отличие от других ферментов/13/.
1.2.3 Механизм реакции переаминирования
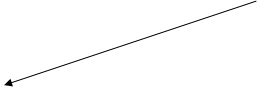
Общая теория пиридоксалевого капитализма была разработана в 1952 году А.Е. Браунштейном и М.М. Шемякиным, а несколько позднее тАУ Д.Е.Мецлером и Э.Снеллом. Согласно этой теории действие пиридоксалевых ферментов обусловлено способностью альдегидной группы пиридоксальфосфата образовывать с аминокислотами альдимины (основания Шиффа) (рисунок1)/27/. В образующемся альдимине имеется система сопряженных двойных связей, по которой происходит смещение электронов от α тАУ углеродного атома аминокислоты к электрофильному атому азота пиридинового кольца кофермента. Понижение электронной плотности у αтАУ углеродного атома приводит к поляризации и ослаблению связей у этого атома.
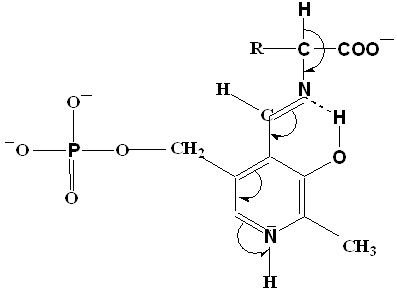
Рисунок 1 - Смещение электронов к атому N кофермента.
Проведенные А.Е. Браунштейном и Э.Снеллом модельные эксперименты показали, что избирательный разрыв только одной из этих связей с образованием карбаниона, определяется особенностями строения активного центра фермента. Эти представления получили подтверждения при исследовании очищенных фосфопиридоксалевых ферментов. В 1966 году Донатан выдвинул и теоретически обосновал важное положение о том, что в альдимине, фиксированном в активном центре фермента, должна разрываться та из связей у α тАУ углеродного атома, которая ориентирована перпендикулярно к плоскости пиридинового кольца пиридоксальфосфата. При такой ориентации энергия, необходимая для разрыва связи, минимальная вследствие перекрывания электронной орбитали связи с сопряженной π тАУ системой кофермента ( σ тАУ π - перекрывание). Донатан предположил, что конформация может контролироваться апоферментом, возможно с помощью связывания карбоксилат тАУ иона, а также, что имин может принимать одну из трех возможных конформаций/29/.
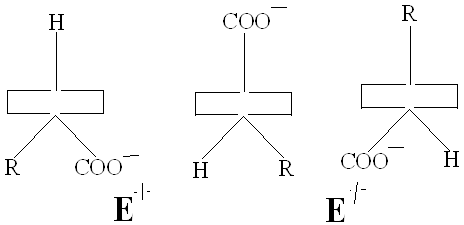
Здесь прямоугольником обозначена плоскость пиридинового кольца, вертикальной линией изображена σ тАУ связь. Конформамация (1) благоприятствует переаминированию.
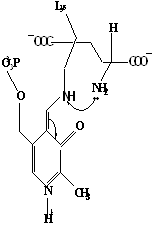
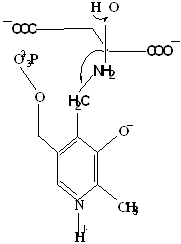
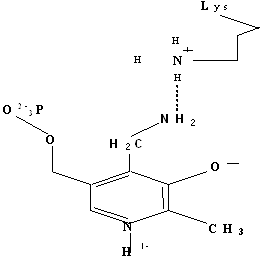
Методами спектрального анализа было установлено, что альдегидная группа связанного в активном центре пиридоксальфосфата образует так называемое тАЬвнутреннеетАЭ основание Шиффа с ε- NH2 тАУ группой остатка лизина в белке. Из этого следует, что на начальном этапе каталитической реакции α тАУ аминогруппа субстрата вытесняет ε- NH2 тАУ группу лизина из связи с коферментом (стадия трансальдиминирования). На основании изучения спектральных, химических и кинетических свойств аспартат тАУ трансаминазы был сделан вывод о том, что как прямая, так и обратная реакция переаминирования состоят из восьми стадий; интермедиаты, возникающие на этих стадиях, представлены на рисунке 2/27,28/.
На первом стадии происходит присоединение к ферменту субстратной аминокислоты с образованием нековалентного комплекса Михаэлиса. Далее один из протоков аминогруппы субстрата переходит на атом азота внутренней иминной связи (стадия 2); в результате аминогруппа приобретает нуклеофильные свойства, необходимые для атаки на атом С-4' кофермента. Эта атака приводит к образованию промежуточного тетраэдрического соединения (геминального диамина, стадия 3); за этим следует освобождение ε- NH2 тАУ группы остатка лизина из связи с пиридоксальфосфатом и возникновение "внешнего" или субстратного альдимина (стадия 5), одной из форм которого является хинолоид показанный на рис.2. Последующее протонирование атома С-4' дает кетимин (стадия 6), при гидролизе которого образуется ПМФ тАУ форма фермента и оксокислота (стадии 7 и 8). Далее реакция идет в обратном направлении между ПМФ тАУ формой трансаминазы и другой ококислотой и приводит к регенерации ПЛФ тАУ формы ("внутреннего" альдимина) и образованию новой аминокислоты.
Таким образом, реакции переаминирования являются обратимыми и универсальными для всех живых организмов. Пиридоксальфосфат в этих реакциях выполняет роль переносчика аминогруппы и в конечной стадии освобождается и может вновь вступить в ферментативный процесс.
Рисунок 2 - Основные интермедиаты, образующиеся в ходе реакции переаминирования.
а тАУ внутренний альдимин;
б тАУ нековалентный комплекс Михаэлиса;
в тАУ то же, что σ, но атом иминного азота протонирован;
гтАУ геминальный диамин;
дтАУ внешний альдимии;
е - хинолоид;
ж тАУ кетимин;
з тАУ карбиноламин;
и- пиридоксаминфосфат.







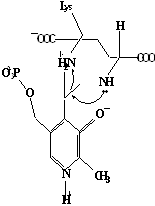



1.2.4 Биологическая роль трансаминаз
Аминокислоты, не использованные для синтеза белков и других производных, не накапливаются в организме в больших количествах. Они подвергаются различным ферментативным превращениям и, в конечном счете, распаду /32/. Важную роль в азотистом обмене играют процессы перехода одних аминокислот на другие, в результате ферментативных реакций переаминирования. При этом происходит обратимый перенос NH2 тАУ группы от L тАУ аминокислоты на L тАУ кетокислоту без промежуточного образования аммиака. Таким образом, в реакции переаминирования участвуют L тАУ аминокислота как донор и L тАУ кетокислота как акцептор аминогруппы. Эти реакции катализируются особыми ферментами трансаминазами. Коферментом трансаминаз является пиридоксаль тАУ 5׳ тАУ фосфат, который и является промежуточным переносчиком аминогруппы от аминокислоты на кетокислоту/27/.
Широкое распространение трансаминаз в животных тканях, у микроорганизмов и растений, их высокая резистентность к физическим, химическим и биологическим факторам, абсолютная стереохимическая специфичность по отношению к L - и Д тАУ аминокислотам, высокая каталитическая активность в процессах переаминирования послужили предметом детального исследования роли этих ферментов в обмене аминокислот/33/. Тип катализируемой химической реакции в сочетании с названием субстрата служит основой для систематического наименования ферментов. Согласно Международной классификации трансаминазы относят к 2 классу трансфераз, 4 подклассу тАУ аминотрансферазы; наименование их составляется по форме Влдонор тАУ транспортируемая группа тАУ трансферазаВ» /34/. А. Е. Браунштейн выдвинул гипотезу о возможности существования в живых тканях не прямого пути дезаминирования аминокислот через реакции переаминирования, названного им трансдезаминированием. Основой для этой гипотезы послужили данные о том, что из всех природных аминокислот в животных тканях с высокой скоростью дезаминируются только L тАУ глутаминовая кислота. Согласно этой теории большинство природных аминокислот сначала реагируют с L тАУ кетоглутаровой кислотой в реакции переаминирования с образованием глутаминовой кислоты к соответствующей кетокислоте/30/. Образовавшаяся глутаминовая кислота подвергается окислительному дезаминированию под действием глутаматдегидрогеназы. Механизм трансдезаминирования можно представить в виде следующей схемы /13/:
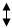
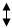
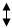 R1- CH (NH2)-COOH L-кетоглутарат НАДН2 + NH3
R1- CH (NH2)-COOH L-кетоглутарат НАДН2 + NH3
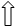 R1- CO- COOH L-глутамат НАД + Н2О
R1- CO- COOH L-глутамат НАД + Н2О
трансаминаза глутаматдегидрогеназа
Обе реакции (переаминирование и дезаминирование глутаминовой кислоты) являются обратимыми, создаются условия для синтеза любой аминокислоты, если в организме имеются соответствующие L тАУ кетокислоты. Организм животных и человека не обладает способностью синтеза углеводородного скелета (L - кетокислот) так называемых незаменимых аминокислот, этой способностью обладают только растения и многие микроорганизмы.
В живых организмах осуществляется синтез природных аминокислот из L тАУ кетокислот и аммиака, этот процесс был назван А. Е. Браунштейном трансреаминированием. Сущность его сводится к восстановительному аминированию L тАУ кетоглутаровой кислоты, с образованием глутаминовой кислоты, и к последующему переаминированию глутамата с любой L тАУ кетокислотой. В результате образуется L тАУ аминокислота, соответствующая исходной кетокислоте, и вновь освобождается L тАУ кетоглутаровая кислота, которая может акцептировать новую молекулу аммиака/35/.Схематически роль трансаминаз в дезаминировании в биосинтезе аминокислот можно представить в следующем виде/28/:
 L-Аминокислота Пиридоксальфосфат L-Глутамат НАД
L-Аминокислота Пиридоксальфосфат L-Глутамат НАД

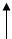
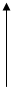
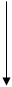 R1-CH(NH2)-COOH O=CH-ПФ HOOC-(CH2)2-CH(NH2)-COOH НАДФ
R1-CH(NH2)-COOH O=CH-ПФ HOOC-(CH2)2-CH(NH2)-COOH НАДФ



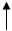
 Трансаминаза НАДФН2
Трансаминаза НАДФН2
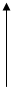
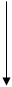 R1-C-COOH H2N-CH2-ПФ HOOC-(CH2)2-C(NH)-COOH НАДН2
R1-C-COOH H2N-CH2-ПФ HOOC-(CH2)2-C(NH)-COOH НАДН2
L-кетокислота Иминоглутарат

 Пиридоксаминфосфат Н2О
Пиридоксаминфосфат Н2О
 HOOC-(CH2)-C-COOH
HOOC-(CH2)-C-COOH
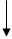 L-кетоглутарат NH3
L-кетоглутарат NH3
Схема пока
Вместе с этим смотрят:
G-белки и их функция
Австралопитеки - обезьянолюди или человекообезьяны?
Адаптация микроорганизмов в экстремальных условиях космоса
Адвентивна флора Чернiгiвськоi областi: iсторiя формування та сучасний стан
Адсорбция ионных и неионных поверхностно-активных веществ (ПАВ)