Клеточная биотехнология
Клеточная биотехнология базируется на использовании культуры клеток, тканей и протопластов. Для того чтобы манипулировать клетками, нужно выделить их из растения и создать такие условия, при которых они могли бы жить и размножаться вне растительного организма. Метод культивирования изолированных клеток и тканей на искусственных питательных средах в стерильных условиях (in vitro) получил название культуры изолированных тканей и приобрёл особое значение в связи с возможностью его использования в биотехнологии.
Культура клеток высших растений может рассматриваться с трёх точек зрения тАУ как уникальная биологическая система, как модель в физиологии растений и как инструмент для разнообразных исследований и биотехнологий. Изолированные растительные клетки способны продуцировать ценные для медицины, парфюмерии и других отраслей промышленности вещества вторичного синтеза (вещества не участвующие в основном обмене веществ): алкалоиды, стероиды, гликозиды, гормоны, эфирные масла и т.д. Продуктивность культивируемых клеток в результате клеточной селекции может значительно превышать продуктивность целых растений. Использование изолированных культур клеток в селекции, дают возможность получать быстрорастущие растения, устойчивые к различным неблагоприятным факторам среды. Вместе с тем, это направление предусматривает создание новых растений путём слияния изолированных протопластов и получение соматических гибридов. Перенос в изолированные протопласты чужеродных генов с помощью методов генной инженерии позволяет получать в дальнейшем растения с новыми наследуемыми свойствами. Культура клеток как экспериментально созданная биологическая система интересна сама по себе и является объектом исследования узкого круга специалистов. Как модель, клетки in vitro представляют интерес для многих физиологов и биохимиков растений. Очевидно, что адекватно использовать культуру клеток как модель можно тогда, когда чётко представляешь её свойства, как биологической системы. И, наконец, как инструмент фундаментальных и прикладных исследований. Статус экспериментально созданной биологической системы обусловлен свойственной культурам клеток изменчивостью, наследуемостью возникших изменений, адаптивным отбором и эволюцией. В некотором роде её можно считать микропопуляцией, основное отличие которой от природных популяций - это отсутствие полового размножения особей, т.е. клеток. Можно выделить две принципиальные особенности культуры клеток растений как биологической системы: во-первых, отсутствие организменного контроля развития, и во-вторых - избыточный генетический материал. Культивируемые клетки и ткани могут служить адекватными моделями для исследований различных направленностей, например метаболизма и его регуляции в клетках и тканях целого растения. И для более глубокого понимания данных процессов и явлений часто используются методы создания биохимических мутантов, гибридных и трансформированных клеток в пределах исследуемой культуры. Простота клеточных моделей, возможность быстро получать достаточную массу в асептических, контролируемых по многим параметрам условиях являются преимуществами такого моделирования. В отношении синтеза вторичных метаболитов культуры клеток также обладают рядом достоинств, а именно возможность использования для этой цели растения, не произрастающие в наших природных условиях, и получать продукцию круглый год. Тем не менее, проблемы клеточных и молекулярных основ морфогенеза, не говоря уже о механизмах морфогенеза, остаются малоизученными. Прежде всего, это концепция тотипотентности растительной клетки и её влияние на стратегию исследовательской работы с культурой тканей и клеток растений. Постулат этой концепции о первичности внешнего сигнала в морфогенетическом ответе растительной клетки во многом определил экстенсивный характер исследований в области культуры клеток растений. Второй причиной является сложность морфогенетических процессов, которые позволяют моделировать и изучать культуры клеток и тканей. Известно, что в культуре in vitro может осуществляться реализация нескольких морфогенетических программ, а именно зародышевого развития и некоторого органогенеза. Возможность моделирования в культуре in vitro более простых процессов, например гистогенеза и цитодифференцировок представляется затруднительнее. Однако, в рамках исследования эти проблемы вполне преодолимы, при индивидуальной разработке методики и постановки эксперимента.
Общее представление о росте и развитии
О росте растений, казалось бы, можно судить по увеличению общей биомассы. Однако этот показатель весьма неоднозначен, поскольку сырая биомасса может не только увеличиваться, но и уменьшаться. Ещё один показатель роста тАУ это увеличение числа клеток. Если число клеток растёт, можно уверенно говорить о росте, но постоянное число клеток ещё не говорит об отсутствии роста: в зоне растяжения увеличение числа клеток незначительно, тем не менее, рост идёт. О росте можно судить по увеличению линейных размеров тАУ высоты растения, длины корня, ширины листа и т.д.
Таким образом, ростом можно называть необратимое увеличение растения хотя бы по одному из параметров: число клеток, линейные размеры, сырая/сухая биомасса.
Упрощённой моделью изменения параметров роста от времени является Влкривая ростаВ». Более подробно я буду говорить о ней ниже. Следует только отметить, что характер этой кривой способен резко меняться, в связи с действием на растение массы внешних факторов. Общая кривая роста, часто оказывается составленной разномасштабными S тАУ образными участками. Таким образом, кривая роста целого растения обычно имеет более сложную форму.
Дифференцировка
Термин дифференцировка был введён для обозначения процесса приобретения различий между клетками (тканями, органами, системами органов и т.д.). Предполагается, что есть начальное недифференцированное состояние, когда наблюдатель не может установить различий между клетками, затем появляются видимые различия клеток и они становятся дифференцированными. Традиционно недифференцированными считают: делящиеся клетки эмбриона; меристематические клетки апексов корня и стебля, камбия, феллогена, интеркалярных меристем; клетки,_неорганизованно делящиеся в экспериментальных условиях (суспензионная и каллусная культура in vitro).
Клетки, покинувшие зону деления, приступают к дифференцировке. Результат этого процесса можно увидеть, например, при образовании проводящей системы: возникает прокамбий, который дифференцируется на флоэму, ксилему и камбий. Во флоэме дифференцируются ситовидные элементы и клетки-спутницы, в ксилеме тАФ паренхимные клетки и трахеиды, проводящий пучок может быть усилен дифференцирующимися механическими тканями и т.д. В данном примере клетки поэтапно приобретают анатомические различия в связи с выполняемыми функциями, многообразие клеток растет.
Анатомической дифференцировке предшествует биохимическая дифференцировка, когда видимых различий между клетками мало, но они, не одинаковы по содержанию тех или иных веществ. Удобнее следить за дифференциальной эспрессией генов: появлением новых или снижением уровня старых мРНК и белков. Эти данные позволяют зарегистрировать различия между клетками раньше, чем они станут видимыми на анатомическом уровне. Таким образом, дифференцировка начинается с изменения активности генома, экспрессии одних генов и подавления активности других.
При таком подходе делящиеся клетки меристемы придется считать дифференцированными, так как для прохождения клеточного цикла нужна определённая активность генома, которая и будет отличать эти клетки от других. Анатомы давно обратили внимание на неоднородность клеток меристемы. Можно сказать, что апикальная меристема корня дифференцирована на каллиптроген (инициали чехлика), дерматоген (инициали эпидермальной ткани), инициали коры, покоящийся центр и инициали осевого цилиндра. Для каждой из групп делящихся клеток характерны определенная локализация, направление веретена делений и тип производных клеток. Исследование меристемы методами молекулярной генетики показывает, что обнаруженная анатомами дифференцировка меристемы на зоны совпадает с зонами дифференциальной экспрессией определенных генов. Более того, саму меристему в целом можно достаточно четко выделить по зонам дифференциальной экспрессии. Таким образом, меристема является биохимически дифференцированной тканью.
Дифференциальная экспрессия генов тАФ фундаментальное проявляение дифференцировки, и, как это ни парадоксально, недифференцированных клеток вообще не существует. Понятие ВлнедифференцированныйВ» хорошо работает только там, где в соответствии с задачами исследования исходные различия между клетками не учитывают (или нет методов их обнаружить).
Генетический анализ процесса развития предполагает его разложение на ряд промежуточных этапов, каждый из которых контролируется определённой генетической системой. Развитие есть результат совместной, возможно сменяющей друг друга активности двух генетических систем тАУ первичной и вторичной. Под первичной системой понимается генетический контроль, жёстко регламентирующий переход развивающейся системы из одного состояния в другое, а под вторичной генетической регуляцией тАУ способность системы достигать некоторого конечного состояния автоматически или авторегуляторно.
Геноконтролируемые этапы являются критическими периодами в развитии биологической системы, поскольку именно здесь происходят коренные изменения, связанные с формированием морфофункциональной структуры и определение принципов регулирования. В эти периоды создаются предпосылки негеноконтролируемых переходов системы, в которых она сохраняет свои качественные характеристики и свойства, а также демонстрирует низкую чувствительность к внешним и внутренним изменениям условий развития.
Итак, дифференцировкой можно назвать процесс изменения профиля генной активности, приводящий к дальнейшему изменению функции клеток.
Тотипотентность
В эмбриологии животных процесс дифференцировки изображают как сложный ВлландшафтВ», по которому катится ВлшарВ». Шар тАФ это символ клетки, дающей начало новому организму. В развилках шар Влсовершает выборВ» и скатывается по одной из нескольких возможных траекторий. Так и клетки, возникшие при делении зиготы, направляются по одному из возможных путей дифференцировки. При этом клетки теряют Влморфогенетический потенциалВ». Все ВлтраекторииВ» заканчиваются в ВлмореВ», символизирующем смерть организма.
Если в начале пути у ВлшараВ» - клетки много потенциальных возможностей, то по мере приближения к ВлморюВ» их становится все меньше.
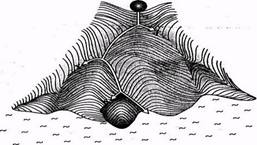
По имени ученого, предложившего такую аналогию, ее называют морфогенетическим ландшафтом Уоддингтона.
Процесс дифференцировки равносилен потере морфогенетического потенциала.
В отличие от клеток животных большинство клеток растений после анатомической дифференцировки легко переходят к делению. Такой процесс называют дедифференцировкой (потерей специализации). При механическом повреждении растения, а также в условиях эксперимента дедифференцировка приводит к образованию каллуса.
Из большинства клеток можно получить новый организм (для клеток животных это невозможно). Практически любая клетка многоклеточного организма содержит полный набор генов, необходимый для формирования организма, однако не каждая клетка может дать начало целому организму. Свойство клетки реализовать имеющуюся генетическую информацию и дать начало целому организму называют тотипотентностью. Тотипотентность клеток растения сравнительно легко реализовать, тогда, как большинство животных клеток не могут образовать новый организм. Таким образом, понятие дифференцировки как снижения морфогенетического потенциала, заимствованное из эмбриологии животных, не применимо к тотипотентным растительным клеткам, так как их морфогенетический потенциал долго остается высоким.
Идея о тотипотентности растительной клетки была выдвинута Г. Хаберландтом еще в 1902 г., хотя и не получила тогда экспериментального подтверждения. Согласно определению Хаберландта, любая клетка растения может дать начало новому организму, и если этого не наблюдается, то только потому, что растительный организм подавляет потенции клетки к развитию. Изоляция клеток от растений способствует проявлению этих потенций.
Культура каллусных тканей
и их морфогенетические особенности
Культура изолированных тканей обычно бывает представлена каллусными или опухолевыми тканями. Каллусная культура тАУ это неорганизованная пролиферирующая ткань, состоящая из недифференцированных клеток. В дальнейшем они специализируются как каллусные. Каллус может образовываться как на изолированных участках ткани (эксплантах) in vitro, так и на растении при повреждении.
Каллусная ткань in vitro в основном бывает белого или желтоватого, реже светло-зелёного цвета (полная или зональная пигментация антоцианами). Тёмно-коричневая окраска возникает при старении каллусных клеток и вызвана накоплением в них фенолов. Каллусная ткань аморфна и не имеет конкретной анатомической структуры, но в зависимости от происхождения и условий выращивания она может быть различной консистенции:
1. Рыхлая, состоящая из сильно оводнённых клеток, легко распадающиеся на отдельные агрегаты.
2. Средней плотности, с хорошо выраженными меристематическими очагами.
3. Плотная, в которой дифференцируются элементы камбия и проводящей системы.
Обязательным условием дифференцировки растительной клетки и превращение её в каллусную является присутствие в питательной среде двух групп антагонистических гормонов: ауксинов и цитокининов. Ауксины вызывают процессы дифференцировки клетки, запуская механизмы активизации вторичных мессенджеров, способствующих растяжению клеточных стенок и дальнейшую пролиферацию, а цитокинины вызывают деление уже дифференцированных клеток. Для того чтобы дифференцированные клетки вновь приобрели способность к делению, необходим ВлвозвратВ» к меристематическому состоянию (дедифференцировка). Размножение дифференцированных клеток приводит к анархическому, неорганизованному росту, в результате чего образуется каллусная ткань. Таким образом, превращение специализированной клетки в каллусную связано с индукцией митозов, способность к которому была потеряна в процессе дифференцировки.
Эффект, вызываемый действием одних и тех же фитогормонов, может быть различным в зависимости от физиологической характеристики ткани-мишени. Её компетентность определяется степенью дифференцировки клеток.
Переход клетки in vitro из дифференцированного состояния к дедифференцировке и активным клеточным делениям обусловлен изменением активности генов (эпигеномной изменчивостью). Активирование одних генов и репрессирование других приводит к изменению в белковом составе клеток. В каллусных клетках появляются специфические белки и одновременно исчезают или уменьшаются в количестве белки, характерные для фотосинтезирующих клеток листа. У двудольных растений процесс репрессии и дерепрессии генов, лежащий в основе дедифференцировки, происходит легче, чем у однодольных. При переходе дедифференцированной клетки к неорганизованному анархическому размножению, приводящему к образованию каллусной ткани, в клетках происходят биохимические и цитологические изменения. Дедифференцировка начинается с использования запасных веществ и разрушения специализированных клеточных органелл. Через 6тАФ12 ч после индукции дедифференцировки клеточная оболочка разрыхляется и разбухает, увеличивается число свободных рибосом, возрастает число элементов аппарата Гольджи, увеличиваются размеры и число ядрышек. Все эти изменения предшествуют началу делений, которые начинаются через 48-72 часа.
Каллусная клетка имеет свой цикл развития и повторяет развитие любой клетки, включая деление, растяжение и дифференцировку, после чего наступает старение и отмирание клетки. Каллусную дифференцировку можно назвать вторичной, но её не следует путать с вторичной дифференцировкой клетки, лежащей в основе морфогенеза. Для того чтобы не произошло старения, утраты способности к делению и отмирание каллусных клеток, первичный каллус, возникший на эксплантах, через 4-6 недель переносят на свежую питательную среду тАУ пассируют. При регулярном пассировании способность к делению может поддерживаться в течение нескольких лет.
Ростовая кривая каллусных клеток имеет S-образную форму (рис.1). Данный график включает пять фаз. Во время первой тАУ латентной фазы увеличения числа и массы клеток не происходит. Клетки в этот период подготавливаются к делению. Вторая фаза - период экспоненциального роста, характеризующаяся наибольшей митотической активностью и увеличением массы каллусной культуры. Кроме того, рост здесь происходит с ускорением. Третья фаза тАУ линейная, где скорость роста клеток относительно постоянна. Далее наступает фаза замедленного роста, при которой митотическая активность клеток резко снижается. И пятая фаза тАУ стационарная или период деградации. Скорость нарастания клеточной массы здесь равна нулю.

На электронно-микроскопических фотографиях показана тонкая структура молодой, растущей и стареющей клетки каллусной ткани:

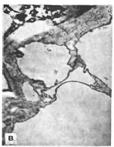
а тАУ молодая
б - растущая
в - стареющая
Успех в применении культуры клеток и тканей в первую очередь зависит от оптимизации физиологических процессов, обеспечивающих нормальную пролиферацию, их дифференцировку и регенерацию из них взрослых особей. Наиболее сложной является регенерация растений из отдельных клеток. В первую очередь это касается злаковых растений. Поэтому важнейшее значение имеет выяснение механизма морфогенеза in vitro, регенерация и лежащих в их основы процессов.
Каллусные клетки in vitro сохраняют многие физиолого-биохимические черты, свойственные нормальным клеткам, входящим в состав растительного организма. Каллусные клетки сохраняют способность к синтезу вторичных метаболитов. Морозостойкость и способность к закаливанию присущи каллусным клеткам, полученным от морозостойких растений. Этим свойством не обладают каллусные ткани, полученные от тропических и субтропических культур. Таким образом, устойчивость к низким температурам сохраняется при переходе клетки к каллусному росту. Каллусным тканям свойственна и фотопериодическая реакция, что связано с сохранением активности фитохромов. Общим у каллусные и нормальных клеток растения является и еще ряд признаков, в частности, устойчивость к действию высоких температур, осмотически активных веществ, засолению.
Вместе с тем каллусные клетки обладают отдельными свойствами, отличающими их от нормальных. В них появляются специфические белки, и уменьшается количество белков, характерных для фотосинтезирующих клеток листа, или они совсем исчезают. Каллусные клетки отличаются большой генетической гетерогенностью и физиологической асинхронностью.
В результате выхода из-под контроля организма рост каллусных клеток происходит неорганизованно, асинхронно, и является неограниченным.
Клеточный цикл у каллусных клеток более длительный, чем у растений, произрастающих в открытом грунте. Особенностью каллусных клеток является гетерогенность по возрасту. В каллусной ткани одновременно присутствуют клетки молодые в G1-фазе, старые в G2- и S-фазах цикла клеточных делений.
Значительные отличия наблюдаются в энергетическом обмене каллусных клеток. Они потребляют меньше кислорода по сравнению с нормальными.
Митохондрии в каллусных клетках так же, как и в меристематических, являются слабо развитыми, в них мало крист, что не может не оказывать влияния на активность аэробного дыхания.
Наряду с изменением характера дыхания в каллусных клетках в направлении усиления бескислородного расщепления углеводов происходит также сдвиг в сторону пентозофосфатного пути, который является источником пентоз, необходимых для делящихся клеток.
Длительное время считали, что каллусные клетки генетически строго однородны. Однако клетки каллусной ткани обладают выраженной генетической гетерогенностью. Генетическая неоднородность каллусных клеток выражается, прежде всего, в различной плоидности, т.е. каллусные клетки отличаются по числу хромосом. Генетически стабильными in vitro являются меристематические ткани. В каллусных и суспензионных культурах встречаются клетки, имеющие диплоидный набор хромосом, свойственный исходному растению, полиплоидные клетки, содержащие 3, 4, 5 и более хромосомных наборов. Наряду с полиплоидией в культуре каллусных тканей можно нередко наблюдать анеуплоидию (возрастание или уменьшение хромосомного набора на несколько хромосом). Чем длительнее культивировать каллусные клетки, тем больше они различаются по плоидности. В каллусных клетках табака через четыре года культивирования совсем не остается диплоидных клеток: все клетки становятся полиплоидными или анеуплоидными. Этот факт указывает на то, что изменение плоидности происходит под влиянием условий культивирования и, прежде всего входящих в состав питательной среды веществ. Однако можно интерпретировать его и иначе. Полиплоидные клетки имеют меньшую лаг-фазу и поэтому быстрее переходят к делениям, чем диплоидные. Вследствие этого они и получают преимущество в дальнейших пассажах. Скорее всего, влияние оказывают обе причины.
Кроме изменения плоидности, культивирование клеток и тканей растений in vitro вызывает появление в клетках хромосомных аббераций. Последние сказываются на биологических особенностях культивируемых тканей, изменяя их внешний вид, обмен веществ, скорость роста. Наряду с видимыми под микроскопом хромосомными мутациями в культивируемых клетках могут возникать изменения, не выявляемые микроскопически. Эти изменения могут затрагивать как незначительные участки хромосом, так и структуру генов. Генные мутации выявляются по изменению морфологии и физиолого-биохимических свойств клеток.
Каковы же причины генетической нестабильности культивируемых клеток? Таких причин несколько. Прежде всего тАУ это генетическая неоднородность исходного материала (гетерогенность экспланта). У многих растений дифференцированные ткани характеризуются наличием клеток разной плоидности и лишь активно пролиферирующие в течение онтогенеза ткани, такие, как верхушечные меристемы, камбий и другие, остаются всегда диплоидными. Другой причиной может быть длительное пассирование тканевых и клеточных культур, приводящее к накоплению в них генетических изменений, в том числе к неравномерному изменению плоидности. Нарушение коррелятивных связей при изолировании участков тканей растений и помещении их на питательную среду также приводит к генетической нестабильности клеток. Подобные результаты могут быть связаны и с влиянием на генетический аппарат клетки входящих в состав питательных сред фитогормонов. В качестве гормонов в питательные среды для каллусообразования обязательно входят ауксины и цитокинины. О мутагенном действии этих веществ известно из целого ряда работ. Наиболее активным мутагенным препаратом является 2,4-Д (2,4-Дихлорфеноксиуксусная кислота тАУ синтетический аналог индолилуксусной кислоты), входящий в состав большинства питательных сред. Цитокинины, в частности кинетин, способствуют полиплоидизации клеток. Не исключено, что возникновение генетических аббераций вызвано накоплением вторичных метаболитов, и в частности полифенолов.
Существует несколько путей, по которым может идти развитие клетки после ее дедифференцировки.
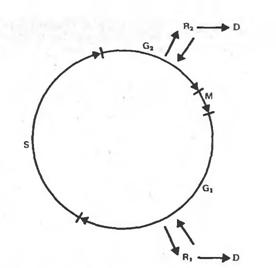
Первый путь тАУ это вторичная регенерация целого растения, возможна дифференцировка на уровне клеток, тканей, органов.
Второй путь - это утрата клеткой способности к вторичной дифференцировке и регенерации растения, стойкая дедифференцировка, приобретение способности расти на среде без гормонов, т.е. превращение в опухолевую. Такими свойствами часто характеризуются клетки старых пересадочных культур. На рисунке изображены фазы клеточного цикла, и показано, в каких из них клетки могут выйти из митотического цикла, и перейти в дифференцированное состояние и соответственно вернуться в цикл при дедифференцировке и индукции их к делению. Обычно клетки переходят к специализации из фазы G1.
Третий путь - это нормальный цикл развития каллусной клетки, заканчивающийся ее старением и отмиранием. В этом случае клетка претерпевает вторичную дифференцировку и прекращает делиться (стационарная фаза роста). Однако такая дифференцировка не ведет к морфогенезу, а закрепляет за ней свойства старой каллусной клетки. В культуре каллусных тканей морфогенезом называют возникновение организованных структур из неорганизованной массы клеток.
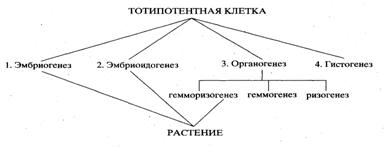
Существует два основных типа морфогенеза. В культуре тканей он может проявляться в виде органогенеза (образования монополярной структуры, т.е. отдельных органов); корневого, стеблевого, реже флорального (цветочного) или листового, в виде соматического эмбриогенеза (образования биполярных зародышеподобных структур из соматических клеток).
В случае органогенеза сначала регенерируют отдельные органы, а затем уже из них - целые растения, исключение составляет корневой органогенез. В результате соматического эмбриогенеза в отличие от органогенеза сразу образуется зародыш, имеющий как меристему корня, так и меристему верхушечной почки, из которого в дальнейшем развивается целое растение.
Согласно концепции тотипотентности, если мы получаем каллус из клеток лепестка цветка, или из клеток сердцевинной паренхимы стебля, или из клеток любой ткани, то в принципе каждая такая клетка может регенерировать целое растение. Однако свойство тотипотентности не всегда реализуется, так как потенциальные возможности клеток разных типов проявляются неодинаково. В некоторых из них гены в сильной степени репрессированы, в связи с чем проявление тотипотентности становится ограниченным.
Клеточную основу морфогенеза составляет цитодифференцировка. Регенерация растения начинается с вторичной дифференцировки клеток. При этом дедифференцированные клетки вновь приобретают структуру и функции специализированных. Вторичная дифференцировка каллусных клеток не всегда заканчивается морфогенезом и регенерацией растения. Иногда она приводит только к образованию тканей (гистодифференцировка). Таким путем каллусная клетка может превращаться во флоэмные или ксилемные элементы. Другим примером вторичной дифференцировки может служить превращение дедифференцированной активно пролиферирующей клетки в старую неделящуюся каллусную клетку (стационарная фаза роста).
Из всех видов вторичной дифференцировки наибольший интерес представляет морфогенез, так как он позволяет получать целое растение из каллусной клетки. Как отмечалось выше, в основе дифференцировки и морфогенеза лежит последовательное включение различных генов, т.е. дифференцировка клеток определяется дифференциальной активностью генов. Изменение активности структурных генов может быть связано сих дерепрессией, репрессией или амплификацией. Большую роль в этом процессе играют фитогормоны.
Морфогенезом в культуре каллусных тканей можно управлять. На способность изолированных растительных клеток к морфогенезу оказывают влияние как внутренние, так и внешние факторы. К внутренним факторам относятся: видовая принадлежность исходного растения, орган, из которого взят эксплант, возраст экспланта, и даже его массы. В этом случае можно говорить об Влэффекте минимальной массыВ», который сводится к тому, что способность уже детерминированных клеток к дальнейшей дифференцировки зависит от наличия некоторой минимальной массы, необходимой для морфогенеза.
Любопытны работы по выявлению зависимости регенерации растений от скорости их развития. Раннеспелые сорта характеризуются более низким уровнем регенерации по-сравнению с позднеспелыми культурами. Возможно, что выделенные для культивирования in vitro из более быстро развивающихся растений органы и ткани могут иметь жолее короткий период существования инициальных меристематических клеток, обеспечивающих морфологическую компетентность у потенциальных эксплантов.
К внешним факторам, прежде всего, относятся: состав питательной среды, температура, свет (интенсивность и длина фотопериода). Наиболее мощным индуктором морфогенеза, который принято называть стимулом или сигналом морфогенеза, является изменение соотношения между цитокининами и ауксинами, входящими в состав питательных сред.
Присутствие в среде одного ауксина определяет переход специализированной клетки из фазы G0 митоза в S-фазу. Однако для завершения фазы синтеза ядерной ДНК, синтеза белков, стимулирующих переход клеток к митозу и цитокенезу, необходимо добавление к среде кинетина.
При преобладании цитокининов над ауксинами часто начинается стеблевой органогенез, а в случае преобладания ауксинов тАУ корневой. Это легко объяснить антагонистичностью двух гормонов, их совместным аттрагирующим эффектом и процессом индукции/репрессии апикального доминирования.
Таким образом, различия в балансе экзогенных гормонов ауксинового и цитокининового рядов определяет, с одной стороны, возможность перехода клетки в культуре к дифференцировки и неорганизованной пролиферации, а с другой стороны - индукцию вторичной дифференцировки того или иного типа морфогенеза.
Если органогенез можно индуцировать с помощью ауксинов или цитокининов, то соматический эмбриогенез фактически независим от экзогенных фитогормонов. Обычно эмбриогенные зоны возникают в каллусной ткани на той же питательной среде, которая использовалась для каллусообразования. Развитие соматических зародышей в каллусной ткани начинается тогда, когда устраняется дедифференцирующий фактор из питательной среды (2,4-Д или другие ауксины). Развивающийся зародыш не нуждается в экзогенных гормонах, так как сам обеспечивает себя ими.
Независимость соматического эмбриогенеза от гормонов является аргументом в пользу точки зрения, высказанной Хаберландтом, а позднее Стэвардом, что сам процесс изолирования клетки стимулирует реализацию ее тотипотентности, т.е. переход к морфогенезу. Таким образом, основными стимулами морфогенеза являются изменения соотношения гормонов в питательной среде, а также сам процесс изоляции растительной клетки от организма.
Дополнительными стимулами морфогенеза в культуре каллусных тканей является присутствие в питательной среде нитрата серебра, нитрата аммония, некоторых аминокислот (пролин, тирозин, иногда серии), полиаминов (путресцин и спермидин). В ряде случаев стимулируют процесс морфогенеза маннит и сорбит. Ионы N03, оказывают влияние на развитие возникших в каллусной ткани организованных структур, а их индукцию стимулируют ионы NН4. Гиббереллиновая кислота стимулирует рост зачатков стебля, а абсцизовая ускоряет дифференцировку органов соматических зародышей. Интересно отметить, что некоторые из перечисленных веществ, например, нитрат серебра, продлевают регенерационную способность в старых пересадочных культурах. Под влиянием того или иного стимула морфогенеза каллусная клетка должна стать детерминированной, однако не все клетки, а лишь одна из 400тАФ1000 становится на путь регенерации. Следовательно, для перехода к морфогенезу недостаточно индуктора (стимула), а необходимо, чтобы клетка была готова к ответу на него. Способность воспринимать стимулы морфогенеза называют компетентностью клетки. Исследователи пришли к выводу, что компетентность клеток - событие случайное и поэтому столь редкое. В связи с этим напрашивается вопрос о судьбе тех каллусных клеток, которые в силу некомпетентности не способны воспринять стимулы морфогенеза и детерминироваться. В пересадочной культуре эти клетки продолжают делиться и, скорее всего, становятся на путь перехода к гормононезависимости. Однако не все каллусные ткани со временем завершают развитие возникновением гормононезависимости.
Многие из них в силу генетических особенностей продолжают использовать экзогенные гормоны, но полностью утрачивают способность к регенерации. Такие ткани занимают промежуточное положение между ВлпривыкшимиВ» и свежими каллусными тканями. Морфогенез в каллусной ткани начинается с того, чтопод влиянием соответствующих условий детерминированная клетка обособляется от окружающих ее каллусных клеток, образуя утолщенную клеточную стенку. Клетка - инициаль при соматическом эмбриогенезе дает начало зиготе, а при органогенезе - меристематическому очагу. От недетерминированных каллусных клеток инициальная отличается более крупным ядром и меньшими размерами вакуолей. Ядро обычно занимает центральное положение. В инициальных клетках содержатся большие количества запасных веществ: крахмала, иногда тАФ липидов. Некоторое время инициальные клетки находятся в лаг-фазе, что необходимо для их перестройки и подготовки к последующим быстрым делениям. Затем эти клетки делятся по типу дробления, образуя сферическую массу мелких изодиаметрических клеток. В случае органогенеза эту массу клеток называют меристематическим очагом, а в случае соматического эмбриогенеза - глобулярным проэмбрио. В дальнейшем в меристематическом очаге дифференцируются зачатки стебля, корня, листа или цветочной почки и соответственно происходит стеблевой, корневой, листовой или флоральный органогенез. В глобулярном проэмбрио развивается биполярная эмбриоидная структура. Можно выделить несколько последовательных стадий формирования соматических эмбриоидов из каллусной клетки: глобулярную, сердечка, торпедовидную, соматического зародыша. Меристематические очаги или проэмбрио могут возникать на периферии каллусной ткани или быть погруженными в нее. Обычно не наблюдается определенной закономерности в их локализации.
Сравнительный анализ половых и соматических зародышей позволяет говорить о параллелизме их развития, который проявляется в основных закономерностях морфогенеза (полярности, симметрии, клеточной и тканевой дифференциации, способности к пролиферации). И половые и соматические зародыши характеризуются полиморфизмом, переходными формами и аномалиями. Генезис и структура соматического зародыша таксоноспецифицны. Возможно, они определяются местом формирования инициальной клетки. С помощью сопоставления характеров формирования половых и соматических зародышей, была выделена новая категория вегентативного размножения растений тАУ эмбриоидогения.
При переходе каллусных клеток к морфогенезу происходит существенное изменение их метаболизма. Морфогенезу предшествует появление в клетках белков-антигенов. В работах Р.Г. Бутенко, Н.И. Володарского и Н.А.Моисеевой показано, что морфогенез в культуре каллусных тканей табака характеризуется включением и выключением синтеза определенных белков-маркеров. В меристемах обнаружено два белка-антигена, которые являются маркерами этих
Вместе с этим смотрят:
G-белки и их функция
Австралопитеки - обезьянолюди или человекообезьяны?
Адаптация микроорганизмов в экстремальных условиях космоса
Адвентивна флора Чернiгiвськоi областi: iсторiя формування та сучасний стан
Адсорбция ионных и неионных поверхностно-активных веществ (ПАВ)