Белковый обмен в организме человека
Организм человека состоит из белков (19,6 %), жиров (14,7 %), углеводов (1 %), минеральных веществ (4,9 %), воды (58,8%). Он постоянно расходует эти вещества на образование энергии, необходимой для функционирования внутренних органов, поддержания тепла и осуВнществления всех жизненных процессов, в том числе физиВнческой и умственной работы.
Одновременно происходят восстановление и создание клеток и тканей, из которых построен организм человека, восполнение расходуемой энергии за счет веществ, постуВнпающих с пищей. К таким веществам относят белки, жиВнры, углеводы, минеральные вещества, витамины, воду и др., их называют пищевыми. Следовательно, пища для организма является источником энергии и пластических (строительных) материалов.
Это сложные органические соединения из аминокисВнлот, в состав которых входят углерод (50тАФ55%), водород (6тАФ7 %), кислород (19тАФ24 %), азот (15тАФ19 %), а также могут входить фосфор, сера, железо и другие элементы.
Белки тАФ наиболее важные биологические вещества живых организмов. Они служат основным пластическим материалом, из которого строятся клетки, ткани и органы тела человека. Белки составляют основу гормонов, ферВнментов, антител и других образований, выполняющих сложные функции в жизни человека (пищеварение, рост, размножение, иммунитет и др.), способствуют нормальВнному обмену в организме витаминов и минеральных солей. Белки участвуют в образовании энергии, особенно в период больших энергетических затрат или при недостаВнточном количестве в питании углеводов и жиров. Энергетическая ценность 1 г белка составляет 4 ккал (16,7 кДж).
При недостатке белков в организме возникают серьезВнные нарушения: замедление роста и развития детей, изменения в печени взрослых, деятельности желез внуВнтренней секреции, состава крови, ослабление умственной деятельности, снижение работоспособности и сопротивВнляемости к инфекционным заболеваниям.
Белок в организме человека образуется беспрерывно из аминокислот, поступающих в клетки в результате переваривания белка пищи. Для синтеза белка человека необходим белок пищи в определенном количестве и опВнределенного аминокислотного состава. В настоящее вреВнмя известно более 80 аминокислот, из которых 22 наиВнболее распространены в пищевых продуктах. АминокисВнлоты по биологической ценности делят на незаменимые и заменимые.
Незаменимы восемь аминокислот тАФ лизин, триптофан, метионин, лейцин, изолейцин, валин, треонин, фенилаланин; для детей нужен также гистидин. Эти аминокислоты в организме не синтезируются и должны обязательно поступать с пищей в определенном соотношении, т. е. сбалансированными. Особенно ценны незаменимые амиВннокислоты триптофан, лизин, метионин, содержащиеся в основном в продуктах животного происхождения, соотВнношение которых в пищевом рационе должно составлять 1:3:3.
Заменимые аминокислоты (аргинин, цистин, тирозин, аланин, серин и др.) могут синтезироваться в организме человека.
Пищевая ценность белка зависит от содержания и сбалансированности незаменимых аминокислот. Чем больше в нем незаменимых аминокислот, тем он ценней. Источниками полноценного белка являются мясо, рыба, молочные продукты, яйца, бобовые (особенно соя), овВнсяная и рисовая крупы.
Суточная норма потребления белка 1,2тАФ1,6 г на 1 кг массы человека, т. е всего 57тАФ118 г в зависимости от пола, возраста и характера труда человека. Белки животВнного происхождения должны составлять 55 % суточной нормы. Кроме того, при составлении рациона питания следует учитывать сбалансированность аминокислотного состава пищи. Наиболее благоприятный аминокислотный состав представлен в сочетании таких продуктов, как хлеб и каша с молоком, пирожки с мясом, пельмени.
1 Обмен белков
Биологическое значение и специфичность белков. Белки являются основным веществом, из которого построена протоплазма клеток и межВнклеточные вещества. Жизнь тАФ есть форма существования белковых тел (Ф. Энгельс). Без белков нет и не может быть жизни. Все ферменты, без которых не могут протекать обменные процессы, являются белковыми телами. С белковыми телами тАФ миозином и актином тАФ связаны явления мышечного сокращения. Переносчиками кислорода в крови являются пигменты белковой природы, у высших животных тАФ гемоглобин, а у низших тАФ хлорокруорин и гемоцианин. Белку плазмы, фибриногену, кровь обязана своей способностью к свертыванию. С некоторыми белкоВнвыми веществами плазмы, так называемыми антителами, связаны иммунВнные свойства организма. Одно из белковых веществ сетчатки тАФ зрительВнный пурпур, или родопсин тАФ повышает чувствительность сетчатки глаза к восприятию света. Нуклеопротеиды ядерные и цитоплазматические принимают существенное участие в процессах роста и размножения. С участием белковых тел связаны явления возбуждения и его распростраВннения. Среди гормонов, участвующих в регуляции физиологических функций, имеется ряд веществ белковой природы.
Строение белков отличается большой сложностью. При гидролизе кислотами, щелочами и протеолитическими ферментами белок расщепВнляется до аминокислот, общее число которых более двадцати пяти. Помимо аминокислот, в состав различных белков входят и многие другие компоненты (фосфорная кислота, углеводные группы, липоидные группы, специальные группировки).
Белки отличаются высокой специфичностью. В каждом организме и в каждой ткани имеются белки, отличные от белков, входящих в состав других организмов и других тканей. Высокая специфичность белков может быть выявлена при помощи следующей биологической пробы. Если ввести в кровь животного белок другого животного или растительВнный белок, то организм отвечает на это общей реакцией, заключающейся в изменении деятельности ряда органов и в повышении температуры. При этом в организме образуются специальные защитные ферменты, споВнсобные расщеплять введенный в него чужеродный белок.
Парэнтеральное (т. е. минуя пищеварительный тракт) ввеВндение чужеродного белка делает животное через некоторый промежуток времени чрезвычайно чувствительным к повторному введению этого белка. Так, если морской свинке парэнтерально ввести небольшое количество (1 мг и даже меньше) чужеродного белка (сывороточные белки других животВнных, яичные белки и т. д.), то через 10тАФ12 дней (инкубационный период) повторное введение нескольких миллиграммов этого же самого белка вызывает бурную реакцию организма морской свинки. Реакция проВнявляется в судорогах, рвоте, кишечных кровоизлияниях, понижении кроВнвяного давления, расстройстве дыхания, параличах. В результате этих расстройств животное может погибнуть. Такая повышенная чувствительВнность к чужеродному белку получила название анафилаксии (Ш. Рише, 1902), а описанная выше реакция организма тАФ анафилакВнтического шока. Значительно большая доза чужеродного белка, вводимая первый раз или до истечения инкубационного срока, не вызыВнвает анафилактического шока. Повышение чувствительности организма к тому или иному воздействию называется сенсибилизацией. Сенсибилизация организма, вызванная парентеральным введением чужеВнродного белка, сохраняется в течение многих месяцев и даже лет. Она может быть устранена, если ввести этот же белок повторно до истечения срока инкубационного периода.
Явление анафилаксии наблюдается и у людей в форме так называемой Влсывороточной болезниВ» при повторном введении лечебных сывороток.
Высокая специфичность белков понятна, если учесть, что путем различного комбинирования аминокислот возможно образование бесВнчисленного количества белков с различным сочетанием аминокислот. Расщепление белков в кишечнике обеспечивает не только возможность их всасывания, но и снабжение организма продуктами для синтеза своих собственных специфических белков.
Основное значение белков заключается в том, что за их счет строятся клетки и межклеточное вещество и синтезируются вещества, принимающие участие в регуляции физиологических функций. В известной мере белки, однако, наряду с углеводами и жирами, используются и для покрытия энергетических затрат.
1.1 Промежуточный обмен белков
Белки в пищеварительном канале подвергаются расщеплению протеолитическими ферментами (пепсином, трипсином, химотрипсином, полипептидазами и дипептидазами) вплоть до образования аминокислот. Поступившие из кишечника в кровь амиВннокислоты разносятся по всему организму и из них в тканях синтезируются белки.
Как показали исследования с применением тяжелого изотопа азота (N18), в теле все время происходит перестройка белковых тел с выхождением из них и обратным включением в их состав аминокислот. Белки тела находятся в состоянии постоянного обмена с теми аминокислотами, которые находятся в составе небелковой фракции. В теле происходят также превращения одних аминокислот в другие. К числу таких превраВнщений относится переаминирование, заключающееся в переносе аминоВнгруппы с аминокислот на кетокислоты (А. Е. Браунштейн и М. Г. Крицман). При окислительном распаде аминокислот прежде всего происходит дезаминирование. Аммиак, отщепляющийся в качестве одного из конечВнных продуктов белкового обмена, у высших животных в значительной своей части подвергается дальнейшему превращению в мочевину. У челоВнвека азот мочевины составляет в среднем 85% всего азота мочи.
У птиц и рептилий главным конечным продуктом обмена белков является не мочевина, а мочевая кислота. Даже введенная в организм мочевина превращается в организме птиц в мочевую кислоту. Такая особенность азотистого обмена связана с тем, что эмбриональный период жизни птиц протекает в замкнутом пространстве, внутри яйца. Мочевая кислота обладает очень низкой растворимостью и слабо прониВнкает через животные перепонки. Поэтому накопление в полости аллантоиса и эмбриоВннов такого продукта азотистого обмена, как мочевая кислота, не приносит вреда эмбрионам.
У млекопитающих мочевая кислота также является одним из конечВнных продуктов, выводимых с мочой. Она образуется только из пуриновых тел, которые входят в состав нуклеопротеидов и нуклеотидов, являюВнщихся коферментами некоторых ферментативных систем.
У собак мочевая кислота подвергается дальнейшему расщеплению, и конечным продуктом обмена пуринових тел у них является аллантоин.
К числу важных конечных продуктов азотистого обмена относятся также креа-тинин и гиппуровая кислота. Креатинин представляет собой ангидрид креатина. Креатин находится в мышцах и в мозговой ткани в свободном состоянии и в соединеВннии с фосфорной кислотой (фосфокреатин).
Креатинин образуется из фосфокреатинина путем отщепления фосВнфорной кислоты. Количество выводимого с мочой из организма креатинина сравнительно постоянно (1,5 г в суточной моче) и мало зависит от количества белков, принимаемых с пищей. Только при мясной пище, богаВнтой креатином, количество креатинина в моче возрастает.
Гиппуровая кислота синтезируется из бензойной кислоты и гликокола (у собак преимущественно в почках, у большинства животных и у человека преимущественно в печени и в меньших размерах в почках).
Этот синтез, невидимому, направлен на обезвреживание бензойной кислоты. Особенно много образуется гиппуровой кислоты у травоядных животных в связи с тем, что в растительной пище содержатся вещества, превращающиеся _в животном оргаВннизме в бензойную кислоту. Увеличение содержания гиппуровой кислоты в моче наблюдается и у человека при переходе на растительную диету.
Продуктами распада белков, подчас имеющими большое физиологиВнческое значение, являются амины (например, гистамин).
1.2 Роль печени и почек в обмене белков
При протекании крови через печень аминокислоты частично задерживаются в ней и из них синтезиВнруется ВлзапасныйВ» белок, легко потребляемый организмом при ограниченВнном введении белка. Незначительный запас белка, невидимому, может откладываться и в мышцах (А. Я. Данилевский).

Рисунок 1.1 тАУ Схема экк-павловской фистулы.
РЖ тАФ схема хода сосудов до операции; II тАФ экк-павловская фистула. НалоВнжено соустье между воротной веной и нижней полой веной; воротная вена между соустьем и печенью перевязана; РЖРЖРЖ тАФ ВлперевернутаяВ» экк-павловская фистула. После наложения соустья между воротной веной и нижней полой веной последняя перевязана выше соустья тАФ в этом случае развиваются коллатерали между v. porta n v. azygos.
В печени происходит, вероятно, также образование белков. Так, после кровопотерь нормальное содержание альбуминов и глобулинов плазмы крови быстро восстанавливается. Если же функция печени наруВншена отравлением фосфором, то восстановление нормального белкового состава крови чрезвычайно замедлено. Образование альбуминов в печени показано в опытах с ее измельченной тканью. Печень играет центральную роль и в промежуточном белковом обмене. В ней в большом объеме совершаются процессы дезаминирования, а также синтез мочевины. В печени же происходит обезвреживание ряда ядовитых продуктов кишечВнного гниения белка (фенолы, индол). Удаление печени вызывает через некоторое время гибель животного даже при условии повторного ввеВндения глюкозы. Очевидно, это обусловлено отравлением продуктами проВнмежуточного обмена белков, в частности, накоплением аммиака. Очень большую роль в изучении функции печени сыграл метод наложения соустья между венами (фистула Экка-Павлова).
Экк-павловская фистула представляет соустье между воротной веной и нижней полой веной (рис. 157), причем участок воротной вены вблизи печени перевязывается. В результате такой операции кровь, оттекающая от кишечника и поступающая в воротную вену, не может из нее поступать в печень, а изливается в нижнюю полую вену, минуя печень. Такая опеВнрация сохраняет печень жизнеспособной, так как последняя снабжается кровью через печеночную артерию. Но при этом исключается возможность задержки печенью токсических веществ, всасываемых кишечником. Впервые эта трудная операция была осуществлена Н. В. Экком в лабораВнтории И. Р. Тараханова. Однако сохранять в живых собак с таким свиВнщом Экку не удалось. И. П. Павлов в 1892 г. прооперировал около 60 соВнбак, причем около трети их остались живыми и были подвергнуты изуВнчению. Биохимическая часть исследований была проведена М. В. Ненцким и его сотрудниками. Оказалось, что собаки с экк-павловской фистулой могут жить в течение значительного срока, если только их пища содержит мало белка. При белковой пище, в частности, при даче собакам большого количества мяса, происходит отравление организма ядовитыми продуктами распада белков. Животное становится возбужденным, координация движений нарушается, наступают судороги и затем смерть. В крови при этом обнаруживается повышенное содержание аммиака. Органом, принимающим значительное участие в белковом обмене, являются почки. В почках происходит отщепление аммиака от аминоВнкислот, причем отщепляющийся аммиак идет на нейтрализацию кислот. Последние в форме аммонийных солей выделяются с мочой.
Через почки происходит освобождение организма от образовавшихся азотистых конечных продуктов белкового обмена (мочевина, креатинин, мочевая кислота, гиппуровая кислота, аммиак). При нарушении функВнции почек в результате их заболевания происходит задержка всех этих продуктов в тканях и в крови, что приводит к накоплению небелкового (так называемого остаточного) азота в крови (азотемия и уремия). Если накопление азотсодержащих продуктов обмена в крови прогрессирует, то человек погибает.
1.3 Обмен сложных белков
Нуклеопротеиды принимают участие в явлеВнниях роста и размножения. В тканях, не увеличивающих уже своей массы, роль нуклеопротеидов, по-видимому, сводится к участию в воспроизВнведении белковых веществ ткани. Обмен цитоплазматических нуклеопроВнтеидов (рибонуклеопротеидов) происходит интенсивнее, чем обмен ядерных нуклеопротеидов, дезоксирибонуклеопротеидов. Так, скорость обновления фосфора в рибонуклеиновой кислоте печени в ЗО раз, а в рибонуклеиВнновой кислоте мозга в 10 раз больше, чем в дезоксирибонуклеиновой кислоте этих тканей. Об обмене нуклеопротеидов в организме челоВнвека судят по выведению пуриновых тел, в частности, мочевой кислоты. В обычных условиях питания ее выделяется 0,7 г в сутки. При мясной пище образование ее в организме повышено. При нарушении обмена, выражающемся в заболевании подагрой, трудно растворимая мочеВнвая кислота откладывается в тканях, в частности, в окружности суставов.
В организме непрерывно происходит распад и синтез гемоглобина. При синтезе геминовой группы используется гликокол и уксусная кисВнлота. Необходимо также достаточное поступление в тело железа.
Об интенсивности распада гемоглобина в теле можно получить предВнставление по образованию желчных пигментов, возникновение которых связано с расщеплением порфиринового кольца геминовой группировки и отщеплением железа. Желчные пигменты поступают с желчью в кишечВнник и в толстых кишках подвергаются восстановлению до стеркобилиногена или уробилиногена. Часть уробилиногена теряется с каловыми массами, а часть всасывается в толстых кишках и затем попаВндает в печень, из которой вновь поступает в желчь. При некоторых страдаВнниях печени уробилиноген не задерживается полностью в печени и попаВндает в мочу. Содержащийся в моче уробилиноген в присутствии кислорода окисляется в уробилин, отчего моча темнеет.
1.4 Баланс азотистого обмена
Изучение белкового обмена облегчается тем, что в состав белка входит азот. Содержание азота в различных белВнках колеблется от 14 до 19%, в среднем же составляет 16%. Каждые 16 г азота соответствуют 100 г белка, air азота, следовательно, тАФ 6,25 г белка. Поэтому, изучая азотистый баланс, т. е. колиВнчество азота, введенного с пищей, и количество азота, выведенного из организма, можно охарактеризовать суммарно и белковый обмен. УсвоеВнние азота организмом равно азоту пищи минус азот кала, выведение тАФ количеству азота, выделенного с мочой. Умножая эти количества азота на 6,25, определяют количество потребленного и распавшегося белка. На точности этого метода сказываются потери организмом белков с кожной поверхности (слущивающиеся клетки рогового слоя эпидермиса, отраВнстающие волосы, ногти). Процессы расщепления белков в организме и выведение продуктов обмена, так же как усвоение воспринятых белков, требуют многих часов. Поэтому для определения величины белкового распада в организме необходимо собирать мочу в течение суток, а при ответственных исследованиях тАФ даже в течение многих суток подряд.
Во время роста организма или прироста в весе за счет усвоения увеВнличенного количества белков (например, после голодания, после инфекВнционных болезней и т. д.) количество вводимого с пищей азота больше, чем количество выводимого. Азот задерживается в теле в форме белкового азота. Это обозначается как положительный азотистый баланс. При голодании, при заболеваниях, сопровождающихся больВншим распадом белков, наблюдается превышение выделяемого азота над вводимым, что обозначается как отрицательный азотистый баланс. Когда количество вводимого и выводимого азота одинаково, говорят об азотистом равновесии.
Обмен белка существенно отличается от обмена жиров и углеводов тем, что во взрослом здоровом организме почти не происходит откладыВнвания легко используемого запасного белка. Количество резервного белка, откладываемого в печени, незначительно, и удержания этого белка на длительный срок не происходит. Увеличение общей массы белков в оргаВннизме наблюдается только в период роста, в период восстановления после инфекционных болезней или голодания и в известной мере в период усиленной мышечной тренировки, когда происходит некоторое увелиВнчение общей массы мускулатуры. Во всех остальных случаях избыточное введение белка вызывает увеличение распада белка в организме.
Если поэтому человек, находящийся в состоянии азотистого равновесия, начиВннает принимать с пищей большое количество белков, то количество выводимого с мочой азота также увеличивается. Однако состояние азотистого равновесия на более высоком уровне устанавливается не сразу, а в течение нескольких дней. То же самое происхоВндит, но в обратном порядке, если переходить на более низкий уровень азотистого равноВнвесия. По мере уменьшения количества азота, вводимого с пищей, уменьшается и колиВнчество азота, выводимого с мочой, причем через несколько дней устанавливается равно1 весне на более низком уровне.
В обычных условиях питания азотистое равновесие устанавливается при выделении 14тАФ18 г азота с мочой. При понижении количества белВнков в пище оно может быть установлено и на 8тАФ10 г. Дальнейшее пониВнжение количества белков в пище приводит уже к отрицательному азотиВнстому балансу. То минимальное количество вводимого с пищей белкового азота (6тАФ7 г), при котором еще возможно сохранение азотистого равноВнвесия, называется белковым минимумом. Количество вывоВндимого с мочой азота при белковом голодании зависит от того, вводятся ли другие питательные вещества или нет. Если все энергетические затраты организма могут быть обеспечены за счет других питательных веществ, то количество азота, выводимого с мочой, может быть снижено до 1 г в сутки и даже ниже.
При поступлении в тело белков в количестве меньшем, чем это соответствует белковому минимуму, организм испытывает белковое голодание: потери белков оргаВннизмом восполняются в недостаточной степени. В течение более или менее продолжиВнтельного срока в зависимости от степени голодания отрицательный белковый баланс не грозит опасными последствиями. Описаны наблюдения над Влискусниками голодаВннияВ», которые не принимали пищи, ограничиваясь лишь небольшим количеством воды, в течение 20тАФ50 дней. Однако, если голодание не прекратится, наступает смерть.
При продолжительном общем голодании количество азота, выводиВнмого из организма, в первые дни резко снижается, затем устанавливается на постоянном низком уровне (рис. 158). Опыты на животных показали, что незадолго перед смертью азотистый распад в организме вновь повыВншается. Это обусловлено исчерпанием последних остатков других энерВнгетических ресурсов, в частности, жиров.
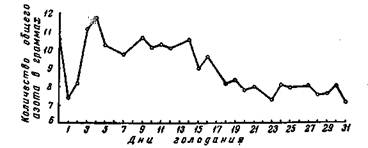
Рисунок 1.2 тАУ Влияние полного голодания на суточное выведение с мочой ваВнлового азота (по Бенедикту).
1.5 Нормы белков в питании
В связи с тем, что при различных услоВнвиях питания минимум может изменяться, а значение больших колиВнчеств белков в пище не выяснено, белковые нормы не являются опредеВнленными. Фойт, исходя из статистических цифр, предложил в качестве суточной нормы 118 г белка. Нормы Читтендена (50тАФ60 г) и Хиндхеде (25тАФ35 г), как показывает большой ряд наблюдений, являются совершенно недостаточными и, как правило, приводят к отрицательному азотистому балансу.
Внимание к минимальным суточным нормам белков за границей является показателем стремления правящих классов в капиталистических странах оправдать наступление на жизненный уровень трудящихся масс, обреченных на полуголодное существование в результате возросшей эксплуатации. Исследования советских ученых (О. П. Молчанова и др.) позволяют считать наиболее обоснованным минимумом 100тАФ120 г белков за сутки. Прием в пищу больших количеств белка для здоровых людей не является вредным.
Следует иметь в виду, что количественные нормы в белковом питаВннии сохраняют свое значение только при условии надлежащего состава пищевых белков. Поступление с пищей ряда аминокислот, синтез которых в животном теле невозможен, является совершенно необходимым для того, чтобы обеспечить синтез белков организма. Напротив, некоторые аминоВнкислоты могут быть синтезированы из других аминокислот и даже из
безазотистых тел и аммиака, и их поступление в организм с пищей не обяВнзательно. Исследования последних лет показали, что число таких аминоВнкислот больше, чем раньше предполагали.
Из приведенных ниже 20 аминокислот жизненно необходимыми для человека являются только 8.
Вместе с этим смотрят:
РЖсторiя виникнення та розвитку масажу
Аборты
Аденовирусная инфекция
Азотные и кислородные ванны, нафталановая нефть
Акушерська операцiя - накладання акушерських щипцiв