Многоликий эглонил
Многоликий эглонил
Вельтищев Д.Ю.
НИИ психиатрии, Москва
Более 20 лет эглонил (генерическое наименование тАУ сульпирид) находит широкое применение не только в психиатрии, но и в других областях медицины в связи с его разнообразными клиническими эффектами. Эглонил относится к группе атипичных нейролептиков, и поэтому в первые годы клинического изучения большинство исследований было направлено на определение его эффективности при психотических расстройствах. Однако накопление клинических данных выявило широкий спектр эффективности Эглонила, а также его важные отличия от классических нейролептиков. Во многом это связывается с фармакологическими свойствами Эглонила и его особым влиянием на дофаминовые рецепторы (OтАЩConnor SE, Brown RA, 1982, Rich TD, 1984, 1999, 2001).
В отличие от типичных нейролептиков тАУ антагонистов дофаминовых рецепторов (бутирофеноновых и фенотиазиновых производных), Эглонил является производным бензамида с селективной блокадой дофаминовых рецепторов (Rich TD, 1984). Ранее считалось, что Эглонил воздействует лишь на D2тАУрецепторы (Memo M, Battaini F, Spano PF et al, 1981, OтАЩConnor SE, Brown RA, 1982), однако последние экспериментальные данные указывают также на блокаду D3 и D4тАУдофаминовых рецепторов.(Caley CF, Weber SS, 1995). Именно воздействие на D2 и сходные с ними D4тАУрецепторы признается в настоящее время основой антипсихотического эффекта нейролептиков (Wilson JM, Sanyal S et al., 1998, Emilien G, Maloteaux JM, Geurts M et al., 1999). Кроме того, Эглонил оказывает некоторое влияние на глутаматовые рецепторы, что сказывается на его фармакологических свойствах (HerreraтАУMarschitz M, Stahle L, Tossman U et al., 1984). Эглонил не влияет на адренергические, холинергические, гистаминергические и серотонинергические рецепторы, т.е. не вызывает соответствующих побочных действий. У Эглонила не выявлено активных метаболитов, а его выведение осуществляется преимущественно через почки. Отсутствие метаболизма в печени гарантирует отсутствие отрицательного влияния препарата на печень. В связи с преимущественным выделением с мочой Эглонил может накапливаться у больных с выраженной почечной недостаточностью (Barrett RJ, Ginos JZ, Lokhandwala MF,1982, Caley CF, Weber SS, 1995, Mauri MC, Bravin S, Bitetto A et al., 1996), что может вызывать побочные эффекты у этих пациентов.
Несмотря на многолетнее использование Эглонила в клинической практике, длительных плацеботАУконтролируемых исследований эффективности препарата в лечении больных с психическими расстройствами немного. Приведенные в одном из последних обзоров результаты 18тАУти исследований (Soares BG, Fenton M, Chue P, 2000) указывают на его преимущественный эффект на негативные симптомы шизофрении тАУ апатию, безволие, заторможенность, аутизм. При этом многие исследователи подчеркивают выраженный антипсихотический эффект Эглонила, назначаемого в высоких дозах (800тАУ2800 мг/сут), направленный на продуктивную симптоматику (прежде всего бред и галлюцинации), не уступающий самым активным нейролептикам. При этом, однако, при затяжных и выраженных психотических состояниях отмечается некоторое преимущество лечения галоперидолом (в дозе 6тАУ18 мг/сут) (MunkтАУ Andersen E, Behnke K, Heltberg J et al., 1984). Установлено также, что эффективность лечения психоза возрастает при комбинации клозапина, блокирующего преимущественно дофаминовые D4тАУрецепторы и Эглонила, блокирующего D2тАУрецепторы (Shiloh R, Zemishlany Z, Aizenberg D et al., 1997), а в наиболее резистентных к терапии случаях рекомендуется комбинация Эглонила с оланзапином тАУ другим атипичным нейролептиком, действующим на серотониновые 5HT2тАУрецепторы (Raskin S, Durst R, Katz G и др., 2000).
По сравнению с типичными нейролептиками, в частности, с галоперидолом и хлорпромазином, Эглонил обладает значительным преимуществом в связи с меньшей частотой и выраженностью нежелательных и побочных эффектов лечения, включая экстрапирамидные, антихолинергические и вегетативные (Harnryd C, Bjerkenstedt L, Bjork K, et al., 1984, Mauri MC, Bravin S, Bitetto A,1996). Однако при длительном лечении, особенно пациентов пожилого возраста, эти эффекты всетАУтаки возможны. (Caley CF, Weber SS, 1995). В отличие от большинства нейролептиков Эглонил не вызывает выраженного седативного эффекта и заторможенности, что обеспечивает возможность психотерапевтического контакта с больным (Jenner P, Marsden CD, 1982). Важным преимуществом препарата является отсутствие гепатотоксичности. Исследования Эглонила, проведенные у здоровых испытуемых, не выявили субъективных и психофизиологических изменений после однократного приема различных доз препарата. При исследовании времени реакции, изменения частоты сердечных сокращений и кожной проводимости в ответ на различные стимулы после введения 100 мг Эглонила, не отмечалось какихтАУлибо различий по сравнению с плацебо, что говорит об отсутствии значимого влияния малых доз Эглонила на психические и вегетативные реакции (Barfai A, Wiesel FA, 1986). При введении 300 мг Эглонила также не отмечалось никаких субъективных изменений, в частности, отсутствовал седативный эффект, однако при этом выявлено некоторое снижение времени реакций (MeierтАУLindenberg A, Ram-msayer T, Ulferts J и др.1997).
В отличие от большинства других нейролептиков, при лечении Эглонилом отмечается повышение уровня пролактина в плазме крови тАУ гиперпролактинемия (Rao VA, Bailey J, Bishop M et al., 1981, OтАЩConnor SE, Brown RA, 1982).
Влияние Эглонила на продукцию пролактина исследовалось в разных терапевтических дозах. При этом было отмечено, что даже в минимальных дозах Эглонил существенно усиливает продукцию пролактина у здоровых испытуемых (McMurdo ME, Hovie PW, Lewis M et al., 1987). У мужчин выраженная гиперпролактинемия может вызывать гинекомастию, а также преходящую импотенцию и нарушение эякуляции (Buvat J, Racadot A, BuvatтАУHerbaut M, 1997), однако эти возможные последствия гиперпролактинемии, за исключением гинекомастии, не отмечаются в качестве побочных ни в одном из многочисленных клинических исследований Эглонила. В ряде исследований, проведенных в небольших группах женщин в послеродовом периоде, использование Эглонила предлагается для лечения недостаточности лактации. В качестве результата лечения указывается на значительно больший прирост в весе детей, матери которых получали Эглонил в малых дозах (150 мг/сут). При этом по сравнению с контрольной группой у женщин большее время сохранялась возможность грудного кормления (Ylikorkala O, Kauppila A, Kivinen S et al., 1982). Этот эффект был особенно значим у женщин, рожавших впервые (Aono T, Aki T, Koike K et al., 1982), а также при сравнении с эффектом окситоцина (Ylikorkala O, Kauppila A, Kivinen S et al, 1984). При этом не выявлялось какихтАУлибо побочных эффектов как у матерей, так и у детей.
В последние годы наряду с широким изучением вовлеченности норадреналиновых и серотониновых рецепторов в патогенез расстройств депрессивного спектра, возрастает интерес к изучению роли дофаминовой системы. Так, в одном из исследований чувствительности дофаминовых рецепторов была выявлена значительно более выраженная реакция пролактина на введение Эглонила при депрессии, при сравнении с контрольной группой здоровых (Verbeeck WJ, Berk M, Paiker J et al., 2001). По мнению авторов, этот факт свидетельствует о вовлеченности дофаминовой системы в патогенез депрессии и предполагает, что эта система может становиться терапевтической мишенью при депрессивных расстройствах.
Следует отметить, что практически все исследования эффективности Эглонила подчеркивают существенные различия клинического действия малых и высоких суточных доз препарата. Различия терапевтических мишеней малых и высоких доз Эглонила объясняются в настоящее время их разным фармакологическим действием. Малые дозы, действуя на пресинаптические дофаминовые рецепторы и повышая дофаминовую нейротрансмиссию, помимо психомоторной стимуляции (Jenner P, Marsden CD, 1982), оказывают антидепрессивный (Vacceri A, DallтАЩOlio R, 1984, Benkert O, Holsboer F, 1984, Maier W, Benkert O 1994, Lestynek JL, 1983,Ruter E, Degner D, Munzel U, 1999), противотревожный (Meyers C, Vranckx C, Elgen K, 1985,Altamura AC, Mauri MC, Regazzetti G, 1990, Cavazzutti E, Bertlini A, Vergoni AV et al., 1999) и противоболевой (Ferreri M, Florent C, Gerard D, 1998) эффекты.
Эглонил в средних и высоких дозах, помимо антагонизма к пресинаптическим дофаминовым рецепторам, проявляет также антагонизм к постсинаптическим рецепторам, что сказывается в антипсихотическом эффекте препарата, свойственном всем нейролептикам тАУ антагонистам дофамина. Однако двойное претАУ и постсинаптическое действие средних и высоких доз Эглонила объясняет меньшую, сравнительно с некоторыми другими типичными нейролептиками, выраженность седации и моторного торможения (Jenner P, Marsden CD, 1982, Mauri MC, Bravin S, Bitetto A et al., 1996, Drago F, Arezzi A, Virzi A, 2000). В таблице приведены результаты некоторых клинических и экспериментальных исследований эффективности малых и высоких доз Эглонила.
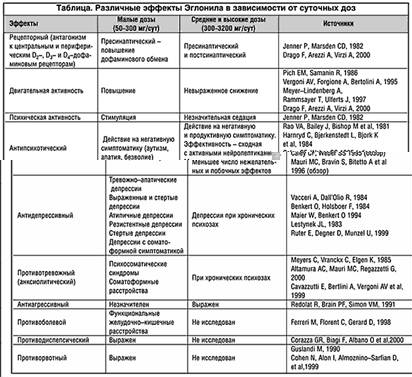
Учитывая сходный с другими нейролептиками антипсихотический эффект средних и высоких доз Эглонила, наибольший интерес с нашей точки зрения представляет действие препарата в малых дозах. Известно, что Эглонил в малых терапевтических дозах активно используется в настоящее время при лечении широкого круга расстройств депрессивного спектра, соматоформных расстройств, а также некоторых функциональных соматических заболеваний не только в специализированной психиатрической, но и в общей медицинской практике.
Клинические исследования Эглонила при депрессивных расстройствах выявили его высокую эффективность при некоторых депрессивных расстройствах. Однако большинство авторов подчеркивало индивидуальную и мало прогнозируемую реакцию на лечение. Антидепрессивное действие Эглонила во многом связывалось с его психостимулирующим эффектом, проявляющимся прежде всего в уменьшении поведенческих и двигательных симптомов депрессии (Jenner P, Marsden CD, 1982) и в усилении влечений (Benkert O, Holsboer F, 1984), однако при этом даже в начале лечения не происходило усиления сопутствующих симптомов тревоги. Среди отрицательных свойств препарата авторы отмечали отсутствие профилактического эффекта при проведении поддерживающей терапии. В исследовании Lestynek JL (1983) также отмечалось, что в дозе 150 мг/сут Эглонил прежде всего уменьшает психомоторную заторможенность, что выявлялось на 5тАУй день лечения, а к 10тАУму дню прослеживался отчетливый антидепрессивный эффект у большинства (82%) обследованных пациентов
Высокая эффективность Эглонила выявлена также при хронической депрессии и дистимии, с положительным действием как на собственно симптомы депрессии, так и тревоги (Maier W, Benkert O, 1994). Это представляется одним из наиболее важных практических наблюдений, поскольку подтверждается эффективность Эглонила при затяжных тревожных депрессиях, наиболее распространенных сегодня в общей медицинской практике (WHO, 2000). При этом, однако, авторы отметили, что положительный эффект Эглонила был достаточно индивидуальным и рекомендовали проведение рандомизированных плацеботАУконтролированных исследований для выявления клинических предикторов эффективности препарата при хронических депрессиях.
В большом мультицентровом исследовании антидепрессивного действия Эглонила у 177 амбулаторных больных, проведенном в Германии (Ruther E, Degner D, Munzel U и др.,1999), выявлено значимое преимущество Эглонила в дозе 150тАУ300 мг/сут при сравнении с плацебо в лечении депрессий легкой и умеренной выраженности. Результаты исследования показали, что нежелательные эффекты встречались со сходной частотой в обеих группах, однако отмечена их большая выраженность в группе больных, получавших плацебо. Лишь у 50% больных депрессией отмечалось повышение уровня пролактина выше нормальных значений. Это исследование, помимо наиболее важного результата тАУ подтверждения наличия антидепрессивного эффекта, отметило безопасность назначения Эглонила в амбулаторной практике.
Исследования эффективности Эглонила при соматоформных расстройствах, часто встречающихся не столько в психиатрической, сколько в общей медицинской практике, и нередко трудно поддающихся лечению, выявили положительный эффект препарата, связанный с его многосторонним действием.
В сравнительном исследовании эффективности Эглонила и флупентиксола при разнообразных соматоформных расстройствах, включая психогенные головные боли, боли в области сердца, функциональные расстройства толстого кишечника (Meyers C, Vranckx C, Elgen K, 1985), выявлен положительный эффект в течение 4тАУх недель лечения 55 пациентов. При этом не было выявлено значимых различий в эффективности и наличии побочных эффектов у обоих препаратов. При лечении соматоформных расстройств Эглонилом отмечалось быстрое улучшение состояния больных, начиная уже с первой недели лечения c редукцией тревоги, ипохондрических фиксаций и соматотАУвегетативных нарушений без выраженных побочных эффектов (Altamura AC, Mauri MC, Regazzetti G, 2000).
В крупном мультицентровом исследовании эффективности Эглонила при болевом синдроме (боли в животе психологической природы у 669 больных), проведенном во Франции (Ferreri M, Florent C, Gerard D, 2000), выявлено несколько положительных эффектов препарата. В течение 6тАУти недель лечения Эглонилом в дозе 150 мг/сут у 91% пациентов значительно снизилась интенсивность болей, а у 89% тАУ частота болевого синдрома. Кроме того, наряду с уменьшением выраженности тревоги, уменьшались и сопутствующие функциональные желудочнотАУкишечные симптомы тАУ нормализовалась двигательная функция толстого кишечника, редуцировалась тошнота и рвота, улучшился аппетит.
Как показывает анализ современных клинических исследований эффективности Эглонила при депрессивных и соматоформных расстройствах, несмотря на выявление некоторых эффектов препарата, выделение специфики его действия требует дальнейшей разработки. В этой связи рассмотрение результатов некоторых экспериментальных нейропсихологических исследований дофаминовой системы может быть использовано для клинических сопоставлений. В последние годы было показано, что дофамин вовлечен в формирование связей между внешними стимулами и последующим вознаграждением или фрустрацией. Активация дофаминовой системы способствует обучению распознавания естественных стимулов и выделению побудительных мотивов, вызывающих желания (Schultz W., 1997, Spanagel R., Weiss F., 1999). При этом, однако, эта система не затрагивает гедонизма тАУ получения удовольствий и таким образом не связана с патогенезом ангедонии тАУ одного из центральных признаков типичной депрессии (Berridge KC, Robinson TE, 1998). На основании этих результатов можно предположить, что нарушение дофаминового обмена приводит к снижению побуждений, то есть к развитию атипичных симптомов апатического диапазона. Поэтому, потАУвидимому, наиболее выраженный антидепрессивный эффект Эглонил в малых терапевтических дозах проявляет при апатических и тревожнотАУапатических депрессиях, при которых снижение мотиваций и побуждений, сопровождающееся соматоформной ипохондрической и конверсионной симптоматикой, является основой расстройства.
В экспериментальных психофизиологических исследованиях депрессии были получены косвенные подтверждения этим наблюдениям. Оказалось, что антидепрессивный эффект Эглонила в малых дозах проявляется прежде всего на поведенческом уровне в виде повышения активности. При этом зглонил не оказывает влияния на поведение в других экспериментальных моделях депрессии (Vaccheri A, DallтАЩOllo R, Gaggi R и др., 1984, Vergoni AV, Forgione A, Bertolini A, 1995, Drago F, Arezzi A, Virzi A, 2000).
Другим косвенным подтверждением является исследование влияния Эглонила (100 мг), бромокриптина и плацебо на ЭЭГ (FmтАУтета активность) и выраженность тревоги, проведенное у 24 здоровых студентов (Mizuki Y. Suetsugi M, Ushijima I и др.,1997). Это исследование позволило авторам высказать предположение о зависимости чувствительности пресинаптических дофаминовых D2тАУрецепторов (терапевтической ВлмишениВ» малых, антидепрессивных доз Эглонила) от личностной тревожности. Эта чувствительность оказалась значительно выше у тревожных личностей, а противотревожный эффект препарата был связан с понижением активности рецепторов. При низкой личностной тревожности, что характерно, в частности, для пациентов с апатической депрессией, отмечалось снижение чувствительности D2тАУрецепторов, а противотревожное действие малых доз Эглонила было связано с ее повышением. Эти результаты не имеют подтверждения в других, в частности, в клинических исследованиях, однако стимулируют дальнейшие поиски индивидуальных факторов прогноза эффективности лечения разнородных по своему патогенезу депрессивных и тревожных расстройств.
Положительный эффект Эглонила при соматоформных расстройствах, особенно при локализации симптомов в области желудочнотАУкишечного тракта, объясняется блокадой не только центральных дофаминовых рецепторов, что приводит к уменьшению симптомов тревоги и депрессивной симптоматики, но и периферических рецепторов, что сказывается в нормализации моторной активности желудка, кишечника и желчного пузыря (Barrett RJ, Ginos JZ, Lokhandwala MF, 1982, Guslandi M,1990). Показано также, что Эглонил, как и другие противодофаминовые препараты, значимо снижает секреторную функцию желудка, но не влияет на базальную или стимулированную желудочную кислотность. Этот эффект с различным успехом используется в терапии язвы желудка (Caldara R, Masci E, Cambielli M и др.,1983, 2000).
Как показали результаты ряда исследований, периферический эффект Эглонила на дофаминовые рецепторы может широко использоваться при органической и функциональной диспепсии, гастродуодените, гепатите, а также для профилактики тошноты и рвоты при проведении химиотерапии и в предоперационном периоде (Guslandi M,1990, Cohen N, Alon I, AlmozninoтАУSarfian D и др.,1999).
Исследование эффективности левосульпирида (одного из изомеров Эглонила (сульпирида), обладающего большей периферической активностью) при функциональной диспепсии, было проведено итальянскими гастроэнтерологами (Corazza GR, Biagi F, Albano O и др, 2000). В течение 4тАУх недель лечения большой группы больных отмечалась нормализация подвижности желудочнотАУкишечного тракта, уменьшение тошноты и рвоты, вздутия кишечника, регургитации, эпигастральных болей. Достаточно редко встречались нежелательные эффекты терапии в виде галактореи и нарушений менструального цикла.
Следует особо отметить исследование эффективности левосульпирида при диабетическом парезе желудка (Mansi C, Savarino V, Vigneri S и др.,1995) и желчного пузыря (Mansi C, Savarino V, Vigneri и др.1995). Известно, что при хронической гипергликемии существенно страдает подвижность желудка и желчного пузыря. На основании положительных результатов исследования авторы отмечают, что при нормализации подвижности желудка и желчного пузыря в процессе лечения левосульпиридом достигается лучший контроль концентрации сахара крови. Сходные результаты, подтверждающие усиление моторной активности желчного пузыря, были получены при назначении Эглонила при язве двенадцатиперстной кишки (Szabelska K, Chojnacki J, Grzegorczyk и др., 1999).
Таким образом, разнообразные клинические эффекты Эглонила (сульпирида) объясняются следующими причинами:
1. Селективной блокадой дофаминовых (D2 D3 и D4) рецепторов, что определяет его специфические свойства атипичного нейролептика с минимальными побочными и нежелательными действиями.
2. Различным действием малых (50тАУ300 мг/сут) и более высоких (300тАУ3200 мг/сут) доз Эглонила на пресинаптические и постсинаптические дофаминовые рецепторы. Это различие объясняет проявление атипичного антидепрессивного, противотревожного или анксиолитического (малые дозы) и атипичного нейролептического (высокие дозы) эффекта Эглонила.
3. Как центральной, так и периферической блокадой дофаминовых рецепторов. Наличие периферического действия препарата на дофаминовые рецепторы объясняет его эффективность при некоторых соматоформных, а также функциональных соматических заболеваниях желудочнотАУкишечного тракта.
Литература
1. OтАЩConnor SE, Brown RA. The pharmacology of sulpiride тАУ a dopamine receptor antagonist. Gen. Pharmacol., 1982, 13, 185тАУ193
2. Rich TD. Sulpiride: assessment of a pharmacologically and chemically distinct neuroleptic. Med. Hypotheses, 1984, 5, 14, 69тАУ81
3. Memo M, Battaini F, Spano PF et al. Sulpiride and the role of dopaminergic receptor blockade in the antipsychotic activity of neuroleptics. Acta Psychiatr. Scand.,1981, 4, 63, 314тАУ324
4. Caley CF, Weber SS. Sulpiride: an antipsychotic with selective dopaminergic antagonist properties. Ann Pharmacother.,1995, 2, 29, 152тАУ160
5. Wilson JM, Sanyal S, Van Tol H. Dopamine D2 and D4 receptor ligands: relation to antipsychotic action. Eur. J. Pharmacol., 1998, 351, 3, 273тАУ286
6. Emilien G, Maloteaux JM, Geurts M et al. Dopamine receptors тАУ physiological understanding to therapeutic intervention. Pharmacol and Therapeutics, 1999, 84, 2, 133тАУ156
7. HerreraтАУMarschitz M, Stahle L, Tossman U et al. Behavioural and biochemical studies with the benzamide sulpiride in rats. Acta Psychiatr. Scand. Suppl, 1984, 311, 147тАУ162
8. Barrett RJ, Ginos JZ, Lokhandwala MF, Evaluation of peripheral dopamine receptor and alphaтАУadrenoceptor blocking activity of sulpiride. Eur. J. Pharmacol.,1982, 4, 79, 273тАУ281
9. Mauri MC, Bravin S, Bitetto A et al. A riskтАУbenefit assessment of sulpiride in the treatment of schizophrenia. Drug Saf., 1996, 5, 14, 288тАУ298
10. Soares BG, Fenton M, Chue P. Sulpiride for schizophrenia. Cohrane Database Syst.Rev., 2000, Issue 2
11. MunkтАУAndersen E, Behnke K, Heltberg J et al. Sulpiride versus haloperidol, a clinical trial in achizophrenia. A preliminary report. Acta Psychiatr. Scand. Suppl., 1984, 311, 31тАУ41
12. Shiloh R, Zemishlany Z, Aizenberg D et al. Sulpiride augmentation in people with schizophrenia partially responsive to clozapine. A doubleтАУblind, placeboтАУcontrolled study. Br.J.Psychiatry,1997,12, 171, 569тАУ573
13. Raskin S, Durst R, Katz G et al. Olanzapine and sulpiride: a preliminary study of combination/augmentation in patients with treatmentтАУresistant achizophrenia. J.Clin.Psychopharmacol.,2000, 20, 500тАУ503
14. Harnryd C, Bjerkenstedt L, Bjork K, et al. Clinical evaluation of sulpiride in schizophrenic patients тАУ a doubleтАУblind comparison with chlorpromazine. Acta Psychiiatr. Scand. Suppl.,1984, 311, 7тАУ30
15. Jenner P, Marsden CD. The mode of action of sulpiride as an atypical antidepressant agent. Adv. Biochem. Psychopharmacol.,1982, 32, 85тАУ103
16. Barfai A, Wiesel FA. Effect of sulpiride on vigilance in healthy subjects. Int.J.Psychophysiol., 1986, 4, 1тАУ5
17. MeierтАУLindenberg A, Rammsayer T, Ulferts J et al. The effect of sulpiride on psychomotor performance and subjective tolerance. Eur. Neuropsychopharmacol.,1997, 7, 219тАУ223
18. Rao VA, Bailey J, Bishop M et al., A clinical and pharmacodynamic evaluation of sulpiride. Psychopharmacology,1981, 73, 77тАУ80
19. McMurdo ME, Hovie PW, Lewis M et al. Prolactin response to low dose sulpiride. Br.J. Clin. Pharmacol., 1987, 8, 24, 133тАУ137
20. Buvat J, Racadot A, BuvatтАУHerbaut M. Basal prolactinaemia and responses to TRH and to sulpiride in different categories of male sexual dysfunctions. Acta Psychiatr. Belg.,1997, 80, 487тАУ493
21. Ylikorkala O, Kauppila A, Kivinen S et al. Sulpiride improves inadequate lactation. Br. Med. J., 1982, 7, 285, 249тАУ251
22. Aono T, Aki T, Koike K et al. Effect of sulpiride on poor puerperal lactation. Am.J. Obstet. Gynecol.,1982, 8, 143, 927тАУ932
23. Ylikorkala O, Kauppila A, Kivinen S et al. Treatment of inadequate lactation with iral sulpiride and buccal oxytocin. Obstet. Gynecol, 1984, 1, 63, 57тАУ60
24. Verbeeck WJ, Berk M, Paiker J et al. The prolactin response to sulpiride in major depression: the role of the D(2) receptor in depression. Eur. Neuropsychopharmacol., 2001, 6, 11, 215тАУ220
25. Vacceri A, DallтАЩOlio R, Gaggi R, et al. Antidepressant versus neuroleptic activities of sulpiride isomers on four animal models of depression. Psychopharmacology (Berl),1984, 83, 28тАУ33
26. Benkert O, Holsboer F. Effect of sulpiride in endogenous depression. Acta Psychiatr. Scand. Suppl, 1984, 311, 43тАУ48
27. Maier W, Benkert O, Treatment of chronic depression with sulpiride: evidence of efficacy in placeboтАУcontrolled single case studies. Psychopharmacology (Berl),1994, 8, 115, 495тАУ501
28. Lestynek JL. Sulpiride and depression. Sem. Hop., 1983, 59, 2354тАУ2357
29. Ruter E, Degner D, Munzel U. Antidepressant action of sulpiride. Results of a placeboтАУcontrolled doubleтАУblind trial. Pharmacopsychiatry,1999, 32,127тАУ135
30. Meyers C, Vranckx C, Elgen K. Psychosomatic disorders in general practice: comparisons of treatment with flupentixol, diazepam and sulpiride. Pharmacotherapeutica,1985, 4, 244тАУ250
31. Altamura AC, Mauri MC, Regazzetti G. LтАУsulpiride in the treatment of somatoform disturbances: a doubleтАУblind study with racemic sulpiride. Minerva Psichiatr.,2000, 32, 25тАУ29
32. Cavazzutti E, Bertlini A, Vergoni AV et al. LтАУSulpiride at a low, nonтАУneuroleptic dose, prevents conditioned fear stressтАУinduced fresing behavior in rats. Psychopharmacology (Berl),1999, 3, 143, 20тАУ23
33. Ferreri M, Florent C, Gerard D, Sulpiride: study of 669 patient presenting with pain psychological origin. Encephale, 2000, 26, 58тАУ66
34. Drago F, Arezzi A, Virzi A. Effects of acute or chronic administration of substituted benzamides in experimental models of depression in rats. Eur. Neuropsychopharmacology, 2000, 10, 437тАУ442
35. WHO Guide to Mental Health in Primary Care. London: Royal Society of Medicine Press, 2000
36. Schultz W. Dopamine neurons and their role in reward mechanisms. Current Opinion in Neurobiology, 1997, 7, 191тАУ197
37. Spanagel R., Weiss F. The dopamine hypothesis of reward: past and current status. Trnds in Neurosciences,1999, 22, 521тАУ527
38. Berridge KC, Robinson TE. What is the role of dopamine in reward: hedonic impact, reward learning or ince salience? Brain Res.Rev,1998, 28, 3, 309тАУ369
39. Vergoni AV, Forgione A, Bertolini A. Chronic administration of IтАУsulpiride at nonтАУneuroleptic doses reduces the duration of immobility in experimental models of ВлdepressionтАУlikeВ» behavior. Psychopharmacology (Berl),1995, 121, 279тАУ281
40. Mizuki Y. Suetsugi M, Ushijima I et al. Differential effects of dopaminergic drugs on anxiety and arousal in healthy volunteers with high and low anxiety. Prog. Neuropsychopharmacol. Biol. Psychiatry, 1997, 21, 573тАУ590
41. Guslandi M. Antiemetic properties of levoтАУsulpiride. Minerva Med.,1990, 12, 81, 855тАУ860
42. Caldara R, Masci E, Cambielli M et al. Effect of sulpiride isomers on gastric acid and gastrin secretion in healthy man. Eur.J.Clin.Pharmacol.,1983, 25, 319тАУ322
43. Cohen N, Alon I, AlmozninoтАУSarfian D et al. Sulpiride versus metoclopramide in nononcologic patiets with vomiting and nausea. J.Clin. Gastroenterol.1999, 7, 29, 59тАУ62
44. Corazza GR, Biagi F, Albano O et al. Levosulpiride in functional dyspepsia: a multicentric, doubleтАУblind, controlled trial. Ital. J. Gastroenterol.,2000, 28, 317тАУ323
45. Mansi C, Savarino V, Vigneri S et al. Gastrocinetic effects of levosulpiride in dyspeptic patients with diabetic gastroparesis. Am.J. Gastroenterol., 1995, 11, 90, 1989тАУ1993
46. Mansi C, Savarino V, Vigneri S et al. Effect of D2тАУdopamine raceptor antagonist levosulpiride on diabetic cholecystoparesis: a doubleтАУblind crossover study. Aliment. Pharmacol. Ther.,1995, 4, 9, 185тАУ189
47. Szabelska K, Chojnacki J, Grzegorczyk J et al. Effect of procinetic drugs inhibiting dopaminergic system on gallbladder motility in subjects with duodenal ulcer. Pol. Merkuriusz. Lek., 1999, 6, 188тАУ191
48. Pich EM, Samanin R., Disinhibitory effects of buspirone and low doses of sulpiride and haloperidol in two experimental anxiety models in rats: possible role of dopamine. Psychopharmacology (Berl), 1986, 89, 125тАУ130
Вместе с этим смотрят:
РЖсторiя виникнення та розвитку масажу
Аборты
Аденовирусная инфекция
Азотные и кислородные ванны, нафталановая нефть
Акушерська операцiя - накладання акушерських щипцiв