Роль эндофрина в нейроэндокринной регуляции функций иммунной системы
На правах рукописи
Гейн Сергей Владимирович
РОЛЬ -ЭНДОРФИНА В НЕЙРОЭНДОКРИННОЙ РЕГУЛЯЦИИ ФУНКЦИЙ ИММУННОЙ СИСТЕМЫ
14.00.36 Аллергология и иммунология
Автореферат диссертации на соискание ученой степени доктора медицинских наук
Пермь - 2007
Работа выполнена в аналитической лаборатории Института экологии и генетики микроорганизмов УрО РАН, Пермь.
Научный консультант:
академик РАН и РАМН, д.м.н., профессор
Черешнев Валерий Александрович
Официальные оппоненты:
доктор медицинских наук, профессор Сибиряк Сергей Владимирович,
доктор медицинских наук, профессор Кузнецов Валериан Фёдорович,
доктор медицинских наук, профессор Юшков Владимир Викторович
Ведущая организация: Институт экспериментальной медицины РАМН, Санкт-Петербург.
Защита состоится Вл__В»__________ 2007 г. в ____ часов на заседании диссертационного совета Д 004.019.01 в Институте экологии и генетики микроорганизмов УрО РАН по адресу: 614081, г. Пермь, ул. Голева, 13. Факс (342)2446711.
С диссертацией можно ознакомиться в библиотеке Института экологии и генетики микроорганизмов УрО РАН, Пермь.
Автореферат разослан Вл___В» _______________2007 г.
Ученый секретарь диссертационного совета,
чл.-корр.РАН Ившина Ирина Борисовна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Поддержание внутреннего гомеостаза определяется взаимодействием нервной, эндокринной и иммунной систем организма. Известно, что иммунная система многокомпонентна, ее функционирование обеспечивается сложной сетью взаимосвязанных сигналов. Одними из важнейших посредников во взаимодействии нервной и иммунной систем выступают эндогенные опиоидные пептиды, представляющие собой группу факторов и играющих ключевую роль в процессах адаптации организма (Корнева, Шхинек, 1988; Зозуля, Пшеничкин, 1990; Корнева, 2007; Maier, 2003; Pruett, 2003; Bodnar, Klein, 2006; Sharp, 2006; Wilbert-Lampen et al., 2007). Несмотря на то, что в последние годы изучению влияния эндогенных опиоидных пептидов на процессы регуляции иммунитета в литературе уделяется достаточно много внимания (Panerai, Sacerdote, 1997; Tomassini et al., 2003, 2004; Sacerdote, 2003), вопрос о механизмах реализации эффектов биорегуляторных пептидов данного класса остается крайне актуальным.
Основной источник опиоидных пептидов в организме - центральная нервная система. Основная группа пептидных гормонов (адренокортикотропный гормон, b-липотропин, меланоцитстимулирующий гормон, b-эндорфин) образуется в результате расщепления большой молекулы тАУ предшественника проопиомеланокортина. При этом наиболее активным и полифункциональным представителем пептидов группы проопиомеланокортина является b-эндорфин. Основной источник b-эндорфина в центральной нервной системе тАУ аркуатное ядро гипоталамуса, на периферии тАУ промежуточная доля гипофиза, из которой пептид секретируется в кровь при стрессе, шоке, травмах и физических нагрузках. b-эндорфин является ключевым фактором, осуществляющим контроль стрессиндуцированных изменений иммунитета со стороны эндогенной опиоидной системы (Зозуля, Пшеничкин, 1990; Pedersen, Hoffman-Goetz, 2000). Роль других соединений из семейства эндогенных опиоидных пептидов, в частности энкефалинов, при стрессе значительно более скромна, а по мнению отдельных авторов (Owens, 1987) вообще отрицается.
Известно (Panerai, Sacerdote, 1997), что изменение концентрации b-эндорфина в головном, спинном мозге и гипофизе часто сочетается с неврологическими и аутоиммунными нарушениями (мигрень, рассеянный склероз, болезнь Крона). Важную роль b-эндорфин играет в патогенезе инфекционных заболеваний, модулируя функции клеток адаптивного и естественного звеньев иммунной системы при их контакте с микроорганизмами и вирусами (Ляшев, 2000; Plotnikoff, 1999; Sitte et al., 2007). В связи с этим изучение роли b-эндорфина в регуляции иммуногенеза представляет большой интерес.
Широкий спектр биологической активности b-эндорфина определяется его способностью взаимодействовать с различными по своей природе сайтами связывания, к которым относятся опиоидные (налоксон-чувствительные) и неопиоидные (налоксон-нечувствительные) рецепторы. Экспрессия опиатных рецепторов трёх основных классов (Вµ, d, k) и неопиоидного рецептора на клетках различных органов и тканей, в том числе и клетках иммунной системы, доказана методами радиолигандного связывания и детекции соответствующей РНК (Наволоцкая и др., 2004; Madden, 1995; Plotnikoff, 1999; Bidlack, 2000; Kraus et al., 2006; Lotsch et al., 2006; Sharp, 2006). Подобное распределение участков связывания b-эндорфина объясняет широкий спектр активности данного пептида и указывает на возможность как прямого, так и опосредованного влияния на формирование иммунного ответа (Зозуля, Пшеничкин 1990; Bidlack, 2000; Stanojević et al., 2006).
Нерешенными остаются вопросы, касающиеся изучения роли эндогенной опиоидной системы в стрессиндуцированных изменениях гуморального и клеточноопосредованного иммунитета; различных рецепторов в регуляции выраженности иммунных процессов, индуцируемых эндогенными опиоидами при стрессе, а также на фоне введения двух основных стрессреализующих факторов тАУ глюкокортикоидов и катехоламинов. Малоизученными остаются молекулярные и клеточные механизмы иммунорегуляторного действия b-эндорфина, связанные с эффектами данного гормона на процессы пролиферации, кооперации и дифференцировки клеток иммунной системы, продукцию ряда ключевых цитокинов (g-IFN, IL-4, IL-10, IL-12), являющихся маркерными для регуляторных Т-лимфоцитов 1 и 2 типа (Th1/Th2) и определяющих выбор типа иммунного ответа. В литературе имеются довольно противоречивые данные о влиянии b-эндорфина на функции клеток естественного иммунного ответа (Van den Bergh et al., 1994; Peterson et al., 1998; Voccarino, Kastin, 2000; Sacerdote, 2003; Bodnar, Klein, 2006).
Цель настоящей работы тАУ изучение роли опиатергических механизмов в нейроэндокринной регуляции иммуногенеза с оценкой эффектов b-эндорфина на процессы пролиферации, дифференцировки и кооперации клеток иммунной системы.
Основные задачи исследования
1. Изучить роль основных компонентов эндогенной опиоидной системы в регуляции процессов иммуногенеза в условиях острого стресса.
2. Исследовать возможность опосредованности иммунорегуляторных эффектов глюкокортикоидов и катехоламинов через взаимодействие с эндогенной опиоидной системой.
3. Оценить влияние b-эндорфина на функции клеток адаптивного иммунитета и исследовать механизм действия пептида на процессы пролиферации, кооперации и Th1/Th2-дифференцировки лимфоцитов.
4. Изучить роль b-эндорфина в регуляции функций клеток естественного иммунитета.
Научная новизна работы. Экспериментально обоснована интегральная роль эндогенной опиоидной системы в нейроэндокринной регуляции иммуногенеза в норме, в условиях стрессорного воздействии и при введении стрессреализующих гормонов тАУ глюкокортикоидов и катехоламинов. Впервые изучено влияние b-эндорфина на процессы активации, пролиферации, кооперации и Th1/Th2-дифференцировки Т-лимфоцитов с оценкой роли различных клеточных фракций. Выявлен характер участия опиатных рецепторов различных типов в регуляции иммунных реакций под воздействием b-эндорфина и синтетических лигандов опиатных рецепоров пептидной природы. В экспериментах in vivo и in vitro подтверждено, что основной мишенью b-эндорфина является гуморальное звено иммунного ответа, при этом выявлена зависимость эффектов b-эндорфина от фазы развития иммунной реакции. В модели пролиферативного ответа лимфоцитов обнаружена зависимость эффекта b-эндорфина и селективных агонистов m- и d-рецепторов от концентрации митогена и концентрации исследуемых пептидов. Выявлена ключевая роль d-рецепторов в реализации стимулирующего эффекта b-эндорфина на пролиферацию и продукцию IL-4. Впервые установлена зависимость стимулирующего эффекта опиоидных пептидов на пролиферацию лимфоцитов и продукцию IL-4 от присутствия моноцитов в клеточной культуре. Обнаружено, что b-эндорфин снижает степень выраженности реакции бласттрансформации лимфоцитов при удалении моноцитов из клеточной культуры. Показано, что b-эндорфин стимулирует фагоцитарную активность эффекторов естественного иммунитета и оказывает модулирующее влияние на цитокинпродуцирующую функцию моноцитов и нейтрофилов. Изучен характер участия опиатных рецепторов в регуляции этих процессов.
Теоретическая и практическая значимость. Полученные данные расширяют представление о роли b-эндорфина и опиатных рецепторов разных типов в регуляции иммуногенеза. Обосновано, что формирование иммунного ответа в норме и при стрессе, а также регуляция адаптивного и естественного иммунного ответа реализуется за счёт механизмов, связанных с синтезом опиоидных пептидов. Выявлен механизм влияния опиоидных пептидов на процессы Th1/Th2-дифференцировки Т-лимфоцитов. Полученные экспериментальные данные подтверждают целесообразность использования иммуномодулирующих свойств b-эндорфина в терапии ряда аутоиммунных заболеваний (рассеянный склероз, болезнь Крона и пр.). В связи с широким использованием агонистов опиатных рецепторов в практической медицине, необходим учет последствий их применения. Результаты работы используются в лекционном курсе ВлЭкспериментальная иммунопатология и иммунотерапияВ» на кафедре микробиологии и иммунологии Пермского государственного университета (614990, Пермь, Букирева 15).
Основные положения, выносимые на защиту
1. В условиях блокады опиатных рецепторов выявляется выраженная модификация иммунорегуляторных эффектов ротационного стресса, глюкокортикоидов и катехоламинов.
2. b-эндорфин в высоких дозах угнетает, в низких - стимулирует гуморальное звено иммунитета, и при этом не влияет на выраженность реакции гиперчувствительности замедленного типа. В клеточных культурах b-эндорфин стимулирует пролиферацию лимфоцитов и продукцию IL-4, не влияет на синтез IL-2 и IFN-g, при этом усиливает степень поляризации Т-хелперов в направлении Th2-клеток. В реализации стимулирующих эффектов b-эндорфина на пролиферацию и продукцию IL-4 доминирующая роль принадлежит d-рецепторам.
3. Клетки моноцитарно-макрофагального ряда играют важную регуляторную роль в направленности эффектов b-эндорфина в отношении функциональной активности CD4+ лимфоцитов.
4. b-эндорфин стимулирует фагоцитарную активность эффекторов естественного иммунитета и оказывает модулирующее влияние на цитокинпродуцирующую функцию моноцитов и нейтрофилов.
Связь работы с крупными программами. Работа проводилась в течение 2000-2007 гг. в соответствии с планом НИР ИЭГМ УрО РАН (номер госрегистрации темы НИР 01.9.009927); в рамках Программы фундаментальных исследований Президиума РАН ВлМолекулярная и клеточная биологияВ»; гранта РФФИ № 06-04-49001, а также грантов молодых учёных Президиума УрО РАН 2003, 2005 гг.
Апробация работы. Материалы диссертации доложены и обсуждены на Международном симпозиуме ВлВзаимодействие нервной и иммунной систем в норме и патологииВ», Санкт-Петербург, 2007; V-VIII конференциях с международным участием ВлДни иммунологии в Санкт-ПетербургеВ», Санкт-Петербург, 2001-2007; ХIХ Российском съезде физиологического общества им. И.П. Павлова с международным участием, Екатеринбург, 2004; VI Международной конференции ВлПроблемы загрязнения окружающей средыВ», Пермь-Казань, 2005; III съезде Российского научного общества иммунологов, Екатеринбург, 2004; I-V конференциях иммунологов Урала, Екатеринбург, 2001; Пермь, 2002; Челябинск, 2003; Уфа, 2005; Оренбург, 2006; I-II конференциях молодых учёных ВлСовременные проблемы микробиологии, иммунологии и экологииВ», Пермь, 1999, 2002.
Публикации. Материалы диссертационной работы обобщены в 46 печатных работах, в том числе 15 экспериментальных статьях и 31 материалах конференций.
Объем и структура работы. Диссертация изложена на 251 странице, содержит 35 таблиц, 49 рисунков и состоит из введения, литературного обзора, описания объектов и методов исследования, 5 глав результатов собственных исследований, обсуждения, выводов, списка цитируемой литературы, включающего 448 наименований, в том числе 124 на русском и 324 на английском языках.
Место проведения работы. Работа является частью исследований, выполняемых в аналитической лаборатории ИЭГМ УрО РАН (зав. тАУ к.г.-м.н. М.А. Шишкин) совместно с лабораторией экологической иммунологии (зав. тАУ к.м.н. Б.А. Бахметьев) по изучению механизмов иммуномодулирующих эффектов гормонов, продукция которых изменяется на фоне экологического воздействия. Исследования по проблеме нейроэндокринной регуляции иммуногенеза были инициированы профессором, заслуженным деятелем науки РФ Н.Н. Кеворковым. Научные положения диссертации и выводы, вытекающие из анализа полученного экспериментального материала, базируются на результатах собственных исследований автора.
Автор выражает искреннюю благодарность М.А. Шишкину, к.х.н. С.П. Тендряковой, профессору М.В. Черешневой, за внимание и моральную поддержку. Автор особо признателен сотрудникам группы радиоизотопных исследований к.б.н. Т.А. Баевой, инженеру Е.Г. Чижовой, магистрантам кафедры микробиологии и иммунологии Пермского государственного университета К.Г. Горшковой и И.Л. Шаравьёвой, способствующим завершению настоящей работы и чей вклад в определённые разделы исследований отражён в приведённых в списке литературы публикациях. Автор благодарит главного специалиста Муниципального управления здравоохранением Ростехнадзора, к.м.н. В.Г. Рыжаенкова за помощь в проведении иммуноферментного анализа.
Глубокую благодарность и признательность автор выражает своим учителям и наставникам академику РАН и РАМН В.А. Черешневу и доценту Ю.И. Шилову, оказавшим большое влияние на выбор целей научного поиска и формирование научного мировоззрения автора.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования. В работе использовали белых беспородных мышей массой 20-22 г и лейкоциты периферической венозной крови, полученной от здоровых людей тАУ добровольцев мужского пола в возрасте 19-35 лет.
Для экспериментального моделирования реакции стресс использовали ротационную модель. Ротация мышей производилась в течение 60 мин по 10 мин с перерывами по 5 мин при 78 об/мин. Роль опиатных рецепторов в постстрессорных изменениях иммунных реакций исследовали путем их блокады налоксоном гидрохлоридом и налтриндолом гидрохлоридом. Налоксона гидрохлорид (DuPont, США) в разовой дозе 0,2 мг/кг массы тела и селективный антагонист d-опиатных рецепторов налтриндола гидрохлорид (ICN, США) в дозе 0,1 мг/кг вводили животным подкожно однократно за 20 мин до ротации (Ашмарин, 1988; Михайлова и др., 1992; Croock et al., 1992). В дальнейших экспериментах в системе in vivo дозы опиатных антогонистов не изменялись. Иммунизацию животных производили через 1 ч после окончания ротации.
При исследовании иммунорегуляторных эффектов опиоидных пептидов in vivo β-эндорфин (Sigma, США) в диапазоне доз от 100 мкг/кг до 0,0005 мкг/кг вводили однократно внутрибрюшинно в объеме 0,2 мл. Контролем для животных, получавших β-эндорфин, служили мыши, которым вводили по той же схеме 0,9% NaCl. μ-агонист DAGO ([d-Ala2,N-Me-Phe4,Gly5-ol]-энкефалин и δ-агонист DADLE ([dтАУAla2,d-Leu5] - энкефалин) (Sigma, США) в диапазоне 10 тАУ 0,0001 мкг/кг вводили по схеме аналогичной введению β-эндорфина. Иммунизацию животных производили через 1 ч после введения опиоидных пептидов.
Гидрокортизона ацетат (Гедеон Рихтер, Венгрия) в дозе 50 мг/кг массы тела вводили однократно внутрибрюшинно. Адреналина гидрохлорид (Московский эндокринный завод, Россия) вводили подкожно однократно в дозе 1 мг/кг. Налоксон и селективный антагонист d-опиатных рецепторов налтриндол вводили подкожно за 20 мин до введения гормонов (3 инъекции через 2,5 ч в группе с гидрокортизоном и 1 инъекция в группе с адреналином). Контролем служили интактные мыши, подвергшиеся иммунизации, но не получавшие препаратов. Дополнительным контролем для животных, получавших гидрокортизон и опиоидные пептиды, служили мыши, получавшие по той же схеме изотонический раствор хлорида натрия. Иммунизацию опытных и контрольных мышей проводили одномоментно через 3 ч от начала эксперимента в группах с гидрокортизоном, через 30 мин - в группах с адреналином.
Для моделирования локального иммунного ответа животных иммунизировали эритроцитами барана (108 клеток вводили подкожно в подошвенную поверхность правой стопы). На 4-е сутки вводили разрешающую дозу антигена (108 клеток). На 5-е сутки оценивали выраженность иммунного воспаления при реакции ГЗТ путём регистрации толщины (инженерным микрометром) и массы (на торсионных весах) опытной и контрольной стопы; количество ядросодержащих клеток (ЯСК); интенсивность антителогенеза методом локального гемолиза в геле агарозы (Jerne, Nordin, 1963). Оценку фагоцитарной активности клеток периферической крови, селезенки, регионарного и отдаленного подколенных лимфатических узлов проводили методом В.Н. Каплина с соавт. (Каплин, 1992, 1996) в модификации (Шилов и др., 1997, 1998).
Нефракционированную клеточную взвесь получали путём отстаивания верхнего слоя плазмы крови с лейкоцитами. Выделение фракции мононуклеаров и нейтрофилов проводили на градиенте плотности фиколл-верографин. Разделение моноцитов и лимфоцитов проводили методом адгезии на чашках Петри. CD4+ Т-клетки выделяли при помощи набора магнитных бус Dynabeads M-450 CD4 (Invitrogen, США). Культивирование клеток проводили в течение 24, 48 и 72 ч в пластиковых 24 и 96-луночных планшетах (Orange Scientific, Бельгия) в соответствии с традиционными методиками с использованием полной питательной среды, приготовленной на основе RPMI 1640 или среды 199 (Биолот, Россия) с добавлением 10 mM HEPES, 2 mM L-глутамина (Sigma, США), 100 мкг/мл гентамицина и 10% эмбриональной телячьей сыворотки (Биолот, Россия) или аутоплазмы во влажной атмосфере с 5% СО2 при 370С.
Пролиферативную активность оценивали по включению 3H-метилтимидина. Радиоактивность проб определяли на жидкостном сцинтилляционном счетчике Guardian (Wallac, Финляндия). Для определения концентрации IL-1β, TNF-a, IL-6, IL-8, IL-1ra, IL-2, IL-4 и IFN-γ в супернатантах культур клеток использовали спектрофотометр Униплан (Пикон, Россия) и иммуноферментные тест-системы производства ООО Протеиновый контур, ООО Цитокин, Санкт-Петербург, Вектор-Бест, Новосибирск. В экспериментах in vitro использовали агонист δ,μ-опиатных рецепторов β-эндорфин в концентрациях 10-7-10-12М; меланотропин потенцирующий фактор (MPF) - фрагмент 88-91 β-липотропина (Lys-Lys-Gly-Glu) в концентрациях 10-7-10-12М; μ-агонист опиатных рецепторов DAGO ([d-Ala2,N-Me-Phe4,Gly5-ol]-энкефалин) в концентрациях 10-7тАУ 10-12М; δ-агонист опиатных рецепторов DADLE ([dтАУAla2,d-Leu5]-энкефалин) в концентрациях 10-7тАУ10-12М; неселективный антагонист опиатных рецепторов налоксона гидрохлорид и селективный антагонист δ-рецепторов налтриндола гидрохлорид в концентрациях 10-6, 10-8, 10-10М; липополисахарид (ЛПС) Escherichia coli O26:B6 - 0,1 мкг/мл (Sigma, США), фитогемагглютинин (ФГА) тАУ 1,25; 2,5; 5,0; 10,0; 20,0 мкг/мл (Sigma, США), диклофенак натрия (ДН) 25 мкг/мл, моноклональные анти-IL-1b антитела тАУ 2 мкг/мл.
Полученные данные обрабатывали с помощью многофакторного дисперсионного анализа для парных данных и корреляционного анализа. Достоверность различий между группами оценивали с помощью t-критерия Стьюдента и критерия Фишера наименьшей значимой разницы. Сортировку и обработку данных проводили на компьютере IBM PC c использованием программ Statistica for Windows 6.0 (Statsoft, Inc., США) и DIASTA (Московский государственный университет, Россия).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Влияние ротационного стресса на показатели иммунитета. Роль опиатных рецепторов. В большинстве опубликованных работ, посвященных изучению влияния стресса на иммунный ответ, исследуются изменения системного иммунного ответа в условиях внутривенной или внутрибрюшинной иммунизации. Принимая во внимание разные компоненты внутрисистемной регуляции общих и локальных форм иммунного ответа, представлялось целесообразным исследование эффектов стресса и блокады опиатных рецепторов в условиях развития локальной формы иммунного ответа.
Как видно из рис. 1, в индуктивную фазу иммунного ответа на фоне стресса наблюдается увеличение числа АОК в лимфатическом узле (ЛУ) и усиление степени выраженности реакции ГЗТ. Блокада δ-опиатных рецепторов приводит к ещё более выраженной активации антителогенеза, в то время как
А Б


В Г
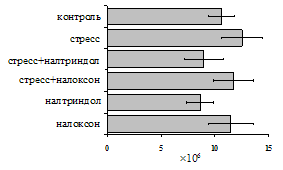
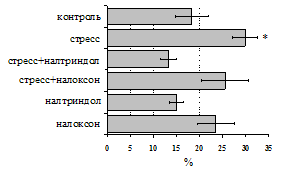
Рис. 1. Влияние ротационного стресса в условиях блокады опиатных рецепторов на абсолютное (А) и относительное (Б) число АОК, количество ЯСК в регионарном лимфатическом узле (В) и выраженность реакции ГЗТ (Г) в индуктивную фазу иммунного ответа. Здесь и на рис. 2: * - p<0,05 к контролю; тАв - p<0,05 к стрессу.
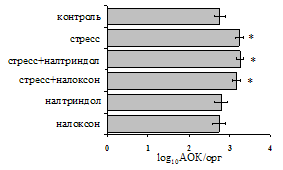
на фоне налоксона стимулирующий эффект ротационного стресса на антителогенез отменяется. Стрессиндуцированное усиление выраженности реакции ГЗТ отменяется как налоксоном, так и налтриндолом. Изолированное введение животным налтриндола или налоксона на количество АОК и степень выраженности ГЗТ влияния не оказывает. В эффекторную фазу иммунного ответа ротационный стресс (рис. 2) стимулирует как клеточный, так и гуморальный ответ, однако, в отличие от индуктивной фазы, на фоне блокады опиатных рецепторов эффекты стресса не модифицируются. Таким образом, стимуляция опиатных рецепторов в индуктивную фазу иммунного ответа играет важную роль в стрессиндуцированных изменениях иммуногенеза и ответственна за активацию функций иммунной системы при стрессе.
Влияние гидрокортизона и адреналина на локальный иммунный ответ в условиях блокады опиатных рецепторов. В процессе развития стрессреакции основные стрессреализующие факторы глюкокортикоиды,
А Б

В Г
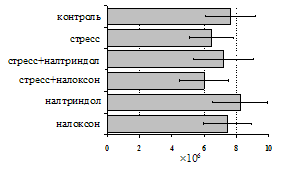
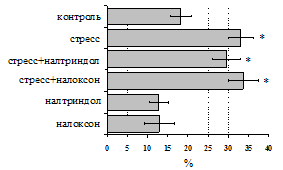
Рис. 2. Влияние ротационного стресса в условиях блокады опиатных рецепторов на абсолютное (А) и относительное (Б) число АОК, количество ЯСК в регионарном лимфатическом узле (В) и выраженность реакции ГЗТ (Г) в эффекторную фазу иммунного ответа.
Таблица 1. Влияние гидрокортизона в условиях блокады m- и d-опиатных рецепторов на число АОК, количество ЯСК в лимфатическом узле и выраженность реакции ГЗТ в индуктивную фазу иммунного ответа
| Экспериментальное воздействие | Лимфатический узел |
ЯСК на орган(´106) | log10 АОК на 106 ЯСК | log10 АОК на орган |
| Интактные животные (контроль), n=19 | 8,93В±1,35 | 2,15В±0,15 | 3,01В±0,17 |
| (142) | (1014) |
| | |
| Физиологический | 7,79В±1,08 | 2,27В±0,16 | 3,10В±0,13 |
| раствор, n=16 | | (186) | (1252) |
| | | |
| Гидрокортизон, n=19 | 4,98В±0,68*# | 1,64В±0,23 | 2,17В±0,25*# |
| | (43) | (149) |
| | | |
| Гидрокортизон | 6,71В±0,75a | 0,96В±0,21*#a | 1,50В±0,31*# |
| +Налоксон, n=15 | | (9) | (32) |
| | | |
| Гидрокортизон | 5,87В±0,71 | 0,55В±0,14*#a | 1,07В±0,22*#a |
| +налтриндол, n=17 | | (4) | (12) |
| | | |
| Налоксон, n=10 | 7,76В±1,27 | 2,24В±0,08 | 3,07В±0,14 |
| | (173) | (1187) |
| | | |
| Налтриндол, n=12 | 8,38В±1,37 | 1,93В±0,11 | 2,79В±0,11 |
| | (86) | (622) |
Примечание. Здесь и в табл. 2, 3, 4 в скобках указана средняя геометрическая числа АОК (антилогарифм из средней арифметической log10 числа АОК). * - p<0,05 к контролю; # - p<0,05 к физиологическому раствору; а - p<0,05 к гидрокортизону по непарному t-критерию Стъюдента.
катехоламины и эндогенные опиоиды находятся в тесной взаимосвязи и оказывают друг на друга взаимное регуляторное влияние (O`Connor, 2000). Как видно из табл. 1, в индуктивную фазу иммунного ответа гидрокортизон снижает количество ядросодержащих клеток в лимфатическом узле и абсолютное число АОК. При введении гидрокортизона на фоне блокады опиатных рецепторов налоксоном и налтриндолом регистрируется отмена индуцированного гидрокортизоном снижения количества ЯСК и ещё более выраженное угнетение антителогенеза по абсолютным и относительным показателям,
Таблица 2. Влияние адреналина в условиях блокады m- и d-опиатных рецепторов на число АОК, количество ЯСК в лимфатическом узле и выраженность реакции ГЗТ в индуктивную фазу иммунного ответа
| Экспериментальное воздействие | Лимфатический узел | |
ЯСК наорган (´106) | log10 АОК на 106 ЯСК | log10 АОК на орган | |
|
| |
Интактные животные (контроль) n=11 | 6,29В±1,04 | 2,43В±0,16 | 3,15В±0,22 | |
| (268) | (1403) | |
| | | |
| Адреналин, n=9 | 5,71В±0,74 | 2,07В±0,14 | 2,79В±0,16 | |
| | (118) | (618) | |
| | | | |
Адреналин | 7,37В±2,08 | 1,94В±0,15* | 2,73В±0,24 | |
| +Налоксон, n=6 | | (86) | (541) | |
| | | | |
| Адреналин | 6,62В±1,30 | 1,78В±0,25* | 2,45В±0,32 | |
| +налтриндол, n=11 | | (60) | (283) | |
| | | | |
| Налоксон, n=10 | 7,76В±1,27 | 2,24В±0,08 | 3,07В±0,14 | |
| | (173) | (1187) | |
| | | | |
| Налтриндол, n=9 | 8,07В±1,82 | 2,08В±1,97 | 2,90В±0,13 | |
| | (121) | (803) | |
особенно ярко проявляющееся в условиях блокады d-рецепторов. Изолированное введение экспериментальным животным налтриндола и налоксона на исследуемые показатели влияния не оказывает. В эффекторную фазу иммунного ответа гидрокортизон угнетает количество ядросодержащих клеток в лимфатическом узле, абсолютное число АОК, однако в отличие от индуктивного периода на фоне блокады опиатных рецепторов эффекты гидрокортизона на показатели клеточности и антителогенеза не модифицируются.
Несколько иная картина наблюдается при анализе эффектов адреналина. Как видно из табл. 2, в индуктивную фазу адреналин оказывает статистически достоверный эффект на антителогенез по относительным показателям (F=5,28; p<0,03), несмотря на то, что при межгрупповом сравнении по отношению к контролю угнетение относительного количества АОК имеет место только при комбинации адреналина с опиатными
Таблица 3. Влияние β-эндорфина
на число АОК, клеточность и выраженность реакции ГЗТ в регионарном лимфатическом узле
| Экспериментальное воздействие (β-эндорфин) | Число живот-ных | Лимфатический узел | Интенсив-ность ГЗТ |
ЯСК на орган (*106) | Log10 АОК на 106 ЯСК | Log10 АОК на Орган | ИР по массе стопы, % В· |
| Контроль | 9 | 4,62В±0,89 | 2,43В±0,10 | 3,04В±0,01 | 17,22В±2,41 |
| | | (271,28) | (1088,94) | |
| 100 мкг/кг | 9 | 4,33В±0,71 | 1,98В±0,22* | 2,57В±0,26* | 19,84В±3,68 |
| | | (95,28) | (370,54) | |
| 10 мкг/кг | 8 | 5,25В±0,70 | 2,06В±0,26 | 2,76В±0,25 | 23,92В±3,46 |
| | | (115,56) | (569,35) | |
| 1 мкг/кг | 9 | 4,87В±1,06 | 2,46В±0,18 | 3,05В±0,16 | 20,25В±4,25 |
| | | (286,09) | (1128,59) | |
| 0,1 мкг/кг | 8 | 7,55В±1,35 | 2,25В±0,18 | 3,08В±0,13 | 18,82В±6,17 |
| | | (117,27) | (1198,91) | |
| 0,01 мкг/кг | 9 | 5,33В±1,13 | 2,68В±0,09 | 3,34В±0,13 | 26,72В±3,88 |
| | | (474,99) | (2192,95) | |
| 0,001 мкг/кг | 8 | 5,90В±1,73 | 2,62В±0,73 | 3,21В±0,13 | 21,27В±4,88 |
| | | (421,49) | (1607,54) | |
| 0,0005 мкг/кг | 9 | 5,82В±0,81 | 2,87В±0,08* | 3,61В±0,07* | 28,72В±4,10 |
| | | (743,72) | (4031,74) | |
Примечание. Здесь и в табл. 4: В· - индекс реакции (ИР): И.Р. = (РотАУРк)/РкВ·100%, где Ро и Рк - показатели массы в опытной и контрольной конечностях. * - p<0,05 к контролю по t-критерию Фишера наименьшей значимой разницы.
антагонистами. В эффекторную фазу иммунного ответа адреналин на антителогенез в лимфатическом узле не влияет. Таким образом, блокада опиатных рецепторов в индуктивную фазу иммунного ответа приводит к существенной модификации иммунорегуляторных эффектов глюкокортикоидов и катехоламинов, связанной с изменениями секреции β-эндорфина в ответ на введение гидрокортизона или адреналина (Mougey et al., 1986; Bagdy et al., 1989; Goodwin et al., 1992).
Влияние β-эндорфина на показатели клеточного и гуморального иммунитета. Степень выраженности эффектов β-эндорфина в системе in vivo
Таблица 4. Влияние β-эндорфина в условиях блокады опиатных рецепторов на число АОК, клеточность и выраженность реакции ГЗТ в регионарном лимфатическом узле в индуктивную фазу иммунного ответа
| Экспериментальное воздействие | Чис-ло жи-во-тных | Лимфатический узел | Интенсив-ность ГЗТ |
ЯСК на орган (´106) | log10 АОК на 106 ЯСК | log10 АОК на орган | ИР по массе стопы, % |
| Контроль | 18 | 5,34В±0,62 | 2,35В±0,10 | 3,02В±0,11 | 22,43В±3,19 |
| | | (223,55) | (1043,31) | |
| β-эндорфин | 18 | 4,71В±0,51 | 1,99В±0,14* | 2,36В±0,15* | 22,16В±2,73 |
| (100 мкг/кг) | | | (98,80) | (423,03) | |
| β-эндорфин | 17 | 5,98В±0,66 | 2,67В±0,07* | 3,40В±0,08* | 27,95В±2,73 |
| (0,0005 мкг/кг) | | | (465,21) | (2519,33) | |
| β-эндорфин | 11 | 5,64В±0,97 | 2,21В±0,14 | 2,87В±0,18 | 23,79В±4,27 |
| (100 мкг/кг) + | | | (161,61) | (747,62) | |
| налоксон | | | | | |
| β-эндорфин | 12 | 5,95В±0,66 | 2,16В±0,12 | 2,90В±0,14 | 28,57В±6,77 |
| (0,0005 мкг/кг) + | | | (143,12) | (798,77) | |
| налоксон | | | | | |
| β-эндорфин | 11 | 7,18В±41,24 | 2,50В±0,07 | 3,29В±0,05* | 23,32В±4,17 |
| (100 мкг/кг) + | | | (314,71) | (1945,42) | |
| налтриндол | | | | | |
| β-эндорфин | 11 | 9,07В±1,24* | 2,52В±0,09 | 3,43В±0,12* | 25,67В±3,12 |
| (0,0005 мкг/кг) + | | | (327,67) | (2673,98) | |
| налтриндол | | | | | |
| Налоксон | 12 | 6,40В±0,73 | 2,23В±0,09 | 3,01В±0,11 | 16,08В±2,02 |
| | | (170,40) | (1013,98) | |
| Налтриндол | 8 | 6,98В±0,55 | 2,04В±0,24 | 2,87В±0,21 | 18,36В±1,92 |
| | | (110,87) | (755,38) | |
Примечание. * - p<0,05 к контролю по непарному t-критерию Стьюдента.
напрямую зависит от вводимой дозы пептида (табл. 3). Пептид оказывает разнонаправленный эффект на гуморальный иммунный ответ, угнетающий в дозе 100 мкг/кг и стимулирующий в дозе 0,0005 мкг/кг образование АОК в регионарном ЛУ. При этом статистически достоверного влияния β-эндорфина на клеточность ЛУ и степень выраженности реакции ГЗТ не обнаруживается. Таким образом, β-эндорфин в системе in vivo в зависимости от дозы как усиливает, так и угнетает образование антителопродуцентов.
Данные о влиянии β-эндорфина на фоне блокады опиатных рецепторов представлены в табл. 4. Блокада рецепторов неселективным антагонистом налоксоном отменяет как угнетающий эффект дозы 100 мкг/кг,
Вместе с этим смотрят:
РЖсторiя виникнення та розвитку масажу
Аборты
Аденовирусная инфекция
Азотные и кислородные ванны, нафталановая нефть
Акушерська операцiя - накладання акушерських щипцiв