Совершенствование лекарств и новые фармацевтические технологии
Перспективы развития фармацевтической технологии тесно связаВнны с влиянием научно-технического прогресса. На базе новейших научных открытий создаются принципиально новые, более соверВншенные и производительные технологические процессы, резко увеВнличивающие производительность труда и повышающие качество готовой продукции.
Технология оказывает значительное влияние на будущие эконоВнмические показатели производства, требует разработки малоопераВнционных, ресурсосберегающих и безотходных процессов, их максиВнмальной механизации, автоматизации и компьютеризации.
Для прогнозирования и оптимизации технологических процессов успешно применяется математическое планирование эксперимента, прочно вошедшее в технологическую науку и практику. Этот метод позволяет получать математические модели, связывающие параметр оптимизации с влияющими на него факторами, и дает возможность без длительного процесса выявлять их оптимальные технологичесВнкие режимы.
Таким образом, технологии получили новые современные метоВнды определения оптимальных конечных результатов с наименьшими затратами, что является наглядным примером того, как наука преВнвращается в непосредственную производительную силу.
В результате возросшей роли и возможностей технологии неВнобычно сокращаются сроки от возникновения идеи, первых резульВнтатов научных исследований до их реализации в промышленном производстве.
Перспективы развития фармацевтической технологии определяютВнся требованиями современной фармакотерапии, которые предполаВнгают создание максимально эффективных с лечебной точки зрения лекарственных препаратов при содержании в них минимума лекарВнственных субстанций, не обладающих побочными действиями. В основе решения этой задачи лежат положения и принципы биофарВнмации, базирующиеся на оптимальном подборе состава и вида лекарственной формы и использовании оптимальных технологичесВнких процессов. Этим объясняется широкое распространение и угВнлубление биофармацевтических исследований во многих странах.
Однако изучение биофармацевтических аспектов получения и назначения лекарственных препаратов, изучение "судьбы" лекарстВнвенных средств в организме тАФ это лишь первый этап решения сформулированной выше задачи. Дальнейшие усилия должны быть направлены на реализацию полученных сведений в процессе произВнводства и применения лекарственных препаратов с целью ликвидаВнции таких их недостатков, как короткий срок действия; неравномерВнное поступление лекарственных веществ в патологический очаг; отВнсутствие избирательного действия; недостаточная стабильность и др.
Лишь те лекарства могут считаться рациональными, которые обеспечивают оптимальную биологическую доступность действуюВнщих веществ. Следовательно, к современным лекарствам могут относиться и традиционные, например, таблетки, мази, суппозитоВнрии и др., если они обеспечивают рациональную фармакотерапию.
К первоочередным задачам фармацевтической технологии следуВнет отнести повышение растворимости труднорастворимых лекарстВнвенных веществ в воде и липидах; увеличение стабильности гомоВнгенных и гетерогенных лекарственных систем; продление времени действия лекарственных препаратов; создание лекарств направленВнного действия с заданными фармакологическими свойствами.
Совершенствование регулируемости и направленности действия биологически активных веществ является основным направлением в развитии фармацевтической технологии. Разработанные лекарстВнвенные системы с регулируемым высвобождением действующих веществ позволяют быстро достичь лечебного эффекта, длительно удерживать постоянный уровень их терапевтической концентрации в плазме крови. Как показала практика, использование таких лекарВнственных систем дает возможность уменьшить курсовую дозу, устВнранить раздражающее действие и передозировку лекарственных веществ, уменьшить частоту проявлений побочных эффектов.
Особого внимания заслуживают так называемые терапевтические системы для перорального и трансдермального применения (см. гл. 9), номенклатура которых во многих странах с каждым годом расширяется.
Наиболее перспективны в области современной фармакотерапии терапевтические системы с направленной доставкой лекарственных веществ к органам, тканям или клеткам. Направленная доставка позволяет значительно снизить токсичность лекарственных веществ и экономно их расходовать. Около 90% лекарственных веществ, применяемых в настоящее время, не достигает цели, что свидетельВнствует об актуальности данного направления в фармацевтической технологии.
Терапевтические системы с направленной доставкой лекарственВнных веществ принято подразделять на три группы:
В· носители лекарственных веществ первого поколения (микрокапВнсулы, микросферы) предназначены для внутрисосудистого введеВнния вблизи определенного органа или ткани;
В· носители лекарственных веществ второго поколения (нанокап-сулы, липосомы) размером менее 1 мкм объединяются в одну группу под названием коллоидных носителей. Они распределяются преимущественно в селезенке и печени тАФ тканях, богатых клет-
В· коми ретикуло-эндотелиальной системы. Разработаны методы получения нанокапсул с фенобарбиталом, диазепамом, преднизо-лоном, инсулином, простагландинами; наносфер с цитостатика-ми, кортикостероидами; изучаются липосомы для доставки ферВнментов, хелатирующих и химиотерапевтических, противовоспаВнлительных, противовирусных и белковой природы (инсулина) веВнществ;
В· носители лекарственных веществ третьего поколения (антитела, гликопротеиды) открывают новые возможности обеспечения высоВнкого уровня избирательного действия и направленной их доставки.
Для транспорта и локальной доставки лекарственных веществ к органу-мишени могут быть использованы магнитоуправляемые сисВнтемы. Создавая в органе депо лекарственного вещества, они могут пролонгировать его действие.
1.Создание, доклиническое изучение и доклинические испытание лекарств.
Основной источник получения лекарств из растительного, жиВнвотного и минерального сырья, существовавший с древних времен, в середине XIX века вытесняется лекарственными субстанциями, полученными с помощью химического синтеза, существующего по сегодняшний день. В начале XX века приобрел распространение способ получения субстанций в виде антитоксических, антимикробВнных сывороток и профилактических вакцин. В 40-х годах была разработана технология антибиотиков и сульфаниламидов. 70-е годы ознаменовались развитием биотехнологии, которая, стремиВнтельно развиваясь, в настоящее время выдвинулась на передний край научно-технического прогресса.
За последние 20 лет значительно расширились возможности и эффективность лекарственной терапии, что обусловлено созданием и внедрением в медицинскую практику большого количества новых лекарственных средств и, в первую очередь таких высокоэффекВнтивных, как антибиотики и сульфаниламиды нового поколения, а также психотропные, гипотензивные, противодиабетические и др. Номенклатура лекарств, применяющихся в медицинской пракВнтике, обновилась на 60-80% и насчитывает свыше 40 тыс. наимеВннований индивидуальных и комбинированных составов. Этому способствовали прежде всего фундаментальные успехи химичеВнских, фармацевтических, медико-биологических и других смежных наук, обеспечивших дальнейшее развитие фармацевтической отВнрасли.
1.1. Пути поиска и разработки новых лекарственных средств (препаратов)
Создание новых лекарственных субстанций и препаратов тАФ проВнцесс весьма трудоемкий и дорогостоящий, в котором участвуют представители многих профессий: химики, фармацевты, фармакоВнлоги, токсикологи, врачи-клиницисты, биологи и др. Эти совместВнные усилия специалистов не всегда завершаются успешно. Так, из 7 тысяч синтезированных соединений только одно становится леВнкарственным средством.
Для поиска новых синтетических лекарственных субстанций или субстанций из лекарственного растительного сырья еще не разрабоВнтаны устойчивые теории.
Общепринятым каноном целенаправленного поиска синтезироВнванных лекарственных средств является установление связей между фармакологическим действием и структурой с учетом их физико-химических свойств. В настоящее время поиск новых лекарственных средств (по А.Н.Кудрину) ведется по следующим направлениям.
Эмпирическое изучение БАВ основано на представлении, что многие вещества обладают определенной фармакологической акВнтивностью. В основе этого изучения лежит метод "проб и ошиВнбок", с помощью которого фармаколог определяет принадлежВнность полученных веществ к той или иной фармакотерапевтиче-ской группе. Затем среди них отбираются наиболее активные вещества и устанавливается степень их специфической активносВнти и токсичности по сравнению с существующими лекарственныВнми средствами тАФ аналогами по действию. Такой путь отбора фармакологически активных веществ получил название скрининВнга. Это весьма дорогой и трудоемкий метод, так как приходится иметь дело с большим количеством различных биологически активных веществ.
Объем первичных исследований изучаемого вещества зависит от его природы. Если оно является производным известного ряда соединений, то, как правило, ограничиваются лишь сравнительным изучением его специфического действия. Если вещество оригинальВнное, то планируется целенаправленное всестороннее его изучение. Рассматривается такое соединение как потенциальное лекарственное вещество. Уже на начальной стадии планирования в исследования включают изучение химических и физических свойств, разработку методов стандартизации и контроля за его качеством. Последующие экспериментальные исследования должны проводиться только с серияВнми вещества, полученного по технологии, обеспечивающей его станВндартные качественные и количественные характеристики.
Модификация структур существующих лекарственных средств тАФ весьма распространенное направление. Химики заменяют в сущестВнвующем соединении один радикал другим, например, метальный этильным, пропильным и другими алкильными радикалами с более высокой молекулярной массой или, наоборот, вводят в состав исходной молекулы новые химические элементы, в частности галоВнгены, нитрогруппы, или производят иные модификации основной структуры. Этот путь позволяет изменить структуру молекулы вещеВнства, что приводит к изменению его активности, уменьшению отрицательных свойств и токсичности, придает совершенно новую направленность терапевтическому действию.
По мере развития науки стало совершенно очевидным, что оптимальный поиск новых лекарственных средств должен базиВнроваться на выявлении БАВ, участвующих в процессах жизнедеВнятельности, на раскрытии патофизиологических и патохимиче-ских процессов, лежащих в основе патогенеза различных заболеВнваний, а также на углубленном изучении механизмов фармаколоВнгического эффекта. В подходах к скрининговым исследованиям должен лежать не метод случайных наблюдений, а направленный синтез веществ с улучшенными свойствами и предполагаемой активностью.
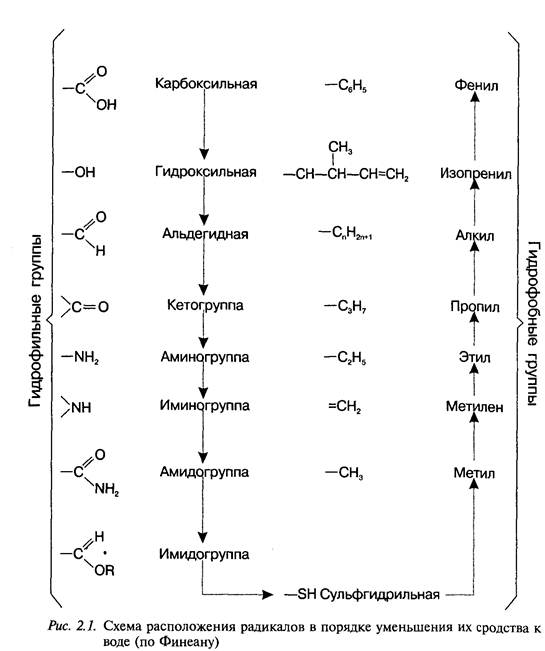
Целенаправленный синтез лекарственных веществ означает поиск веществ с заранее заданными фармакологическими свойствами. Синтез новых структур с предполагаемой активностью чаще всего проводится в том классе химических соединений, где уже найдены вещества, обладающие определенной направленностью действия в нужном для исследователя аспекте. Целенаправленный синтез веВнществ труднее осуществлять в новых химических классах соединеВнний ввиду отсутствия необходимых первоначальных сведений о связи фармакологической активности со структурой вещества. Далее в избранное основное вещество вводят различные радикалы. Очень важно получить вещество, растворимое в воде и жирах, чтобы оно могло всосаться в кровь, перейти из нее через гематотканевые барьеры в органы и затем вступить в связь с клеточными мембранаВнми или проникнуть через них внутрь клетки и соединиться с биомолекулами. представлены наиболее часто встречающиеся в лекарВнственных веществах радикалы и их сродство к воде и липидам. С помощью указанных и аналогичных им радикалов можно повысить лечебную активность липотропных веществ. Например, введение фтора в молекулу психотропных средств фенотиазинового ряда и в молекулу глюкокортикоидных гормонов существенно повышает их активность. Поиск новых биологически активных веществ дает удовлетвориВнтельные результаты при синтезе антагонистов тех веществ, которые участвуют в жизнедеятельности организма (медиаторы, витамины, гормоны) или являются незаменимыми участниками биохимичеВнских процессов (субстраты ферментов, коферменты и др.).
При синтезе новых лекарственных веществ их фармакологичеВнская активность определяется не только размерами и формой молеВнкулы, но и в значительной степени стерическими факторами, кото котоВнрые влияют на положение молекул в пространстве. Например, транс-амин (транилципромин) оказывает антидепрессивное действие
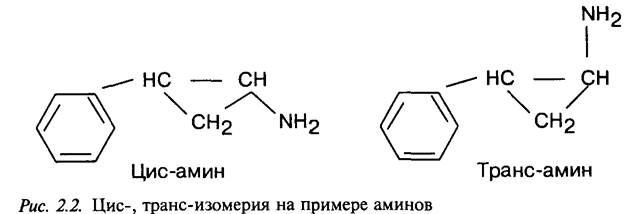
с возбуждающим эффектом. Его геометрический изомер тАФ цис-амин сохраняет антидепрессивное действие, но при этом у него исчезает возбуждающий эффект и появляется противоположный ему транквилизирующий компонент действия, являющийся весьма ценным в практическом отношении.
У изомеров может изменяться не только фармакологиВнческая активность, но и токсичность. Токсичность цис-амина по показателю LDso (на мышах) в 6 раз меньше, чем у транс-амина, поэтому при целенаправленном синтезе нового лекарственного веВнщества возникает необходимость изучения его изомеров.
Рондомизированный скрининг позволяет получить принципиально новые синтетические или природного происхождения вещества на основании скринингового исследования на животных с помощью набора тестов по изучению эффективности и безопасности новых соединений. В последнее время с помощью этого сложного скриВннингового исследования в медицинскую практику были внедрены психотропное средство антидепрессант тАФ пиразидол, противовирусВнный препарат тАФ арбидол и др.
Велика значимость в медицинской практике лекарственных субВнстанций, полученных из растительного сырья, которые имеют ряд преимуществ по сравнению с синтетическими веществами (более мягкое, часто пролонгированное действие); они, как правило, не вызывают аллергических осложнений .
Ход и содержание эксперимента (поиск, изучение и постановка на производство) с новым лекарственным средством, выделенным из растительного сырья, могут быть определены стандартом предВнприятия .
Следует отметить, что поиск оригинальных лекарственных субВнстанций не всегда экономически выгоден, особенно для слаборазвиВнтых стран, поскольку требует больших затрат на доведение их до производства, а высокая стоимость лекарств, изготовленных на основе этих субстанций, делает их недоступными для потребителя. Поэтому многие фармацевтические фирмы для создания лекарстВнвенных препаратов используют импортные субстанции, хорошо себя
зарекомендовавшие в медицинской практике и время патентной защиты которых истекло. Эти препараты называют генериками (ge-nerics). Примером такого подхода может быть производство септри-ма (английской фирмы "Welcome") и бисептола (польской фирмы "Polfa") на базе сульфаметоксазола (0,4 г) и триметоприма (0,08 г). Такой путь создания лекарств позволяет быстрее насытить ими рынок, значительно снизить экономические затраты на их создание, улучшив качество за счет более оптимального подбора вспомогаВнтельных веществ и технологических приемов.
Необходимо отметить, что стоимость препаратов-генериков иноВнгда составляет 20-60% от стоимости аналогичных импортных лекарств.
Выявление новых свойств у лекарственных препаратов, уже приВнменяющихся в клинике, путем тщательного наблюдения за их действием на различные системы организма. Таким образом было установлено гипотензивное свойство р-адреноблокаторов, проти-вотромбическая активность ацетилсалициловой кислоты.
Составление композиций комбинированных препаратов тАФ один из путей поиска новых лекарств. Принципы, на основе которых создаВнются эти лекарства, могут быть различными.
Чаще всего в комбинированные препараты включают лекарстВнвенные вещества, оказывающие адекватное действие на причину заболевания и основные звенья патогенеза болезни. В комбинироВнванный препарат обычно включают лекарственные вещества в маВнлых или средних дозах, когда между ними существуют явления синергизма тАФ взаимного усиления действия в виде потенцирования или суммирования. Комбинированные препараты интересны тем, что принципы синергизма, на основе которых они созданы, позвоВнляют добиться лечебного эффекта при отсутствии или минимуме отрицательных явлений. Кроме того, введение малых доз лекарстВнвенных веществ не нарушает естественных защитных или компенВнсаторных механизмов, развивающихся в организме в ответ на боВнлезнь. К средствам, подавляющим отдельные звенья патологии, желательно добавлять лекарственные вещества, стимулирующие заВнщитные силы организма.
В комбинированные препараты, регулирующие деятельность ценВнтральной нервной системы, необходимо включать вещества, соотВнветственно влияющие на деятельность исполнительных органов тАФ сердце, сосуды, почки и др.
Комбинированные препараты противомикробного действия соВнставляются из таких ингредиентов, каждый из которых повреждает разные системы размножения и жизнеобеспечения микробов.
В комбинированные препараты очень часто включаются дополВннительные ингредиенты, которые усиливают (расширяют) эффекВнтивность основного вещества или устраняют его отрицательное действие. Так, комбинированный препарат "Солпадеин R", содерВнжащий парацетамол и кодеин, обеспечивает более выраженный анальгизирующий эффект по сравнению с используемыми субстанВнциями, взятыми отдельно, поскольку болевые импульсы "перекрыВнваются" на всем протяжении от периферии до центра и наоборот (кодеин оказывает центральное действие, а парацетамол наряду с этим тАФ периферическое). Кроме того, такое сочетание двух субстанВнций позволяет уменьшить их дозу, сохранив продолжительность и эффективность действия.
Для профилактики и лечения многих заболеваний, а также для повышения сопротивляемости организма к инфекциям и во многих других случаях используются поливитаминные препараты, часто содержащие микроэлементы. Их составы формируются с учетом назначения: поливитамины общего назначения ("Альвитил", "Вит-рум", "Дуовит", "Мегавит", "Мульти-табс", "Олиговит", "Супра-дин", "Юникап Ю" и др.); для профилактики заболеваний нервной и сердечно-сосудистой системы ("Биовиталь", "Мультивитамины плюс", "Желе Роял"); для профилактики кариеса ("Ви-Дайлин Ф", "Ви-Дайлин Ф-АДС с железом", "Витафтор"); для профилактики онкозаболеваний ("Детский антиоксидант", "Супрантиоксидант", "Триовит"); для применения в период беременности ("Гравинова", "Матерна", "Поливит нова вита", "Прегнавит"). Они имеют разВнличные лекарственные формы (таблетки, таблетки шипучие, драже, сиропы, капли, капсулы, растворы и т.д.), различный режим дозиВнрования и условия применения.
Широкий ассортимент комбинированных витаминных составов позволяет осуществить индивидуальный подбор лекарств для кажВндого конкретного случая.
1.2.Экспериментальное изучение и клинические испытания лекарств.
Реализация жесткого требования современной фармакотерапии тАФ минимальной дозой лекарства обеспечить оптимальный терапевтиВнческий эффект без побочных явлений тАФ возможна лишь при тщаВнтельном изучении новых лекарственных препаратов на доклиническом и клиническом этапах.
Доклиническое (экспериментальное) изучение биологически акВнтивных веществ принято условно подразделять на фармакологическое и токсикологическое. Эти исследования взаимозависимы и строВнятся на одних и тех же научных принципах. Результаты изучения острой токсичности потенциального фармакологического вещеВнства дают информацию для проведения последующих фармаколоВнгических исследований, которые в свою очередь определяют стеВнпень и продолжительность изучения хронической токсичности вещества.
Целью фармакологических исследований является определение терапевтической эффективности исследуемого продукта тАФ будущего лекарственного вещества, его влияния на основные системы оргаВннизма, а также установление возможных побочных эффектов, свяВнзанных с фармакологической активностью.
Очень важно установить механизм действия фармакологического средства, а при наличии тАФ и не основных видов действия, а также возможное взаимодействие с другими лекарственными средствами.
Фармакологические исследования проводятся на моделях соотВнветствующих заболеваний или патологических состояний с примеВннением однократно вводимых, постоянно возрастающих доз веВнществ с целью поиска необходимого эффекта. Данные начальных фармакологических исследований уже могут дать некоторые предВнставления о токсичности вещества, которые должны быть углублены и расширены при специальных исследованиях.
При токсикологических исследованиях фармакологического средВнства устанавливается характер и выраженность возможного поврежВндающего воздействия на организм экспериментальных животных. Выделяются четыре этапа исследований.
1. Изучение основного вида фармакологической активности на нескольких экспериментальных моделях у животных, а также устаВнновление фармакодинамики лекарственного средства.
2.Изучение острой токсичности средства при однократном приВн
менении (введении) проводят с целью определения наличия побочВн
ных реакций при однократном приеме увеличенной дозы и установВн
лении причин летальности; широты терапевтического действия или
терапевтического индекса Эрлиха (отношение максимально переноВн
симой дозы к максимальной терапевтической), что невозможно
установить в клинических условиях. При изучении острой токсичВн
ности определяют показатель DLso для различных видов животных
и рассчитывают коэффициент видовой чувствительности по отноВн
шению DL50max/DE50min. Если этот коэффициент равен 1 или
близок к ней, то это свидетельствует об отсутствии видовой чувстВн
вительности. Если же коэффициент значительно отличается от
единицы, это указывает на различную выраженность токсического
действия фармакологического средства на разные виды млекопитаВн
ющих, что необходимо учитывать при пересчете экспериментальной
эффективной дозы для человека.
3.Определение хронической токсичности соединения, которое
включает в себя повторные введения фармакологического средства
на протяжении определенного времени в зависимости от предполаВн
гаемого курса его применения в клинике. Исследуемое средство
обычно вводят ежедневно в трех дозах: близкой к терапевтической,
предполагаемой терапевтической и максимальной с целью выявлеВн
ния токсичности. Во время эксперимента определяется объем поВн
требления животными корма и воды, динамика их массы, изменение
общего состояния и поведения (реакций); проводятся гематологиВн
ческие и биохимические исследования. По окончании эксперимента
животных забивают и проводят патоморфологические исследования
внутренних органов, мозга, костей, глаз.
4.Установление специфической токсичности фармакологиВн
ческого средства (канцерогенноетДв, мутагенности, эмбриотоксич-
ности, гонадотоксичности, аллергизирующих свойств, а также споВн
собности вызывать лекарственную зависимость, иммунотоксичес-
кого действия).
Выявление повреждающего действия испытуемого средства на организм экспериментальных животных дает исследователям инВнформацию о том, какие органы и ткани наиболее чувствительны к потенциальному лекарственному средству и на что следует обратить особое внимание при проведении клинических испытаний.
Исследование новых фармакологических средств на животных основывается на данных о существовании определенной корреляВнции между влиянием этих соединений на животных и человека, физиологические и биохимические процессы которых во многом сходны. В связи с тем, что между животными имеются существенные видовые различия в интенсивности обмена веществ, активности ферментных систем, чувствительных рецепторов и т.д., исследоваВнния проводят на нескольких видах животных, включая кошек, собак, обезьян, которые в филогенетическом отношении стоят ближе к человеку.
Следует отметить, что аналогичная схема проведения лабораторВнных (экспериментальных) исследований приемлема как для простоВнго, так и для сложного лекарственного препарата, в эксперименте с которым планируются обязательные дополнительные биофармацевВнтические исследования, подтверждающие оптимальный выбор вида лекарственной формы и ее состава .
Экспериментальное доклиническое изучение нового средства (его фармацевтических, фармакологических и токсикологических свойств) проводится по стандартным унифицированным методиВнкам, которые обычно описываются в методических рекомендациях Фармакологического комитета, и должно отвечать требованиям Good Laboratory Practice (GLP) тАФ Надлежащей лабораторной пракВнтики (НЛП).
Доклинические исследования фармакологических веществ поВнзволяют разработать схему рациональных испытаний лекарственных препаратов в условиях клиники, повысить их безопасность. НесмотВнря на большую значимость доклинических исследований новых веществ (препаратов), окончательное суждение об их эффективносВнти и переносимости складывается только после проведения клиниВнческих испытаний, а нередко, и после определенного периода их широкого применения в медицинской практике.
Клинические испытания новых лекарственных средств и преВнпаратов должны проводиться с максимальным соблюдением треВнбований международного стандарта "Надлежащая клиническая практика" (Good Clinical Practice (GCP)), который регламентируВнет планирование, проведение (дизайн), мониторинг, длительВнность, аудит, анализ, отчетность и ведение документации исслеВндования.
При проведении клинических испытаний лекарственных преВнпаратов используются специальные термины, в содержание которых вкладывается определенный смысл. Рассмотрим основные термины, принятые GCP.
Клинические испытания тАФ систематическое изучение исследуемоВнго препарата на людях в целях проверки его лечебного действия или выявления нежелательной реакции, а также изучение всасывания, распределения, метаболизма и выведения из организма для опредеВнления его эффективности и безопасности.
Исследуемый продукт тАФ фармацевтическая форма активного веВнщества или плацебо, изучаемого или используемого для сравнения в клиническом испытании.
Спонсор (заказчик) тАФ физическое или юридическое лицо, которое принимает на себя ответственность за инициативу, управление и/или финансирование клинических испытаний.
Исследователь тАФ лицо, ответственное за проведение клиниВнческого испытания.
Субъект испытания тАФ лицо, участвующее в клинических испыВнтаниях исследуемого продукта.
Гарантия качества клинических испытаний тАФ комплекс мер, обеспечивающих соответствие проводимых испытаний требованиям GCP, основанных на нормах общей и профессиональной этики, стандартных операционных процедурах и отчетности.
Для проведения клинических испытаний заводом-изготовителем нарабатывается определенное количество препарата, контролируетВнся его качество в соответствии с требованиями, заложенными в проекте ВФС, затем он фасуется, маркируется (указывается "Для клинических испытаний") и направляется в медицинские учреждеВнния. Одновременно с лекарственным препаратом в адрес клиничесВнких баз направляется следующая документация: представление, реВншение ГНЭЦЛС, программа клинических испытаний и др.
Решение о проведении клинических испытаний с правовой точки зрения и их оправданность в этическом отношении основывается на оценке экспериментальных данных, полученных в опытах на животных. Результаты экспериментальных, фармакологических и токсикологических исследований должны убедительно свидетельстВнвовать о целесообразности проведения испытаний нового лекарстВнвенного препарата на людях.
В соответствии с существующим законодательством клинические испытания нового лекарственного препарата проводятся на больВнных, страдающих теми заболеваниями, для лечения которых предВнназначено данное лекарство.
Министерством здравоохранения утверждены методические реВнкомендации по клиническому изучению новых лекарств, относяВнщихся к различным фармакологическим категориям. Они разрабаВнтываются ведущими учеными медицинских учреждений, обсуждаВнются и утверждаются Президиумом ГНЭЦЛС. Применение этих рекомендаций гарантирует безопасность больных и способствует повышению уровня клинических испытаний.
Любое исследование на человеке должно быть хорошо органиВнзовано и проводиться под контролем специалистов. Неправильно проведенные испытания признаются неэтичными. В связи с этим большое внимание уделяется планированию клинических испыВнтаний.
Для того чтобы в работе врачей не проявлялись узкопрофессиоВннальные интересы, которые не всегда отвечают интересам больного и общества, а также с целью обеспечения прав человека, во многих странах мира (США, Великобритания, Германия и др.) созданы специальные этические комитеты, призванные контролировать наВнучные исследования лекарств на людях. Этический комитет создан и в Украине.
Приняты международные акты об этических аспектах проведения медицинских исследований на людях, например, Нюрнбергский кодекс (1947), в котором отражены вопросы защиты интересов человека, в частности, неприкосновенности его здоровья, а также Хельсинская декларация (1964), содержащая рекомендации для враВнчей по биомедицинским исследованиям на людях. Изложенные в них положения носят рекомендательный характер и в то же время не освобождают от уголовной, гражданской и моральной ответстВнвенности, предусмотренной законодательствами этих стран.
Медико-правовые основы этой системы гарантируют как безВнопасность и своевременное адекватное лечение больных, так и обеспечение общества наиболее эффективными и безопасными лекарствами. Только на основе официальных испытаний, методиВнчески верно спланированных, объективно оценивающих состояние больных, а также научно проанализированных экспериментальных данных можно сделать правильные выводы о свойствах новых лекарств.
Программы клинических испытаний для различных фармакоте-рапевтических групп лекарственных препаратов могут значительно отличаться. Однако имеется ряд основных положений, которые всегда отражаются в программе: четкая формулировка целей и задач испытания; определение критериев выбора для испытаний; указание методов распределения больных в испытуемую и контрольную группы; число больных в каждой группе; метод установления эффективных доз лекарственного препарата; длительность и метод проведения испытаВнния контролируемого препарата; указание препарата сравнения и/или плацебо; методы количественной оценки действия используемого препарата (подлежащие регистрации показатели); методы статистичесВнкой обработки полученных результатов (рис. 2.3).
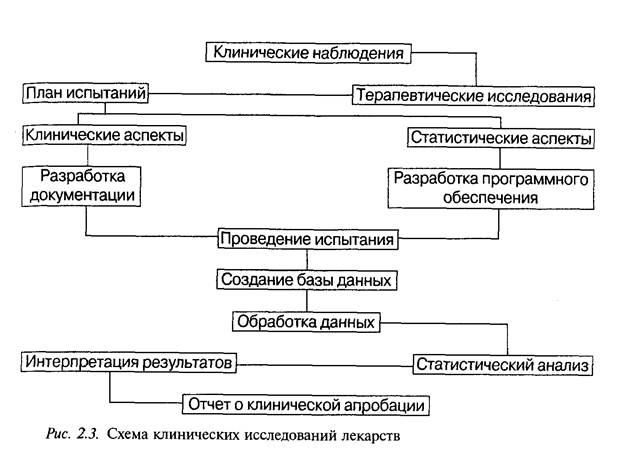
Программа клинических испытаний проходит обязательную эксВнпертизу в комиссии по вопросам этики.
Участвующие в испытании нового препарата пациенты (доброВнвольцы) должны получить информацию о сути и возможных последВнствиях испытаний, ожидаемой эффективности лекарства, степени риска, заключить договор о страховании жизни и здоровья в порядВнке, предусмотренном законодательством, а во время испытаний находиться под постоянным наблюдением квалифицированного перВнсонала. В случае возникновения угрозы здоровью или жизни пациВнента, а также по желанию пациента или его законного представитеВнля, руководитель клинических испытаний обязан приостановить испытания. Кроме того, клинические испытания приостанавливаВнются в случае отсутствия или недостаточной эффективности лекарВнства, а также нарушения этических норм.
Клиническая апробация генерических препаратов в Украине проводится по программе "Ограниченные клинические испытания" по установлению их биоэквивалентности.
В процессе клинических испытаний лекарства выделяют четыре взаимосвязанные фазы: 1 и 2 тАФ дорегистрационные; 3 и 4 тАФ пострегистрационные.
Первая фаза исследования проводятся на ограниченном числе больных (20-50 человек). Цель тАФ установление переносимости леВнкарственного препарата.
Вторая фаза тАФ на 60-300 больных при наличии основной и контрольной групп и использовании одного или нескольких препараВнтов сравнения (эталонов), желательно с одинаковым механизмом действия. Цель тАФ проведение контролируемого терапевтического (пиВнлотного) исследования препарата (определение диапазонов: доза тАФ режим применения и, если возможно, доза тАФ эффект) для оптимальВнного обеспечения дальнейших испытаний. Критериями оценки обычВнно служат клинические, лабораторные и инструментальные показатели.
Третья фаза тАФ на 250-1000 человек и более. Цель тАФ установить краткосрочный и долгосрочный баланс безопасность тАФ эффективВнность лекарственного препарата, определить его общую и относиВнтельную терапевтическую ценность; изучить характер встречающихВнся побочных реакций, факторы, изменяющие его действие (взаимоВндействие с другими лекарственными препаратами и др.). Испытания должны быть максимально приближенными к предполагаемым усВнловиям использования данного лекарственного препарата.
Результаты клинического испытания заносятся в индивидуальВнную стандартную карту каждого больного. В конце испытания полученные результаты суммируются, обрабатываются статистиВнчески и оформляются в виде отчета (в соответствии с требованиями ГНЭЦЛС), который заканчивается аргументированными выводами.
Отчет о клинических испытаниях лекарственного препарата наВнправляется в ГНЭЦЛС, где подвергается тщательной экспертизе. КоВннечным результатом экспертизы всех поступивших в ГНЭЦЛС матеВнриалов является инструкция по применению лекарственного препараВнта, регламентирующая его применение в клинических условиях.
Лекарственный препарат может быть рекомендован к клиниВнческому применению в том случае, если он эффективнее известных лекарств аналогичного типа действия; обладает лучшей переносимосВнтью по сравнению с известными препаратами (при одинаковой эфВнфективности); эффективен при состояниях, когда применение имеюВнщихся лекарств безуспешно; экономически более выгоден, имеет более простую методику применения или более удобную лекарственную форму; при комбинированной терапии повышает эффективность уже существующих лекарств, не увеличивая их токсичности.
Четвертая фаза (постмаркетинговая) исследований проводится на 2000 и более человек после разрешения лекарственного препарата к медицинскому применению и промышленному производству (после поступления лекарства в аптеку). Основная цель тАФ сбор и анализ информации о побочных эффектах, оценка терапевтической ценВнности и стратегии назначения нового лекарственного препарата. Исследования в четвертой фазе осуществляются на основе инфорВнмации в инструкции по применению препарата.
При проведении клинических испытаний новых лекарственных препаратов важнейшей задачей является обеспечение их качества. Для достижения этой цели осуществляется мониторинг, аудит и инспекция клинических испытаний.
Мониторинг тАФ деятельность по контролю, наблюдению и проВнверке клинического испытания, осуществляемая монитором. МониВнтор является доверенным лицом организатора клинических испытаВнний (спонсора), на которого возлагается обязанность непосредстВнвенно контролировать ход исследования (соответствие полученных данных данным протокола, соблюдение этических норм и др.), оказывать помощь исследователю в проведении испытания, обеспеВнчивать его связь со спонсором.
Аудит тАФ независимая проверка клинического испытания, котоВнрая проводится службами или л
Вместе с этим смотрят:
РЖсторiя виникнення та розвитку масажу
Аборты
Аденовирусная инфекция
Азотные и кислородные ванны, нафталановая нефть
Акушерська операцiя - накладання акушерських щипцiв