Хламiдii. Будова та морфологiчнi особливостi
Мiнiстерство освiти та науки Украiни
Нацiональний технiчний унiверситет Украiни ВлКПРЖВ»
Факультет
Курсова робота
з курсу ВлтАжВ»
на тему ВлХламiдii. Будова та морфологiчнi особливостiВ»
Керiвник:
Виконав:
Студент 2-го курсу
Допущений до захисту:
Вл___В»__________2009р
групи
Захищено з оцiнкою:
____________________
Залiкова книжка:
№ тАжтАжтАжтАжтАж.
Киiв-2009
ВСТУП
Хламiдiя - мiкроорганiзм, що займаi промiжне положення мiж бактерiями i вiрусами i що i збудником хламiдiозу.
У природi iснуi два види хламiдiй, але патогенними для людини i тiльки мiкроорганiзми, що вiдносяться до другого вигляду. Основний збудник сечостатевого хламiдiозу - Chlamydia trachomatis серотипiв D-K, проте вiдомо, що венеричний лiмфогрануломатоз i трахома також викликаються рiзновидами Chlamidia trachomatis.
РЖнфекцiiю можуть вражатися будь-якi слизистi оболонки, покритi цилiндровим епiтелiiм. Даний мiкроорганiзм може iснувати як зовнi, так i усерединi клiтини хазяiна, де вiн посилено розмножуiться. Повний цикл розвитку триваi в середньому 2-3 доби, що залежить вiд штаму збудника, особливостей навколишнього середовища i клiтини-хазяiна. Поява нових запалень сприяi посиленню iмунноi вiдповiдi хазяiна, а також ступеню пошкоджень. Chlamidia trachomatis, як i всi внутрiклiтиннi мiкроорганiзми, здатна мiняти захиснi механiзми клiтини-хазяiна.
У деяких випадках iнфекцiя може тривалий час iснувати всерединi клiтини при цьому не розмножуючись. Таку iнфекцiю називають персистентною, як правило, вона нiяк не виявляiться клiнiчно. Персистенцiя i наслiдком впливу зовнiшнiх чинникiв на мiкроорганiзм, тобто вiн знаходиться в таких умовах, при яких нормальне розмноження неможливе.
Хламiдiйна iнфекцiя надзвичайно широко поширена в природi. Вона може виявлятися бiльш нiж в 20 клiнiчних синдромах, приводячи до слiпоти, безплiддя, iнвалiдностi, часто вражаi рiзнi дiлянки органiв сечостатевоi системи. Хламiдii - облiгатнi внутрiшньоклiтиннi паразити, представленi двома формами, що вiдрiзняються, якi володiють загальним груповим антигеном i змiнюють один одного в циклi розвитку збудника . Не дивлячись на те, що данi про внутрiклiтинну локалiзацiю хламiдii з'явилися бiльше 70 рокiв назад, патогенетичнi механiзми iх паразитизму вивченi недостатньо.
Враховуючи особливостi хламiдiй, дiагностика i лiкування захворювань, що викликаються цими мiкроорганiзмами, дещо ускладненi. Проте, використання сучасних методiв дослiдження i новiтнiх лiкарських препаратiв дозволяють визначити всi особливостi збудника i добитися повного одужання.
1. Огляд лiтератури
1.1 Вiдкриття хламiдiй та iсторiя iх вивчення
Вже в XV столiттi до нашоi ери в староiгипетському папiрусi згадуiться ексудативне захворювання очей. Тодi це ж захворювання було вiдомо в Китаi, Грецii i Римi. Ним страждали такi видатнi дiячi, як Цицерон, Горацii, Плинiй - молодший [1].
У 60-i роки нашоi ери сицилiйський лiкар Pedanius Diasсarides для назви цiii хвороби ввiв термiн ВлтрахомаВ», що означаi Влнерiвний, шорсткийВ». Пiзнiше Гален встановив чотири стадii цього захворювання [2].
У 1879 р. був вiдкритий гонокок Neisser. У цей же перiод у новонароджених вiдзначали офтальмiю, яка, як незабаром з'ясувалося, також маi гонококову i негонококову природу. Kroner (1884) припустив, що негонококова офтальмiя, ймовiрно, викликаiться невiдомим мiкроорганiзмом, зараження яким вiдбуваiться в генiтальному трактi породiль.
Такi вiдомi ученi, як Koch, Halberstaedter i Prowazek в 1883-1907 р вiдзначили наявнiсть схожих включень в контАЩюнктивальних мазках у дiтей з негонококовою офтальмiiю. Аналогiчнi включення в клiтках мазкiв, одержаних з шийки матки i уретри батькiв дiтей з природженою офтальмiiю, це i вiдзначав Heyman (1910), але оскiльки у рядi таких випадкiв разом з включеннями виявляли i гонококи, то це приводило до спiрного трактування iх етiологiчнiй ролi. Проте Wahl (1911) стверджував, що гонококовi для поста уретрити (ПГУ) викликаються не гонореiю, а i результатом первинноi змiшаноi iнфекцii, викликаноi i гонококами, i збудниками негонококових уретритiв (НГУ) [3].
Таким чином, протягом декiлькох рокiв були встановленi ключовi епiдемiологiчнi факти генiтального хламiдiозу - його роль в етiологii НГУ i ураження очей у новонароджених, передача статевим шляхом. Подальше вивчення проблеми затримувалось через неможливiсть культивування С. trachomatis в лабораторних умовах.
Bedson, Bland ( 1934) встановили наявнiсть схожостi в життiвих циклах С. psittaci i С. trachomatis. Thygеson, Mengert (1936) припустили, що включення розмiщуються в промiжному епiтелii шийки матки [2].
Спроби видiлення мiкроорганiзмiв з фiльтрату уражень iз застосуванням хорiон-аллантоiсних мембран курячих ембрiонiв були безуспiшнi.
РЖнтерес до цього мiкроорганiзму пожвавило видiлення збудника трахоми TтАЩang i спiвавторами (1957). Для його культивування TтАЩang i спiвавтори застосували заплiдненi курячi яйця. У перших дослiдах захист яiць вiд суперiнфекцii здiйснювали пенiцилiном, але незабаром було вiдмiчено, що вiн несприятливо дii на хламiдii. У цiй же роботi повiдомляiться про наявнiсть у С. trachomatis чутливостi до тетрациклiну i резистентностi до амiноглiкозиду [3].
Знахiдки TтАЩang i його спiвробiтникiв незабаром пiдтвердили i iншi дослiдники, зокрема Collier, Sowa.
РЗх подальшими роботами [Collier, Duke-Elder, Jones, 1958] встановлено, що передача збудника вiд людини до людини викликаi трахому. Послiдували енергiйнi пошуки методiв профiлактики трахоми i боротьби з нею,включаючи спроби одержати вакцину.
Вперше з урогенiтального тракту С. trachomatis видiлили Jones, Collier, Smith (1959), i серiiю проведених ними важливих клiнiчних дослiджень знов були пiдтвердженi основнi епiдемiологiчнi факти, що вiдносяться до хламiдiозу: зв'язок з негонококовими уретритами, передача статевим шляхом, взаiмозв'язок захворювань у дорослих i очних уражень у дiтей.
Великим досягненням стало досягнення Gordon, Quan (1965) метод культивування С. trachomatis на тканинних моношарових середовищах, що включаi центрифугування зразкiв клiнiчного матерiалу, iнкубацiю i забарвлення клiтин для демонстрацii включень. Вiдносна простота методики дозволяi дослiджувати велике число клiнiчних зразкiв, i незабаром було вiдмiчено, що вона чутливiша, чим методика культивування, що ранiше застосовувалася, на жовткових мiшках курячих ембрiонiв. Ця ж група дослiдникiв встановила, що метод можна використовувати для видiлення хламiдiй з генiтального тракту, прямоi кишки, очей i з iнших органiв (Dunlop, Hare et al., 1969). Вони ще раз продемонстрували наявнiсть взаiмозв'язку очних i генiтальних уражень i показали, що збудник видiляiться у чоловiкiв з НГУ i у жiнок, з якими вони знаходилися в статевому контактi.
Труднощi, що виникають при культивуваннi С. trachomatis в лабораторних умовах, привели до необхiдностi пошуку серологiчних методiв. Спочатку застосовувався лише метод комплементифiксацii (КФ) з антигенами пситтакозу або венеричнi лiмфогранулеми. Тест мав недостатню чутливiсть для дiагностики кон'юнктивiту з включеннями. Великi переваги мав метод мiкроiмунофлюорисценсii (МРЖФ), розроблений Wang (1971). Цей метод цiннiший при епiдемiологiчних дослiдженнях [2].
2. Класифiкацiя роду Chlamydia
2.1 Питання класифiкацii
Про природу хламiдiй були рiзнi думки: iх вважали бактерiями, рикетсiями або атиповими вiрусами [1]. Унаслiдок того, що хламiдii неможливо вирощувати на звичайних бактерiологiчних середовищах i в результатi таксономiчноi плутанини, термiнологiя, що вiдноситься до хламiдiозiв, протягом тривалого часу була недосконалою. На думку Page (1966), що iнтенсивно вивчав морфологiю, цитологiю, хiмiчну структуру i метаболiзм цих мiкроорганiзмiв, iх слiд вiднести до бактерiй.
Першi дослiдники трахоми Halberstaedter, Ргоwazek (1907) запропонували для найменування сiмейства термiн Chlamydozoa (вiд грецького chlamys - мантiя, для позначення матриксу навколо елементарних тiлець. Акцентуючи наявнiсть вiдмiнностей мiж рикетсiями i хламiдiями, Jones, Rake, Stearns (1945) вперше запропонували таксометрично обгрунтовану назву Chlamydia.
Мiж 1957 (7-е видання Визначника Bergey i 1975 р. (8-е видання Визначника Bergey) дискусiя велася щодо числа родiв в сiмействi Chlаmуdiacae. Moulder (1964, 1966) роздiлив сiмейство на двi групи:
В· група А - збудники трахоми i супутнiх захворювань;
В· група Б - псiттакози.
Page (1968) запропонував розрiзняти два види в одному родi, а саме С. trachomatis в групi А i С. psittaci в групi Б. У класифiкацii Bergey (8-е видання Визначника), хламiдii за традицiiю все ще вiдносилися до групи рикетсiй, хоча спорiдненiстю вони з ними не зв'язанi. Схожiсть же iх життiвих циклiв, ймовiрно, i результатом конвергентноi еволюцii [2].
До 1980 р. цi бактерii називали бедсонiями, мiягаванеллами, гальпровiями. У 1980 р. в результатi роботи Мiжнародноi Асоцiацii Мiкробiологiчних Суспiльств була дана назва хламiдiя [3].
По сучаснiй класифiкацii хламiдii помiщенi в одну таксономiчну групу з рикетсiями, з якими iх об'iднуi внутрiклiтинний паразитизм [4].
Отже, сучасна класифiкацiя хламiдiй така:
Царство: Бактерii
Тип: Рiккетсii
Вiдряд:Chlamydiales
Сiмейство:Chlamydiaceae
Рiд:Chlamydia
Вид:Ch. trachomatis, Ch. psittaci, Ch. pneumoniae, Ch. pecorum [3].
2.2 Ознаки роду Chlamydia
Хламiдii - своiрiдна таксономiчна група патогенних мiкроорганiзмiв, що володiють схожими антигенними, морфологiчними, бiохiмiчними характеристиками. Вони не можуть вiльно iснувати поза клiтками органiзму господаря, не можуть самостiйно синтезувати такi життiво необхiднi з'iднання, як АТФ, а використовують для цього системи бiоенергетики клiток макроорганiзму.
Хламiдii як бiологiчно своiрiднi "енергетичнi" паразити рiзних клiток-господарiв володiють унiкальним циклом внутрiклiтинного розвитку. Найдрiбнiшi спороподiбнi елементарнi тiльця не мають аналогiв серед бактерiй, фiльтруються через бактерiйнi фiльтри i не ростуть на штучних живильних середовищах. У зв'язку з цим хламiдii кардинально вiдрiзняються вiд всiх iнших бактерiй i тому видiленi в особливий порядок - Chlamidiales, що включаi одне сiмейство- Chlamidiaceas, що мiстить один рiд - Chlamуdiа, хоча ряд бiологiчних ознак i данi електронноi мiкроскопii доводять iх приналежнiсть до грамнегативних.
Рiд Chlamуdia об'iднуi 4 види: C. psittaci, C. trachomatis, C. pneumoniae i C. pecorum (табл.2.1).
Таблиця 2.1- Класифiкацiя хламiдiй [5].
| Рiд | Види | Бiовари | Серовари |
Chlamydia | Chlamуdia trachomatis | Трахома, пара трахома | A, B, Ba, C |
Урогенiтальний хламiдiоз, контАЩюнктивiт i пневмонiя Новонароджених | D, E, F, H, I, J, K |
| Венерична лiмфогранульома (ВЛГ) | L1, L2, L3 |
| Мишача пневмонiя | I |
Chlamydia psittaci | Первиннi патологii тварин | I3 |
Chlamydia pneumoniae | Пневмонiя, ГРЗ, атеросклероз, саркоiдоз, астма | TWAR, AR, KA, CWL |
Chlamydia pecorum | Видiленi вiд хворих тварин | ? |
Таким чином, хламiдii близькi по структурi i хiмiчному складу до класичних бактерiй, але не володiють багатьма метаболiчними механiзмами, необхiдними для самостiйного розмноження. Особливостями хламiдiй i:
Обов'язковий внутрiшньоклiтинний енергозалежний вiд хазяiна паразитизм
Унiкальний цикл розвитку.
Бактерiоподiбнi характеристики хламiдiйноi клiтини:
Збереження морфологiчноi сутi на протязi всього життiвого циклу
Дiлення вегетативних форм
Наявнiсть клiтинноi стiнки
Чутливiсть до ряду антибiотикiв широкого спектру дii
Наявнiсть загального родоспецифiчного антигена.
Все це визначаi самостiйне положення цих мiкроорганiзмiв серед прокарiот [5].
3. Характеристика будови та морфологii представникiв роду Chlamydia
3.1 Морфологiчнi особливостi
Хламiдii i групою прокарiотних мiкроорганiзмiв i мають вид дрiбних грамнегативних кокiв. Добре виднi в не зафарбованому станi при мiкроскопii вологих препаратiв пiд склом за допомогою фазовоконтрастноi оптичноi системи [6]. Це облiгатнi внутрiшньоклiтиннi паразити, представленi двома формами, що вiдрiзняються, i що мають загальний груповий антиген [7].
РЖз-за невеликих розмiрiв i нездатностi виживати на неживих бактерiологiчних середовищах хламiдii вважалися вiрусами. У табл. 3.1. перерахованi характеристики Chlamydia порiвняно з бактерiями, мiкоплазмами i вiрусами.
Таблиця 3.1 - Порiвняльна характеристика хламiдiй, бактерiй, мiкоплазм та вiрусiв [2].
Ознака | Хламiдii | Бактерii | Мiкоплазми | Вiруси |
| Розмiр (500 нм) | + | - | + | + |
| Клiтинна оболонка | + | + | - | - |
| ДНК / РНК | + | + | + | - |
Ядро без обмежувальноi мембрани | + | + | + | - |
| Метаболiзм карбон гiдрату | + | + | + | - |
| Рибосоми 70S | + | + | + | - |
| Еклiпсо-фаза | - | - | - | + |
| Використання нуклеiнових кислот хазяiна | - | - | - | + |
| Бiнарне дiлення | + | + | + | - |
| РЖнгiбiювання антибiотиками | + | + | + | - |
| Рiст на неживих бактерiологiчних середовищах | - | + | + | - |
Двi форми мiкроорганiзмiв, що вiдрiзняються, позначають як елементарнi та iнiцiальнi (або ретикулярнi) тiльця. Елементарнi тiльця i невеликими частинками розмiром близько 300 нм. Це транспортнi форми, високо iнфекцiйнi, адаптованi до виживання в неклiтинному середовищi, не пiддаються дii антибiотикiв [8], при забарвленнi по Гiмзе дають рожево-фiолетовий вiдтiнок. Вони оточенi оболонкою, яка представлена жорсткими тришаровими структурами, аналогiчними клiтинним стiнкам грамнегативних бактерiй, вмiщують нуклеоiд та протопласт, що забезпечуi витривалiсть до факторiв зовнiшнього середовища при переносi вiд клiтини до клiтини [9]. Розмiр iнiцiальних (ретикулярних) тiлець 800-1200 нм, вони мало iнфекцiйнi i i внутрiклiтинними репродуктивними формами, що забарвлюються по Гiмзе в голубуватий колiр. РЖнiцiальнi тiльця, отримали свою назву, оскiльки вони з'являються на самому початку розвитку хламiдiйних включень. Клiтинна оболонка iнiцiальних тiлець тонша i нiжнiша, нiж у елементарних, i тiснiше прилягаi до клiтинноi мембрани. Цей факт маi важливе значення, оскiльки дозволяi здiйснюватися дифузii матерiалу включень, що розвиваються [2]. Елементарнi тiльця мають бiльшу електронну щiльнiсть, нiж ядерний матерiал, я також фiбрилярний нуклеоiд. Промiжнi тiльця тАФ промiжна стадiя мiж елементарними i ретикулярними тiльцями [9]. Форми iх досягають 500-1000 нм i навiть до гiгантських розмiрiв дiаметром 2-3 мкм дiляться бiнарно, або способом внутрiшньоi фрагментацii. Знання про наявнiсть промiжних форм маi практичне значення i важливе при мiкроскопii мазкiв [10]. Життiвий цикл хламiдiй в оптимальних умовах росту в еукарiотичних клiтинах складаi 17-40 год [6].
3.2 Будова бактерiальноi клiтини хламiдiй
3.2.1 Мембрана та внутрiшньоклiтиннi структури
Хламiдii мають досить складну структурну органiзацiю. Зовнiшня мембрана, хiмiчний склад якоi вiдповiдаi складу такоi ж у грамнегативних бактерiй [6], представлена в бiльшостi лiпополiсахаридом (ЛПС ), який вмiщуi детермiнанти родовоi серологiчноi специфiчностi збудника. Вона складаiться iз внутрiшньоi цитоплазматичноi та зовнiшньоi мембран( обидвi i подвiйними, що забезпечуi мiцнiсть клiтинноi стiнки) [4]. В нiй у великiй кiлькостi вмiщуються лiпiди i пептидоглiкан, до складу якого входить н-ацетилмурамова кислота [9]. Антигеннi властивостi хламiдiй визначаються внутрiшньою мембраною [4].
Клiтинна оболонка частинок мiстить лiзин i D-аланiн, але не маi диамiнопiмеловоi кислоти. Дискутабельним i наявнiсть N-ацетилмурамовоi кислоти (ii виявляють тiльки у бактерiй). Структура клiтинноi оболонки iнiцiальних тiлець (РТ) вiдрiзняiться вiд структури елементарних тiлець (ET) тим, що пептидоглiкани не сполученi пептидними мiстками. Можливо, що це збiльшуi проникнiсть аденозинтрифосфату через клiтинну оболонку iнiцiальних тiлець. Передбачаiться, що пептидоглiкан маi iншi функцii, вiдмiннi вiд iнших бактерiй [4]. На вiдмiну вiд мiкоплазм хламiдii не мiстять холестеролу в клiтинних оболонках. Спостерiгаються в значних кiлькостях лiпiдi i карбондигiдратiв, але частка нуклеiнових кислот не велика [2].
Оскiльки хламiдii i облiгатними внутрiклiтинними паразитами, iх внутрiшня будова набагато простiша, нiж у вiльноживучих бактерiй, багато органели зредукованi, або вiдсутнi взагалi. Так головною iх ознакою i вiдсутнiсть мiтохондрiй, i данi бактерii забезпечують своi iснування за рахунок енергii клiтин-хазяiна, тобто, використовують iх АТФ [11].
На вiдмiну вiд вiрусiв, хламiдii мiстять як ДНК (ядерний апарат), так i рибосоми [7]. Геном хламiдii маi невеликий розмiр i складаi не бiльше 15% генома кишковоi палички. Вiн складаiться з хромосоми, що мiстить 1042519 пар основ (58,7% ) i плазмiди, що маi в своiму складi 7493 пара основ. Аналiз генома дозволив видiлити 894 гени, що кодують рiзнi бiлки. Схожiсть з ранiше дослiдженими бiлками iнших бактерiй дозволила визначити функцiональне призначення 604 (68%) кодованих бiлкiв. 35 (4%) бiлкiв були схожi з бiлками, що i у iнших бактерiй. У тих, що залишилися 255 (28%) бiлках послiдовностi були несхожi ранiше вивченi. Аналiз бiлкових послiдовностей показав, що 256 (29%) хламiдiйних бiлкiв групуються в 58 сiмейств в межах генома подiбно до групування бiлкiв у бактерiй з невеликим геномом, таких як мiкоплазми i Haemophilus influenzae [4]. Так само як i в бактерiйних клiтинах, виявлена рибосома 70S, що пiдроздiляiться на компоненти 30S i 50S. Описана наявнiсть вiсiмнадцяти амiнокислот. Важливим моментом, що вiдрiзняi хламiдii вiд вiрусiв, i виявлення циклогексiмiда [Tribby, Friis, Moulder, 1973]. Цей компонент iнгiбуi синтез рибосом в еукарiотних клiтинах, отже, на вiдмiну вiд вiрусiв хламiдii синтезують свiй власний ДНК-протеiн [2].
3.2.2 Антигени
Хламiдii володiють специфiчними антигенами. Один з них - термостабiльний групоспецифiчний тАУ являi собою лiпоглiкопротеiд, iнший - термолабiльний видоспецифiчний антиген [6].
Всi хламiдii мають загальний груповий, родоспецифiчний антиген (лiпополiсахаридний комплекс, реактивною половиною якого i 2-кето-3-дезоксиоктановая кислота), що використовуiться при дiагностицi захворювання iмунофлуоресцентними методами iз специфiчними антитiлами.
Бiлки MOMР (Major Outer Membrane Protein) i OMР-2 (Outer membrane proteins) мiстять видо- i серотипоспецифiчнi епiтоти. Проте в них i також областi з високою схожiстю серед видiв (родоспецифiчнi епiтоти), що зумовлюi можливiсть появи перехресних реакцiй. Основний бiлок клiтинноi мембрани i багатi цистеiнами iншi бiлки зв'язанi дисульфiдними зв'язками. Виявлено п'ять генiв дисульфiзв'язаних iзомераз, що можливо грають роль в реструктуризацii цистеiнбагатих бiлкiв при диференцiацii елементарних тiлець в ретикулярнi. У Сhl. trachomatis виявлено 9 генiв, що кодують поверхневi мембраннi бiлки, у Chlamydia рneumonia -18 [4]. У таблицi 3.2 наведенi пiзнi групи антигенiв у хламiдiй та iхнiй хiмiчний склад:
Таблиця 3.2 - Антигени хламiдiй (по Mardh P., 1990) [4]
Антиген | Хiмiчний склад | Примiтка |
Родоспецифiчний (загальний для всiх видiв хламiдiй: Chlamydia psittaci, Chlamydia trachomatis, Chlamydia pneumoniae) | Лiпосахарид | Три рiзних антигенних домени |
Видоспецифiчний (рiзний для всiх видiв хламiдiй Chlamydia psittaci, Chlamydia trachomatis, Chlamydia pneumoniae) | Бiлки | Бiльше 18 рiзних компонентiв 155 кДа у Chlamydia trachomatis, епiтопи у бiлку 40 кДа, бiлок теплового шоку hsp-60 |
Типоспецифiчний (рiзний для сероварiв Chlamydia trachomatis) | Бiлки | Епiтопи в 40 кДа протеiнiв(МОМР), протеiнiв 30 кДа у серотипiв А и В |
3.2.3 Особливостi поверхневих структур елементарних та ретикулярних тiлець
Ранiше методом скануючоi електронноi мiкроскопii на поверхнi хламiдiй були виявленi куполоподiбнi структури, пронизанi Мiкрофiламентами. Мiкрофiламенти, що виходять з iх центру досягають мембрани включень i пронизують ii. Функцiю цiii структури пов'язують з транспортом живильних речовин вiд еукарiотичних клiтин до паразита. Виявлення в геномi хламiдiй генiв, що кодують апарат для 3 типу секрецii, який зумовлюi вiрулентнiсть грамнегативних бактерiй, дозволив припустити, що це утворення здiйснюi передачу сигналу вiд паразита до еукарiотичних клiтин [4].
Як уже згадувалося, спороподiбна форма (елементарнi тiльця) забезпечуi реалiзацiю механiзму передачi iнфекцii i виживання вигляду в зовнiшньому середовищi [12]. Вегетативна форма (ретикулярнi тiльця) забезпечуi репродукцiю органiзму усерединi клiтин органiзму-хазяiна, але не здатна iнфiкувати iншi клiтки. Цi форми розрiзняються по ультраструктурi i фiзiологiчним потенцiям [13]. На поверхнi очищених елементарних i ретикулярних тiлець збудника менiнгопневмонii (С. psittaci) були описанi своiрiднi трубчастi вiдростки дiаметром 5 - 6 нм i завдовжки 35-40 нм, що начиняються, мабуть, вiд цитоплазматичноi мембрани i що проходять через клiтинну стiнку [14].
На поверхнi деяких елементарних тiлець виявили кiльцеподiбнi структури дiаметром 15-22 нм, що мали свiтлiший центр дiаметром 4-7,5 нм. Вони були розташованi в гексагональнiй упаковцi з вiдстанню мiж центрами 45 нм. РЖнодi на вiдстанi 45 нм один вiд одного зустрiчаються вiдростки дiаметром 3 - 4 нм i завдовжки 10-20 нм.
Цi субодиницi клiтинноi стiнки i характерним елементом поверхнi бiльшостi грамнегативних бактерiй [15].
За розмiром i перiодичнiстю розташування виявленi вiдростки вiдповiдають трубчастим вiдросткам, детально описаним на поверхнi елементарних тiлець збудника мiненгопневмонii. Трубчастi вiдростки завдовжки 35-40 нм i дiаметром 5-6 нм проходять, згiдно моделi Matsumoto [16], через отвори в клiтиннiй стiнцi - ВлрозеткиВ» - i крiпляться до цитоплазматичноi мембрани у областi В-структур - своiрiдних вп'ячування цiii мембрани.
Кiльцеподiбнi структури на поверхнi елементарних тiлець вiдповiдають ВлрозеткамВ». Модель Matsumoto була побудована на пiдставi вивчення за допомогою рiзних методiв (негативного контрастування, заморожування - труять, спецiальних обробок ультратонких зрiзiв очищених препаратiв елементарних тiлець [16].
Трубчастi вiдростки i i у ретикулярних тiлець [15]. У збудника менiнгопневмонii iх дiаметр 10-13 нм. Розмiри розеток: зовнiшнiй дiаметр 17-18 нм, внутрiшнiй 14-15 нм. Максимальне число iх спостерiгаiться через 10 г пiсля зараження L-клiтин ( приблизно 45), а за тим поступово зменшувалося до 20 через 20 г пiсля зараження. Розетки на клiтиннiй стiнцi розташовуються або 1-2 групами, або безладно по всiй поверхнi (особливо для раннiх ретикулярних тiлець).
Роль описаних вiдросткiв в прикрiпленнi хламiдiй поки встановити не вдалося, але на думку Matsumoto вони можуть служити своiрiдним каналом, що зв'язуi цитоплазми хламiдiй i клiтини-хазяiна для транспорту метаболiтiв [13]. Можливо вiдростки елементарних тiлець схожi до фiмбрiй бактерiй.
Отже поверхня клiтинноi стiнки хламiдiй утворена округлими субодиницями дiаметром 4 нм, виявленi вiдростки i кiльцеподiбнi структури, через якi вони проходять, i розташованi вони в гексагональнiй упаковцi.
4. Характеристика метаболiзму та життiвий цикл хламiдiй
4.1 Характеристика метаболiзму хламiдiй
Як вже згадувалось, хламiдii, як енергетичнi паразити живих епiтелiальних клiтин, використовують для свого метаболiзму iх АТФ. В даний час аналiз генома показав, що хламiдii здатнi синтезувати АТФ, хоч i в незначних кiлькостях, шляхом глiколiзу i розщеплювання глiкогену [4].
Як було виявлено Weiss i спiвавт. (1964), у хламiдiй спостерiгаiться анаеробний метаболiзм глюкози, що проходить по шляху пептозофосфату i одного з глiколiтичних шляхiв. Тобто, при додаваннi кофакторiв яких вони потребують, хламiдii можуть метаболiзавати глюкозу, а також пiровиноградну i глутамiнову кислоти [7].
Ця активнiсть здiйснюiться на низькому рiвнi i за цих умов приводить до втрати АТФ i НАД. Система транспорту електронiв вiдсутнiй, хоча обидвi частинки мiстять цитохром С-редуктазу. Макромолекулярний синтез клiтин хазяiна гальмуiться хламiдiями, i високоенергетичнi субстанцii клiток хазяiна переходять на синтез протеiнiв i лiпiдiв хламiдiй. Таким чином, забезпечення мiкроорганiзму метаболiтами здiйснюiться в основному за рахунок життiдiяльностi клiтин хазяiна. Деякi з цих метаболiтiв (iзолейцин) можуть бути iнгiбiторами зростання хламiдiй i, ймовiрно, можуть мати вiдношення до латентноi течii при хламiдiозi [Hatch, 1975] [2].
Як яскравий приклад метаболiчноi активностi хламiдiй i впливу на метаболiзм клiтин хазяiна i дослiдження Харкiвського ПРЖРЖ дерматологii i венерологii на споживання глюкози клiтинами [17]. Дослiди проводили на зараженiй культурi клiтин L-929. Утилiзацiя глюкози iнфiкованою культурою достовiрно вище протягом всього процесу культивування. Оскiльки в iнфiкованiй культурi iнтенсивне зростання клiток не вiдбуваiться, можна припустити, що збiльшення споживання глюкози клiткою пов'язано з цитоплазматичним включенням, що розвиваiться, тобто хламiдiйною iнфекцiiю [18]. Через 5 г пiсля зараження, коли фагосома з елементарних тiлець (ET) перемiщаiться в пластинчастий комплекс i ЕТ перетворюiться на ретикулярнi тiльця (РT) через промiжнi тiльця (PT), споживання глюкози клiтками культури бiльш нiж в 7 разiв вище, норми. Можливо, в цей перiод активiзуються бiосинтетичнi процеси клiтини-хазяiна, продукти яких будуть використанi збудником на побудову включення.
Згiдно з лiтературними даними [19], починаючи з 10-12 г пiсля впровадження збудника i до 36 г РT, зазнаi 10-11 подiлень, при цьому утворюiться пул клiток, що i цитоплазматичним включенням. Звичайно цей процес закiнчуiться до 24 г. Можливо, достовiрне зниження споживання глюкози iнфiкованою клiтиною, яке бiльш нiж в 4 рази вище в порiвняннi з нормою, в цей перiод пов'язано з уповiльненням ii метаболiчнiй активностi при швидкому зростаннi морфологiчних структур збудника.
Можна припустити, що перетворення метаболiчно активних РT в неактивнi ЕТ, як правило, що завершуiться до 48 г, супроводжуiться розкрiпаченням власних метаболiчних процесiв, клiтини, i, як наслiдок, спостерiгаiться тенденцiя до збiльшення споживання глюкози [18].
До 72 г цикл розвитку хламiдiй завершуiться. При мiкроскопуваннi препаратiв спостерiгали зрiлi бочкоподiбнi включення збудника, що займають практично весь об'iм клiтини. Значна частина моношару зруйнована, вмiст глюкози в середовищi збiльшений. РЖ не дивлячись на це, споживання глюкози iнфiкованою клiтиною в цей перiод в 3 рази вищий, норми.
Таким чином встановлено, що споживання глюкози iнфiкованою клiткою впродовж всього циклу розвитку збудника достовiрно вищий, нiж у нормi. Спостерiгаються певнi кореляцiйнi залежностi мiж стадiями розвитку збудника i споживанням глюкози iнфiкованою клiткою.
Також проводилися дослiдження синтезу бiлка в клiтинах хазяiна по активностi трансамiназ. Активнiсть аланiномiнотрансферази (AлT), аспартатаминотранферази (AсT) визначали по методу С. Райтмана, С. Френкеля (1957).
Так, до 24 гактивнiсть обох трансфераз у сферi культивування нормальних клiтин достовiрно збiльшилася (AсT - в 4 рази, АлТ-в 8 разiв) i залишилася на досягнутому рiвнi весь перiод, що залишився. Можна припустити, що iнтенсифiкацiя дiяльностi ферментiв до 24 г культивування пов'язана з посиленим утворенням амiнокислот в ходi реакцiй трансамiнування, якi використовуються як субстрат при синтезi бiлкових молекул в культурi, що активно дiлиться (експоненцiальна фаза зростання). До 72 г розвиток клiтин в культурi виходить на плато. Крiм того, спостерiгаiться деяка тенденцiя до зниження активностi ферментiв [17].
Через 24 г пiсля iнфiкування не було вiдмiчено достовiрних вiдмiнностей мiж активнiстю ферментiв в середовищi культивування нормальних клiтин i в середовищi культивування iнфiкованих клiтин, тодi як у всiх iнших часових iнтервалах активнiсть ферментiв в середовищi культивування iнфiкованих клiтин була достовiрно вища. Вiдносно низька активнiсть ферментiв в середовищi iнкубацii iнфiкованоi культури клiтин через 24 г може свiдчити, про те, що амiнокислоти iнтенсивно включаються в синтез бiлка, i немаi сенсу здiйснювати ширше iх використання для iнших цiлей [18]. Разом з тим в перiод вiд 24 до 48 г культивування активнiсть AлT i AсT збiльшувалася майже в 2 рази, причому в цей перiод вона вища, нiж в нормi, вiдповiдно в 2,9 i 3,5 рази. Це може бути пов'язане з iнтенсифiкацiiю процесу глюконеогенезу в iнфiкованiй культурi. Дiйсно, згiдно з лiтературними даними [19]. саме у цей перiод завершуiться дiлення РT, починаiться iх перетворення в ЕТ, а при мiкроскопуваннi в iнфiкованих клiтках виявили гранули глiкогену. РЖншою причиною такого швидкого зростання активностi ферментiв в середовищi може бути збiльшення проникностi мембран iнфiкованоi клiтки.
До 72 г активнiсть AлT зростаi ще в 2,1 рази, в цей перiод вона вища, нiж в нормi, в 6,7 рази, AсT, вiдповiдно, - в 5,6 рази. У цей перiод закiнчуiться цикл розвитку хламiдiй, клiтини руйнуються i росте вмiст ферменту i середовища [17].
Таким чином, виявленi достовiрнi вiдмiнностi у ферментативнiй активностi клiтин нормальноi i iнфiкованоi культур. Показано, що активнiсть ферментiв в середовищi культивування iнфiкованих клiток збiльшуiться в процесi дослiдження, що корелюi з циклом розвитку збудника [17].
Деякi факти, виявленi в ходi дослiдження, не знайшли свого пояснення у зв'язку з тим, що хламiдii в процесi пристосування до внутрiклiтинного паразитизму виробили унiкальнi структури i бiосинтетичнi механiзми, що не мають аналогiв у iнших бактерiй. Не пояснений той факт, що у хламiдiй не виявлений висококонсервативний ген Ftsz, абсолютно необхiдний для клiтинного дiлення всiх прокарiот, оскiльки вiн вiдповiдальний за утворення клiтинноi перегородки пiд час дiлення клiтки. У хламiдii вiдсутнiй пептидоглiкан - компонент клiтинноi стiнки iснуi як у грампозитивних, так i у грамнегативних бактерiй, але при цьому в геномi мiстяться гени, що кодують бiлки, якi необхiднi для його повного синтезу. Передбачаiться, що пептидоглiкан, що синтезуються, або пептидоглiконовий компонент мають iншi функцii, вiдмiннi вiд iнших бактерiй [4].
4.2 Життiвий цикл хламiдiй всерединi зараженоi клiтини
Зрiлою формою збудника хламiдiозу i спороподiбне ЕТ з дiаметром 250-300 нм, що володii iнфекцiйнiстю i обмеженою метаболiчною активнiстю.
Ретикулярнi тiльця утворюються в процесi розмноження мiкроорганiзму всерединi клiтини-хазяiна, i попередником нового поколiння ЕТ i i вегетативною формою хламiдii. У протилежнiсть ЕТ - вельми лабiльнi, неiнфекцiйнi i володiють вираженою метаболiчною активнiстю. Промiжнi тiльця утворюються на двох стадiях циклу розвитку хламiдiй: на раннiй, при перетвореннi ЕТ в РT, i на пiзнiше, при реорганiзацii РT в ЕТ .
Цикл розмноження хламiдiй - облiгатних внутрiклiтинних паразитiв - реалiзуiться при iх взаiмодii з чутливою клiтиною-хазяiном.
Схематично i спрощено основнi морфологiчнi етапи цього циклу представленi на (рис.4.2.1). РЖнфекцiйнi ЕТ адсорбуються на поверхнi клiтини, яка потiм поглинаi iх шляхом ендоцитозу. Доля фагоцитованих ЕТ на цьому першому критичному етапi взаiмодii з клiтиною-хазяiном може скластися двояко:
тАв EТ гине пiд впливом лiзосомноi активностi клiтини-хазяiна
тАв ЕТ зберiгаi життiздатнiсть i вступаi в цикл розвитку [5].
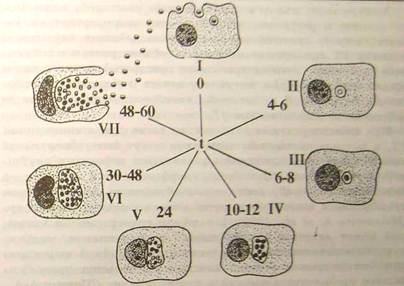
Рисунок 4.2.1 - Схема циклу розвитку хламiдiй в чутливiй клiтинi: (Шаткiн А.А., Мавров РЖ.РЖ., 1983) [5]
Хламiдii здатнi якимсь чином стимулювати специфiчний фагоцитоз, що даi очевиднi переваги облiгатному внутрiклiтинному паразиту. Проникнення елементарних тiлець в клiтину супроводжуiться руйнуванням оболонок, внаслiдок чого вiдбуваiться розм'якшення клiтинних стiнок. Присутнiсть iнфекцiйних частинок у фагосомi не супроводжуiться розщеплюванням лiзосом, як при звичайному фагоцитозi. Цей процес управляiться самими хламiдiями, оскiльки показано, що якщо в результатi фагоцитозу захоплюються хламiдii, убитi нагрiванням, то злиття лiзосом не вiдбуваiться [Friis, 1972]. Неспецiалiзованi клiтини (не здiбнi до активного фагоцитозу) стимулюються хламiдiями так, щоб вони iх захоплювали [Byrne, Moulder, 1978] [2].
Можна видiлити 4 основних шляхи, по яких можуть реалiзуватися подальшi етапи взаiмодii хламiдiй з клiтиною-хазяiном (Шаткiн А.А., Мавров РЖ.РЖ., 1983) [19]:
В· Деструкцiя хламiдii в фаголiзосомнiй системi клiтини-хазяiна
В· Продуктивний цикл розвитку хламiдiй - репродукцiя
В· L-подiбна трансформацiя хламiдiй
В· Персистенцiя хламiдiй.
Через 4-6 годин пiсля зараження ЕТ [5], елементарнi тiльця розташовуються у вакуолi, оточеною дерiватною мембраною, що захищаi iх вiд дii лiзоцимiв. На вiдмiну вiд вiрусiв хламiдii не мають еклiпсо-фази []. Деструкцii, що далi не пiддалися, в сприятливих умовах функцiонування клiтки-господаря, вступають в цикл розвитку, який протiкаi по вiдомiй схемi: ЕТ реорганiзуються у вегетативну форму - РT (через ПT); РT вступають в клiтинний цикл, дiляться бiнарно (всього 8-12 циклiв); дочiрнi РT перетворяться в ПT i далi в ЕТ- iнфекцiйнi форми нового поколiння мiкроорганiзму. Цикл розвитку звичайно займаi 48-72 години.
Вегетативну стадiю в циклi розвитку хламiдii, зокрема дiлення i реорганiзацiю РT, можна розглядати як другий критичний етап взаiмодii паразита i хазяiна. РT високочутливi до несприятливих екзогенних (наприклад, антибактерiальнi препарати) i ендогенних дiй, якi можуть зумовити загибель паразита, що розмножуiться. В той же час антибiотики практично не дiють на iнфекцiйнi ЕТ [20].
За несприятливих умов, на етапi функцiонування РT, в цитоплазматичному включеннi можуть бути виявленi аномальнi форми хламiдiй з рiзними дефектами клiтинноi стiнки. Цi утворення, морфологiчно схожi з L-формами бактерiй, закономiрно утворюються пiд впливом тих, що традицiйних трансформують агентiв - Пенiцилiну i iн. (Matsumoto A. et al., 1970). L-подiбна трансформацiя хламiдii може бути основою одного з механiзмiв, що iндукують виникнення персистентноi хламiдiйноi iнфекцii, при безсимптомному перебiгу яких спостерiгаiться тривале перебування хламiдiй в клiтинi-хазяiна (Шаткiн А.А., Попов В.Л., 1986).
Персистенцiя хламiдiй може спостерiгатися при всiх вiдомих хламiдiозах i у рядi випадкiв маi надiйне мiкробiологiчне пiдтвердження. Проте знання про цей шлях взаiмодii паразита з хазяiном вкрай обмеженi [5]. Схематично цей шлях з боку господаря може бути пов'язаний з нездатнiстю забезпечити вiдтворення паразита необхiдними метаболiтами i / або використанням обмежених механiзмiв захисту, здатних лише iнгiбiрувати розмноження, але не елiмiнувати патогенний агент. Як i iншi шляхи взаiмодii, персистенцiя хламiдiй поза сумнiвом контролюiться iмунною системою. Вiдомо, що лiмфоцити вiд iмунних тварин оберiгають персистентно iнфiкованi макрофаги вiд активацii хламiдiйноi iнфекцii. Вiдома i активна течiя i генералiзуi локалiзованих експериментальних хламiдiйних iнфекцiй у iммуносупресованих тварин. Активний розвиток цього напряму дослiджень i одним з актуальних завдань хламiдiологiв [2].
В процесi взаiмодii з хламiдiiю клiтина-хазяiн пiддаiться дii ii чинникiв патогенностi, що викликають рiзнi порушення життiдiяльностi клiтки. При продуктивному циклi розвитку хламiдiй в клiтинi-хазяiна послiдовно пригнiчуються життiвi функцii, що приводять до ii загибелi i руйнування. Цей результат, як правило, наступаi в перiод завершення циклу розвитку хламiдiй. Суть подiй, що протiкають в клiтинi-хазяiна при L-подiбнiй трансформацii i персистенцii хламiдiй, залишаiться нерозкритою. Функцiонально в цих ситуацiях реалiзуiться часовий збалансований стан, результат якого теоретично може бути на к
Вместе с этим смотрят:
РЖсторiя виникнення та розвитку масажу
Аборты
Аденовирусная инфекция
Азотные и кислородные ванны, нафталановая нефть
Акушерська операцiя - накладання акушерських щипцiв