Виготовлення лiкарських препаратiв на основi амiлолiтичних ферментiв
ЗМРЖСТ
ВСТУП
1. ДЖЕРЕЛА ОДЕРЖАННЯ АМРЖЛОЛРЖТИЧНИХ ФЕРМЕНТРЖВ
1.1 Продуценти тАУпрокарiоти
1.2 Продуценти тАУ дрiжджеподiбнi гриби
1.3 Продуценти тАУ мiкроскопiчнi гриби
1.4 Патентний пошук
1.4.1 Штам цвiлевого гриба Aspergillus аwamori IMBF-100017 - продуценту амiлолiтичних ферментiв
1.4.2 Штам бактерiй Васillus licheniformis тАУ продуцент комплексу термостабiльних амiлолiтичних i протеолiтичних ферментiв
2. МЕХАНРЖЗМ ДРЖРЗ ТА ВЛАСТИВОСТРЖ АМРЖЛОЛРЖТИЧНИХ ФЕРМЕНТРЖВ
2.1 Властивостi та структура ферментiв
2.2 Класифiкацiя амiлолiтичних ферментiв
2.3 Механiзм дii амiлолiтичних ферментiв
3. ФРЖРМИ ВИРОБНИКИ АМРЖЛОЛРЖТИЧНИХ ФЕРМЕНТНИХ ПРЕПАРАТРЖВ
3.1 Украiнськi виробники
3.2 Закордоннi виробники
3.3 Росiйськi виробники
4. ГАЛУЗРЖ ВИКОРИСТАННЯ АМРЖЛОЛРЖТИЧНИХ ФЕРМЕНТНИХ ПРЕПАРАТРЖВ
4.1 Хлiбопекарська i крохмалопаточна промисловiсть
4.2 Пивоварiння та спиртова промисловiсть
4.3 Текстильна промисловiсть
4.4 Фармацевтична промисловiсть
5. СУЧАСНРЖ НАУКОВРЖ ДОСЛРЖДЖЕННЯ, ПОВ`ЯЗАНРЖ З РОЗРОБКОЮ АМРЖЛОЛРЖТИЧНИХ ФЕРМЕНТНИХ ПРЕПАРАТРЖВ
5. 1Комп'ютерне моделювання структурi амiлолiтичних ферментiв
6. ОСОБЛИВОСТРЖ ТЕХНОЛОГРЖЧНОГО ПРОЦЕСУ ВИРОБНИЦТВА АМРЖЛОЛРЖТИЧНИХ ФЕРМЕНТНИХ ПРЕПАРАТРЖВ
6.1 Виробничi способи культивування мiкроорганiзмiв тАУ продутентiв ферментiв
6.2 Отримання амiлолiтичних ферментних препаратiв з глибинних культур мiкроорганiзмiв
6.3 Отримання амiлолiтичних ферментних препаратiв з поверхневих культур мiкроорганiзмiв
7. МЕТОДИКИ ВИЗНАЧЕННЯ ФЕРМЕНТАТИВНОРЗ АКТИВНОСТРЖ АМРЖЛОЛРЖТИЧНИХ ФЕРМЕНТРЖВ
7.1 Спектрофлюрометричнi методи
7.2 Колориметричнi (фотометричнi) методи
7.3 Спектрофотометричнi методи
7.4 Манометричнi методи i iншi методи
ВИСНОВОК
СПИСОК ЛРЖТЕРАТУРИ
ВСТУП
Ферменти або ензими тАУ органiчнi каталiзатори бiлковоi або РНК природи. Ферменти каталiзують бiльшiсть хiмiчних реакцiй, якi вiдбуваються у живих органiзмах.
Великою i незаперечною перевагою ферментiв перед хiмiчними каталiзаторами i те, що вони дiють при нормальному тиску, при температурах вiд 20 до 70 В° С, рН в дiапазонi вiд 4 до 9 i мають у бiльшостi випадкiв виключно високу субстратну специфiчнiсть, що дозволяi в складнiй сумiшi бiополiмерiв направлено впливати тiльки на визначенi з'iднання.
НА сьогоднiшнiй день в свiтi iнтенсивно збiльшуiться виробництво ферментiв для використання iх в рiзноманiтних ланках людськоi життiдiяльностi. Не виняток i амiлолiтичнi ферментнi препарати. Завдяки своiм особливостi тАУ каталiзу реакцiй гiдролiзу рiзноманiтних олiго- та полiсахаридiв тАУ амiлолiтичнi ферменти використовуються в харчовiй промисловостi, легкiй промисловостi, медичнiй промисловостi, та в дiагностичних цiлях. РЗх використання значно спрощуi та значно здешевлюi технологiчний процес виробництва.
Все це свiдчить про те, що виробництво амiлолiтичних ферментних препаратiв i одним з перспективних напрямкiв у бiотехнологii, що буде i далi iнтенсивно розвиватися та розширюватися. РЖ саме тому цей реферат наддаi докладну iнформацiю про структуру та функцii а також схему виробництва амiлолiтичних препаратiв.
1. ДЖЕРЕЛА ОТРИМАННЯ АМРЖЛОЛРЖТИЧНИХ ФЕРМЕНТРЖВ
НА сьогоднiшнiй день амiлолiтичнi ферментнi препарати в Украiнi та за кордоном набули дуже широкого використання.
До розвитку ферментноi промисловостi головним промисловим джерелом отримання амiлаз в iвропейських краiнах було проросле зерно (солод). Для медичних цiлей амiлази отримували з тваринноi сировини. В даний час головним джерелом амiлаз i прокарiоти, особливо бактерii, гриби i найрiдше дрiжджi[1,2].
1.1 Прокарiоти
Серед бактерiальноi мiкрофлори найбiльш ефективними продуцентами i такi мiкроорганiзми: Вас. subtilis, Вас. diastaticus, Вас. mesentericus, Вас. macerans i Вас. polymycus та iн.
Бацили тАУ продуценти амiлолiтичних ферментiв представляють собою в бiльшостi випадкiв Г+ палички довжиною 1,2 .. 1,3 мкм i дiаметром 0,6 .. 0,8 мкм. Палички з'iднуються по два, три, iнодi утворюють ланцюжки. собою утворюють спори, що надають стiйкiсть клiтинi при дii несприятливих умов. Такi форми легко переносять висушування, низькi та високi температури, опромiнення i т. д. Цикл розвитку бактерiй порiвняно короткий.
рН-стабiльнiсть мiкробних глюкоамiлаз лежить в широкому дiапазонi вiд 2,5 до 9. Термостабiльнiсть глюкоамiлаз лежить в iнтервалi вiд 30 до 45 В° С i рiдко пiдвищуiться до 55-60 В° С. Глюкоамiлази рiзного походження помiтно вiдрiзняються по молекулярнiй масi, яка, за даними рiзних авторiв, маi значення вiд 48 000 до 210 000.
Бактерiю Вас. subtilis-82, що застосовуiться в даний час на спиртових заводах як продуцент α-амiлази в сумiшi з препаратами глюкоамiлази, вирощують протягом 48 .. 60 годин при температурi +30 - +35 В° С.
Особливiсть застосування бактерiй у виробництвi тАУ iх здатнiсть утворювати високоактивну термостiйку α-амiлазу. Для розрiдження крохмалю також застосовуються амiлолiтичнi препарати, що мiстять α-амiлазу: α-амiлаза гiдролiзуi внутрiшнi альфа-1,4-глiкозиднi зв'язки крохмалю, приводячи до швидкого зниження в'язкостi клейстеризованих розчинiв крохмалю, тим самим забезпечуючи пiдготовку сусла до дii глюкоамiлази. Кiнцевими продуктами дii бактерiальноi альфа-амiлази на крохмаль i низькомолекулярнi розчиннi декстрини з невеликим змiстом моно-i дисахаридiв (глюкози i мальтози). [3].
1.2 Дрiжджоподiбнi гриби
Амiлолiтичнi ферменти синтезують також деякi дрiжджi i дрiжджоподiбнi гриби родiв Saccharomyces, Candida, Endomycopsis i Endomyces.
Вiдомо бiльше 100 видiв дрiжджiв, якi добре ростуть на крохмалi як на iдиному джерелi вуглецю. Серед них особливо видiляються два види, якi утворюють як глюкоамiлази, так i β-амiлази, ростуть на крохмалi з високим економiчним коефiцiiнтом i можуть не тiльки асимiлювати, але i зброджувати крохмаль: Schwanniomyces occidentalis i Saccharomycopsis fibuliger. Обидва види - перспективнi продуценти амiлолiтичних ферментiв на крохмалевмiсних вiдходах.
У спиртовому виробництвi знайшли застосування дрiжджоподiбнi гриби End. bispora i End. species 20-9, що вирощуються глибинним способом i продукують головним чином активну глюкоамiлазу; активнiсть ферменту виявляiться слабо. Високоактивний End. bispora маi розгалужений мiцелiй, утворюi бластоспори; гiфи тАУ септованi, зернистi; на твердих агаризованних середовищах пророщують колонii з повiтряним сiрувато-бiлим мiцелiiм, на рiдких поживних середовищах - гiфи i деяка кiлькiсть бластоспор.
Дрiжджоподiбнi гриби в спиртовому виробництвi самостiйно не застосовують, тому що вони не мiстять iнших ферментiв, необхiдних для нормального оцукрювання сусла з крохмалевмiсноi сировини. Зазвичай iх використовують у сумiшi з ферментними препаратами з мiкроскопiчних грибiв чи бактерiй [4].
1.3 Мiкроскопiчнi гриби
Для отримання амiлаз широко застосовують мiкроскопiчнi гриби роду Aspergillus, видiв: niger, oryzae, usamii, awamori, batatae, роду Rhizopus, видiв: delemar, tonkinensis, niveus, japonicum та iн, А також окремi штами Neurospora grassa i Mucor.
Мiкроскопiчнi гриби дуже широко поширенi в природi; основне мiсце iх проживання тАУ грунт.
Всi роди i види мiкроскопiчних грибiв характеризуються нитковидною будовою тiла i специфiчною будовою плодоносних органiв. Тiло гриба складаiться з довгих переплетених ниток сiруватого або бiлого кольору, що називаються гiфами. Вони поширюються по поверхнi поживного субстрату, утворюючи мiцелiй, i частково вростають в нього. Деякi гiфи, що пiднiмаються над поверхнею у виглядi легкого пуху, мають бiльш складну будову i мають органи плодоношення, що називаються конiдiями або спорангiiносцями. У мукорових грибiв на спорангiiносця знаходиться кулевидне здуття, оточене оболонкою, всерединi якого утворюються спори. У аспергiллiв кiнець конiдiiносця маi булавкоподiбнi потовщення, вiд якого вiдходять подовженi клiтини, званi стеригмами; вiд стеригм вiдшнуровуются бiльш дрiбнi круглi клiтини тАУ конiдii
Вiдокреленi конiдii або спори, потрапляючи у сприятливi умови, починаi проростати, потiм гiфи гiлкуються, утворюючи мiцелiй; при виснаженнi живильних речовин у середовищi гриб переходить у стадiю споро- або конiдiiутворення. Спори i конiдii мiкроскопiчних грибiв мiстять пiгменти, що i додаi зрiлим культурам характерного забарвлення. Спори розвиваються трьома рiзними способами, в залежностi вiд виду мiкроскопiчного гриба:
В· як круглi дiлянки в межах мережi гiфiв;
В· як речовина в торбинцi на кiнцi антени Гiфа;
В· як схожi на ланцюгу дiлянки на кiнцi антени Гiфа
Аспергiлли - типовi аерофiли, тому вони можуть розвивватись тiльки на поверхнi твердого або рiдкого середовища або в рiдкому середовищi, що аеруiться. Оптимальна температура для бiльшостi аспергiллiв +25 - +30 В° С, для деяких - до 35 В° С. Бiльшiсть грибiв при поверхневому культивуваннi можуть переносити короткочасне пiдвищення температури до 40 В° С i навiть 45 В° С без помiтноi втрати активностi ферментiв. Оптимальна вологiсть середовища для них близько 65%.
Для живлення аспергiллiв необхiднi вуглеводи, азотистi i мiнеральнi речовини. Як джерело вуглеводу, крiм моносахаридiв, багатьох олiго- i полiсахаридiв, можуть бути спирти i органiчнi кислоти, однак для накопичення амiлази в середовищi обов'язково повиннi бути присутнiми крохмаль, декстрини або мальтоза. У середовищах, що мiстять iншi цукри, в тому числi глюкозу, гриби не утворюють амiлази. Джерелом азоту можуть бути бiлки i iх гiдролiзати, амонiйнi солi та нiтрати.
Середа повиннi мiстити сполуки, до складу яких входять сiрка, фосфор, калiй, магнiй i мiкроелементи. Бiльшiсть мiкроскопiчних грибiв засвоюють сiрку з сульфатiв, а фосфор тАУ з фосфатiв. Аспергiлли не потребують готових вiтамiнах та фактори росту, тому що здатнi самi синтезувати iх з бiльш простих сполук, що i в середовищi. Препарати ферментiв з мiкроскопiчних грибiв включають, як правило, широкий набiр ферментiв, тому можуть повнiстю замiнювати зерновий солод[4,5].
1.4 Патентний пошук
1.4.1 Штам цвiлевого гриба Aspergillus аwamori IMBF-100017 - продуценту амiлолiтичних ферментiв
Суть винаходу: Винахiдвiдноситься дохарчовоi промисловостi, зокрема до спиртовоi, i може бути використаний на спиртових заводах для оцукрювання крохмалемiсних субстратiв. Вiдомi продуценти амiлолiтичних ферментiв Asp. niger, Asp. oryzae, Rhizopus, Asp. awamon штам 224-21, 78-2, AK-1 (Глюкоамипаза микроорганизмов - M 1975 -C 6-10) Вiдомий штам Asp. awamon № 466, якийзастосовуiться на спиртових заводах дляодержання ферментiв глкжоамiлазного комплексу (Промисловий регламент виробництва амiпоглюкавамарiну Гх-466, Киiв, 1995 - С 3 -4), але цей штам маi не дуже високу активнiсть синтезу амiлолiтичних ферментiв За 120 -144 год росту накопичуi 140-180 од/см3 активностi
Задача винаходу тАУ селекцiя нового штаму Asp. awamon з пiдвищеною бюсинтетичною активнiстю i швидкiстю росту культури. Технiчний результат, який одержують вiд реалiзацii винаходу полягаi в пiдвищеннi ферментативноi активностi штаму та швидкостi його росту.
Описання винаходу: Досягаiться технiчнийрезультат використанням нового штаму Aspergillus awamon IMBF 100017 тАУ продуцента амiлолiтичних ферментiв для оцукрювання крохмалю з пiдвищеною бюсинтетичною активнiстю. При цьому виникаi пов'язана з технiчним результатом споживча властивiсть заявляемого об'iкту тАУ пiдвищення виходу i активностi цiльового продукту. Штам плiснявого гриба Aspergillus awamon IMBF 100017 вiдселекцiйоновано шляхом багатоступiнчатого вiдбору з виробничоi популяцii продуценту амiлолiтичних ферментiв Одержаний штам гриба Aspergillus awamon IMBF 100017 маi такi морфологiчнi та фiзiологiчнi ознаки.
Культурально-морфолопчнi ознаки.На середовищi Чапека iз сахарозою гiгантська колонiя на 12 добу росту при температурi 30В°С маi розмiр 39,0 - 43,0мм, форма колонiй кругла, колiр колонii вiд темно-коричневого до чорного, край колонii нерiвний, поверхня колонii плоска, складчастiсть слабо виражена, переважно в центрi колони, пiгмент iз зворотноi сторони колони свiтлокоричневий, ексудат вiдсутнiй, конiдii утворюються по всiй поверхнi колонii, бiльш щiльно в центрi колонii, колiр конiдiй вiд темно-коричневого до чорного. Через 12 дiб проводять мiкроскопiчне дослiдження колонiй гриба на чашках Петрi з метою вивчення органiв розмноження. При спостереженнiкраюколонii виявлено сегментований мiцелiй, вiд якого вертикально вiдходять конiдiiносцi На iх вершинах утворюються розширення у виглядi головок, або булав, на поверхнi яких з'являються чисельнi дрiбнi вирости-стеригми Стеригми простi, не розгалужуються Вiд стеригм вiдшнуровуються ланцюжки округлих гладеньких темнокоричневих або чорних конiдiй. Розмноження безстатеве, вегетативне, шляхом утворення конiдiй. Фiзiологiчнi ознаки. На рiдких поживних середовищах культура здатна утилiзувати крохмаль, сахарозу, глюкозу, мальтозу.
Оптимальна температура росту на рiдких поживних середовищах - 30В°С.
Тип дихання тАУ аеробний.
Технологiчнахарактеристика: При вирощуваннi гриба штаму 1MB F 100017 на водно-борошнянiй суспензii (концентрацiя сухих речовин кукурудзяного, житнього або пшеничного сусла повинна бути не менше 18 - 20%) культура активно синтезуi ферменти глюкоамiлазного комплексу При глибинному культивуваннi на 5 добу в умовах iнтенсивноi аерацii глюкоамiлазна активнiсть досягаi 200 - 220 од/см3). Бiотехнологiчнi показники заявленого штаму 1MB F 100017 iлюструються прикладом.
Приклад: Оцiнку виробничих якостей штаму 1MB F 100017 проводили методом глибинного культивування на розваренiй оцукренiй водно-борошнянiй суспензii Спiввiдношення борошна i води 1 2,5, оцукрювали бактерiальною а-амiлазою (1,5 од/г крохмалю) Витрати повiтря на аерацiю 25 - ЗО м3/м3/год при постiйному перемiшуваннi 110-120 об/хв.
Температура культивування - 35В°С
Тривалiсть процесу -120 годин
В культуральнiй рiдинi (в кiнцi вирощування) визначали активнiсть амiлолiтичних ферментiв. Данi, якi пiдтверджують перевагу заявленого штаму в порiвняннi зi штамом-прототипом, наведенi i таблицi 1.1.
Таблиця 1.1. Показники продуктивностi шатму гриба Asp. awamon
| Показники | Штами гриба Asp. awamon |
| (заявлений) | (прототип) |
| Тривалiсть процесу, год | 120 | 144 |
а-амiпазна активнiсть, од/см3 | 50 В±5 | 30 В±5 |
Глюкоамiлазна активнiсть од/см3 | 150В±10 | 110 В± 10 |
Сумарна амiлолггична активнiсть, од/см3 | 200 - 220 | 140-180 |
Як видно з таблицi, при використаннi заявленого штаму а-амiлази накопичусться на 15% бiльше нiж за прототипом Глюкоамiлазна активнiсть - на 36% бiльше, нiж за прототипом Тривалiсть процесу накопичення ферментiв скорочуiться на 20%
Таким чином застосування заявленого штаму дозволяi збiльшити на 20 - 30% накопичення амiлолггичних ферментiв, а також скоротити тривалiсть iх накопичення на 20%
Номер патенту: 47822
Клас (и) патенту: C12N 1 / 14, C12R 1 / 665, C12P 7 / 06
Номер заявки: 2001096648
Дата подачi заявки: 28.09.2001
Дата публiкацii: 15.07.2002
Заявник (и): Украiнський науково-дослiдний iнститут спирту i бiотехнологii продовольчих продуктiв.
Автор (и): Олiйнiчук Сергiй Тимофiйович; Левандовський Леонiд Вiкторович; Ткаченко Алла Феодосiiвна; Руднiченко Людмила Вiкторiвна; Коваль Катерина Олександрiвна; Бейко Наталiя РДвгенiвна
Патентовласник (и): Украiнський науково-дослiдний iнститут спирту i бiотехнологii продовольчих продуктiв.
1.4.2 Штам бактерiй Васillus licheniformis тАУ продуцент комплексу термостабiльним амiлолiтичнi i протеолiтичних ферментiв
Суть винаходу: винахiд вiдноситься до бiотехнологii i може бути використане в спиртовому, крохмале-патоковому, пивоварному, хлiбопекарському, кондитерському, плодово-ягiдному, текстильному виробництвах, де потрiбнi ферменти, стiйкi до пiдвищених температур. Штам бактерiй Bacillus licheniformis ВКМ У-2184 Д видiлений селекцiйним шляхом при вивченнi природноi мiнливостi штаму МКПМ В-6508 iз застосуванням методiв ефективного мутагенезу. Продукуi комплекс, що мiстить не менше п'яти термостабiльних амiлолiтичних i протеолiтичних ферментiв. Активний дiапазон значень рН 5,0-11,0 i температури 30-105 º С з максимальною активнiстю альфа-амiлази при 90-95 º С, пуллуланази - при 75 º С, протеази - при 60 º С. Перспективний для одночасноi обробки крохмалю або крохмалевмiсних сировини з метою його глибокого гiдролiзу i як продуцент лужних протеаз для глибокого розщеплення бiлкiв до амiнокислот. Штам маi пiдвищену здатнiсть синтезу комплексу термостабiльним амiлолiтичнi i протеолiтичних ферментiв, що володii також бета-глюканазной i ламiнарiназной активностями.
Номер патенту: 2177995
Клас (и) патенту: C12N1/20, C12N9/28, C12N9/44, C12N9/56, C12N1/20, C12R1: 10
Номер заявки: 98102082/13
Дата подачi заявки: 05.02.1998
Дата публiкацii: 10.01.2002
Заявник (и): Товариство з обмеженою вiдповiдальнiстю Науково-виробнича компанiя "Фермтек"
Автор (и): Цурiкова Н.В.; Нефедова Л.РЖ.; Окунiв О.Н.; Синицин А.П.; Черноглазов В.М.
Патентовласник (и): Товариство з обмеженою вiдповiдальнiстю Науково-виробнича компанiя "Фермтек"
Опис винаходу: винахiд вiдноситься до галузi бiотехнологii, а саме до отримання комплексу амiлолiтичних i протеолiтичних ферментiв, i може бути використане в мiкробiологiчнiйпромисловостi. Амiлолiтичнi ферменти широко використовуються для розрiдження або перетворення крохмалю i крохмалевмiсноi рослинноi сировини в такi продукти, як мальтодекстрин, цукровi сиропи, декстрозу, мальтозу, глюкозу та iн При промисловому використаннi амiлолiтичних ферментiв необхiднi термостабiльнi ферменти, що обумовленi iх здатнiстю вести гiдролiз сировини при високих температурах - 80-100 º С, що дуже важливо з точки зору ведення процесу клейстерiзацii крохмалю. При цьому поiднуються два процеси: клейстерiзацiя крохмалю i його ферментативний гiдролiз. Значно знижуiться вартiсть ферментативного процесу за рахунок скорочення дозування ферменту i тривалостi гiдролiзу крохмалю, бiльш якiсно ведеться пiдготовка сировини до розварювання - забезпечуiться висока ступiнь гiдролiзу крохмалю i, як наслiдок цього, збiльшуiться вихiд цiльового продукту. Для переважноi бiльшостi продуцентiв амiлолiтичних ферментiв характерний переважний бiосинтез одного з ферментiв. Здатнiсть до утворення комплексу ендогенних амiлолiтичних ферментiв, особливо термостабiльностi, виявляiться дуже рiдко. У цьому зв'язку можна назвати ряд термостабiльним анаеробiв з роду Clostridium. Вiдомий штам Clostridium thermohidrosulfuricum, що синтезуi комплекс, що мiстить термостабiльнi пуллуланазу i глюкоамiлазу. У лiтературi описано декiлька анаеробних термофiлiв з роду Clostridium, що здiйснюють бiосинтез амiлази i пуллуланази або альфа-амiлази i глюкоамiлази, активних при високiй температурi. Однак складнiсть культивування анаеробних бактерiй в заводських умовах робить цей спосiб отримання препарату амiлолiтичних ферментiв практично непридатним. З лiтературних даних вiдомо, що найбiльш термостабiльними гiдролiтичними ферментами, такими як альфа-амiлази, пуллуланази, а в рядi випадкiв i протеази i ферменти, якi продукують термофiльних бактерiй Bacillus licheniformis. Вiдомий аеробний Термофiл Bacillus licheniformis, який при культивуваннi на середовищi з кукурудзяноi борошном оптимального для отримання продукту складу синтезуi комплекс позаклiтинних амiлолiтичнi ферментiв - альфа-амiлазу i пуллуланазу в кiлькостi 2 од / мл i 0,68 од / л вiдповiдно (5). Недолiком цього штаму i низька активнiсть продукуються ферментiв, вузький спектр дii комплексу i тривалiсть процесу культивування (144 години). Недолiками штаму i порiвняно низький рiвень активностi, а також висока вартiсть культивування через застосування висококонцентрованою живильного середовища та тривалостi процесу.
Культурально-морфологiчнi ознаки: Клiтини являють собою грампозитивнi, поодинокi рухливi палички розмiром 0,6-0,8 i 0,2-0,3 мк, спороутворюючi. У першi години зростання (логарифмiчна фаза) утворюються ланцюжки з 2-3 клiтин бiльш витягнутоi форми, до 48-56 години зростання (стацiонарна фаза) ланцюжка розпадаються, клiтини товщають, з'являються спори, що мають центральне положення i овальну форму.
2. МЕХАНРЖЗМ ДРЖРЗ ТА ВЛАСТИВОСТРЖ АМРЖЛОЛРЖТИЧНИХ ФЕРМЕНТРЖВ
2.1 Властивостi та структура ферментiв
Принципова структура ферменту наступна: кожен фермент складаiться з апофермента i коферменту, якi, кожен окремо, не активний, але виявляють свою дiю в комплексi - холоферментi. Всi ферменти мають бiлкову природу. Вони являють собою або простi бiлки, цiлком побудованi з полiпептидних ланцюгiв i розпадаються при гiдролiзi тiльки на амiнокислоти (наприклад, гiдролiтичнi ферменти трипсин i пепсин, уреаза), або - в бiльшостi випадкiв - складнi бiлки, що мiстять разом з бiлковоi частиною (апоферментом) небiлковоi компонент (кофермент або простетичноi групу). Багато ферменти з великою молекулярною масою проявляють каталiтичну активнiсть тiльки у присутностi специфiчних низькомолекулярних речовин, якi називаються коферментом (або кофактором). Роль коферментiв грають бiльшiсть вiтамiнiв i багато мiнеральних речовин. Вiтамiни РР (нiкотинова кислота, або нiацин) i рибофлавiн, наприклад, входять до складу коферментiв, необхiдних для функцiонування дегiдрогеназ. Цинк - кофермент карбоангiдрази, ферменту, який каталiзуi вивiльнення з кровi дiоксиду вуглецю, який видаляiться з органiзму разом з повiтрям, що видихаiться. Залiзо i мiдь служать компонентами дихального ферменту цитохромоксидази. Речовини, яка пiддаiться перетворенню в присутностi ферменту, називають субстратом. Субстрат приiднуiться до ферменту, який прискорюi розрив одних хiмiчних зв'язкiв в його молекулi та створення iнших; що утворюiться в результатi продукт вiд'iднуiться вiд ферменту. Продукт теж можна вважати субстратом, оскiльки всi ферментативнi реакцii в тiй чи iншiй мiрi оборотнi.
За типом реакцiй, що каталiзуються ферменти пiдроздiляються на 6 класiв згiдно iiрархiчноi класифiкацii ферментiв (КФ, EC - Enzyme Comission code). Кожен клас мiстить пiдкласи, так що фермент описуiться сукупнiстю чотирьох чисел, роздiлених крапками. Перше число грубо описуi механiзм реакцii, що каталiзуiться ферментом:
КФ 1: оксидоредуктаиз, каталiзують окислення або вiдновлення.
КФ 2: трансферази, каталiзують перенос хiмiчних груп з однiii молекули субстрату на iншу.
КФ 3: Гiдролази, каталiзують гiдролiз хiмiчних зв'язкiв. Приклад: естерази, пепсин, трипсин, амiлаза, лiпопротеiнлiпаза
КФ 4: Лiази, каталiзують розрив хiмiчних зв'язкiв без гiдролiзу з утворенням подвiйного зв'язку в одному з продуктiв.
КФ 5: РЖзомерази, каталiзують структурнi або геометричнi змiни в молекулi субстрату.
КФ 6: Лiгази, каталiзують утворення хiмiчних зв'язкiв мiж субстратами за рахунок гiдролiзу АТФ.
Будучи каталiзаторами, ферменти прискорюють як пряму, так i зворотну реакцii, тому, наприклад, лiази здатнi каталiзувати i зворотну реакцiю тАУ приiднання по подвiйним зв'язкам.
Ферменти являють собою бiокаталiзатори бiлковоi природи. Каталiзуючи переважна бiльшiсть бiохiмiчних реакцiй в органiзмi, ферменти регулюють обмiн речовин i енергii, граючи тим самим важливу роль у всiх процесах життiдiяльностi. Всi функцiональнi прояви живих органiзмiв (дихання, м'язова скорочення, передача нервового iмпульсу, розмноження i т.д.) забезпечуються дiiю ферментних систем. Сукупнiстю ферментних реакцiй, що каталiзуються, i синтез, розпад та iншi перетворення бiлкiв, жирiв, вуглеводiв, нуклеiнових кислот, гормонiв та iнших сполук.
Активнiсть ферментiв визначаiться iх тривимiрноi структурою [3]. Як i всi бiлки, ферменти синтезуються у виглядi лiнiйного ланцюжка амiнокислот, яка згортаiться певним чином. Кожна послiдовнiсть амiнокислот згортаiться особливим чином, i виходить молекула (бiлкова глобула) маi унiкальнi властивостi. Кiлька бiлкових ланцюгiв можуть об'iднуватися в бiлковий комплекс. Третинна структура бiлкiв руйнуiться при нагрiваннi або дii деяких хiмiчних речовин.
Щоб каталiзувати реакцiю, фермент повинен зв'язатися з одним або декiлькома субстратами. Бiлковий ланцюг ферменту згортаiться таким чином, що на поверхнi глобули утворюiться щiлина, або западина, де зв'язуються субстрати. Ця область називаiться сайтом зв'язування субстрату. Зазвичай вiн збiгаiться з активним центром ферменту або знаходиться поблизу нього. Деякi ферменти мiстять також сайти зв'язування кофакторiв або iонiв металiв.
Фермент, з'iднуючись з субстратом:
тАв очищаi субстрат вiд водяноi ВлшубиВ»
тАв маi у своiму розпорядженнi реагують молекули субстратiв в просторi за потрiбне для протiкання реакцii чином
тАв готуi до реакцii (наприклад, поляризуi) молекули субстратiв.
Зазвичай приiднання ферменту до субстрату вiдбуваiться за рахунок iонних або водневих зв'язкiв, рiдше тАУ за рахунок ковалентних. Наприкiнцi реакцii ii продукт (або продукти) вiддiляються вiд ферменту.
У результатi фермент знижуi енергiю активацii реакцii. Це вiдбуваiться тому, що в присутностi ферменту реакцiя йде iншим шляхом (фактично вiдбуваiться iнша реакцiя), наприклад:
У вiдсутностi ферменту:
А + В = АВ
У присутностi ферменту:
А + Ф = АФ
АФ + В = АВФ
АВФ = АВ + Ф
де А, В - субстрати, АВ - продукт реакцii, Ф - фермент.
Ферменти не можуть самостiйно забезпечувати енергiiю ендергонiчнi реакцii (для протiкання яких потрiбна енергiя). Тому ферменти, що здiйснюють такi реакцii, сполучати iх з екзергонiчними реакцiями, що йдуть з видiленням бiльшоi кiлькостi енергii [2,7].
2.2 Класифiкацiя амiлолiтичних ферментiв
Амiлолiтичнi ферменти об'iднують велику групу ферментiв, якi здiйснюють гiдролiз переважно α-(1,4)-Глiкозидних зв'язкiв амiлози, амiлопектину, глiкогену та iнших мальтоолiгосахаридiв. До групи амiлолiтичних ферментiв вiдносяться наведенi нижче i деякi iншi ферменти:
КФ 3.2.1.1 α-амiлаза
КФ 3.2.1.2 β-амiлаза
КФ 3.2.1.3 Глюкоамiлаза
КФ 3.2.1.41 Пуллуланаза
КФ 3.2.1.68 РЖзоамiлаза
КФ 3.2.1.20 α-глюкозидази
КФ 3.2.1.11 Декстраназа
КФ 2.4.1.19 Амiлаза Bacillus macerans (циклодекстроглюканотрансфераза)
Амiлази бувають двох типiв: ендо-i екзоамiлази. Чiтко вираженоi ендоамiлазой i α-амiлаза, здатна до розриву внутрiшньомолекулярних зв'язкiв у полiмерних ланцюгах субстрату. Глюкоамiлаза i β-амiлаза i екзоамiлазами, тобто ферментами, що атакують субстрат з нередукуючого кiнця.
Субстратами для дii амiлаз i крохмаль, що складаiться з амiлози i амiлопектину, продукти часткового гiдролiзу крохмалю i глiкоген. Крохмаль - рослинний полiсахарид з дуже складною будовою. Цей двокомпонентний з'iднання, що складаiться з 13-30% амiлози i 70-85% амiлопектину. Обидва компоненти неоднорiднi, iх молекулярна маса (М. м.) коливаiться в широких межах i залежить вiд природи крохмалю. Амiлоза - це необертающийся полiмер, в якому залишки глюкози Сполучених α-1,4-Глiкозидний зв'язком; ступiнь полiмеризацii близько 2000. У ВланомальнихВ» амiлози з однiiю-двома α-1,6-зв'язками полiмеризацiя може зрости до 6000. Амiлоза практично не маi вiдновлюючоi здатностi, тому що в кожнiй молекулi амiлози i тiльки один вiльна альдегiдна група [8].
Реакцii, що каталiзуються амiлазами, мають двi стадii: коротку передстацiонарну i тривалу тАУ стацiонарну. Пiд час першоi стадii ендоамiлаза швидко зменшуi молекулярну масу субстрату, утворюючи сумiш лiнiйних та розгалужених олiгосахаридiв. Другий етап реакцii триваi, поки продукти гiдролiзу не перестануть забарвлюватися йодом; вiн протiкаi значно повiльнiше i залежить вiд iндивiдуальних властивостей ферменту та його природи[9].
α-амiлаза (1,4-α-D-глюканглюканогiдролаза) i ендоамiлазою, що викликаi гiдролiтичнi розщеплення α-1,4-глiкозидних зв'язкiв всерединi полiмерного субстрату. Це водорозчинний бiлок, що маi властивостi глобулiну i маi молекулярну масу 45-60 кДа. Всi α-амiлази вiдносяться до металоензимiв, вмiст у них Са коливаiться вiд 1 до 30 г-атом / 1 г-моль ферменту. Повне видалення Са приводить до iнактивацii ферменту. Глутамiнова i аспарагiнова кислоти становлять 25 мас. % Вiд маси бiлка. Залежно вiд виду мiкроорганiзму властивостi α-амiлаз можуть сильно вiдрiзнятися не тiльки за механiзмом дii на субстрат i по кiнцевим продуктам, але i за оптимальними умовами для прояву максимальноi активностi. Присутнiсть в промислових препаратах протеiназ знижуi каталiтичну активнiсть α-амiлази. У результатi впливу α-амiлази на перших стадiях в гiдролiзатi накопичуються декстрини, потiм з'являються тетра- i тримальтоза, що не зафарбовуються йодом i якi дуже повiльно гiдролiзуються α-амiлазою до ди- i моносахаридiв[5].
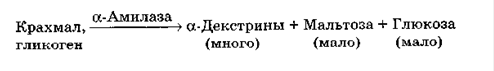
Рисунок 2.1. Механiзм дii α-амiлази[2]
β-амiлаза (β -1,4-глюкан мальтогiдролаза, КФ 3.2.1.2) - активний бiлок, що володii влатсивостями альбумiну. Каталiтичний центр ферменту маi сульфгiдрильнi i карбоксильнi групи i iмiдозольний цикл залишкiв гiстидину. β-Амiлаза тАУекзофермент кiнцевоi дii, що виявляi спорiдненiсть до передостаннього β -1,4-зв'язку з нередукуючого кiнця лiнiйного дiлянки амiлози i амiлопектину.
На вiдмiну вiд α-амiлази β-амiлаза практично не гiдролiзують нативний крохмаль, тодi як клейстеризований крохмаль гiдролiзуiтся нею з утворенням мальтози β-конфiгурацii. Якщо гiдролiзу пiддаiться амiлоза, то гiдролiз йде повнiстю до мальтози. Незначна кiлькiсть декстринiв може здiснюватися при гiдролiзi ВланомальноiВ» амiлози, тому що гiдролiз β-амiлазою йде тiльки по лiнiйнiй ланцюга до α -1,6-зв'язкiв. Якщо субстратом для β-амiлази служить амiлопектин, то гiдролiз йде в значно меншому ступенi. β-Амiлаза вiдщеплюi фрагмент з нередукуючим кiнцем дiлянки вiд зовнiшнiх лiнiйних гiлок, якi мають по 20-26 глюкозних залишкiв, з утворенням 10-12 молекул мальтози. Гiдролiз призупиняiться на передостаннiй α -1,4-зв'язку, що межуi з α -1,6-зв'язком. У гiдролiзатi накопичуiться 54-58% мальтози, решту становлять високомолекулярнi декстрини, що мiстять значну кiлькiсть α -1 ,6-зв'язкiв тАУ так званi β -декстрини.
β-амiлази виявляють бiльшу стабiльнiсть у вiдсутнiсть iонiв Са2+. Молекулярна маса β-амiлази рослин досить висока, вона складаi вiд 50000 до 200000. Фермент може складатися з однiii або чотирьох субодиниць до 50 000 кожна. Фермент мiстить SH-групи та чутливий до дii важких металiв. Вважаiться, що (β-амiлазу маi високу здатнiсть до нескiнченоi атаки субстрату. Для амiлози середньоi молекулярнi маси в одному при з'iднаннi ферменту до субстрату можливо вiдчеплення до чотирьох залишкiв мальтози. При збiльшеннi молекулярноi маси субстрату можлива i бiльша кiлькiсть мiсць атаки.
Продукт реакцii тАУ мальтоза тАУ маi β-конфiгурацiю. Гiдролiз iде по лiнiйному ланцюзi тiльки до α-1,6-зв'язкiв. При гiдролiзi крохмалю утворюiться 54-58% мальтози i 42-46% високомолекулярних декстринiв (β-декстринiв). β-амiлази виявляють бiльшу стабiльнiсть у вiдсутнiсть iонiв Са. Фермент може складатися з однiii або чотирьох субодиниць, мiстить SH-групи та чутливий до дii важких металiв. Властивостi β-амiлаз залежать вiд джерел iх видiлення. Для отримання мальтози з крохмалю використовують бактерiальнi β-амiлази[5].

Рисунок 2.2. Принциповий механiзм дii β-амiлази[2]
Глюкоамiлаза (1,4-α-D-глюканглюкогiдролаза) широко рас-розлогий в природi. Вона синтезуiться багатьма мiкроорганiзмами i утворюiться в тканинах тварин. У лiтературi фермент вiдомий пiд рiзними назвами: амiлоглюкозiдаза, γ-амiлаза, лiзосомальних α-глюкозидази, кисла мальтаза, матулаза, екзо-α-1 ,4-глюкозидази. Глюкоамiлаза каталiзуi послiдовне вiдщеплення кiнцевих залишкiв α-D-глюкози з нередуцiрующiх решт субстрату. Цей фермент проявляi екзогенний механiзм впливу на субстрат. Багато глюкоамiлази володiють також здатнiстю гiдролiзувати α-1 ,6-глюкозiдние зв'язку. Однак це вiдбуваiться в тому випадку, коли за α-1 ,6-зв'язком слiд α-1 ,4-зв'язок, тому декстран ними не гiдролiзуiться. Глюкоамiлаза значно швидше гiдролiзують полiмерний субстрат, нiж олiго-i дисахариди. Майже всi глюкоамiлази i глiкопротеiдiв, що мiстять вiд 5 до 35% вуглеводiв, якi складаються з олiго-, ди- i моносахаридiв.
Майже всi глюкоамiлази i глiкопротеiдiв, що мiстять вiд 5 до 35% вуглеводiв, якi складаються з олiго-, ди-i моносахаридiв. Угле Вм водний компонент може бути цiлiсним фрагментом або ж розбитими на iндивiдуальнi сполуки, якi прикрiплюються до бiлка через треонiн i серин. Наприклад, у глюкоамiлази A. niger iх 20. Бiльшiсть вiдомих глюкоамiлаз маi оптимум при рН 4,5-5,2, рiдше - при 5,7-6,0, в основному для дрiжджових глюкоамiлаз[8].

Рисунок 2.3. Принциповий механiзм дii глюкоамiлаз[2]
Фермент пуллуланаза (пуллулан-6-глюканогiдролаза) ранiше був вiдомий пiд назвами: R-фермент, гранична декстриназа або амiлопектин-6-глюканогiдролаза. Пуллуланаза, як i α-амiлаза, i ендогенних ферментом, але на вiдмiну вiд неi здатна невпорядковано гiдролiзувати α-1 ,6-зв'язку в пуллуланi, амiлопектину, глiкогену та граничних декстрину, одержуваних при спiльному впливi на крохмаль i глiкоген α-i β - амiлаз. Якщо мiж двома α-1 ,6-зв'язками розташовано бiльше трьох залишкiв глюкози, то розрив α-1 ,6-зв'язку йде значно повiльнiше, тому амiлопектин гiдролiзуiться пуллуланазой гiрше за iнших розгалужених полiсахаридiв. Найбiльш частим вiдщеплюi фрагментом i мальтотрiоза. Пуллуланази з рiзних джерел мають рiзнi властивостi[7].
РЖзоамiлаза (глiкоген-6-глюканогiдролаза), або дебранчiнг-фермент, гiдролiз α-1 ,6-зв'язку в розгалужених полiсахаридiв, таких як амiлопектин, глiкоген, β-граничнi декстрини. Вiдмiнною особливiстю iзоамiлази в порiвняннi з пуллуланазой i те, що вона не здатна гiдролiзувати пуллулан i слабко дii на граничнi β-декстрини. Бактерiальна iзоамiлаза розщеплюi α-1 ,6-зв'язку в глiкогеннiй повнiстю, а пуллуланаза дii на цей субстрат слабо. РЖзоамiлазу утворюють багато мiкроорганiзмiв, такi як B. amyloliquefacie, Cytophaga, Streptomyces, Pseudomonas amyloderamosa, Saccharomyces cerevisiae та iн, ферменти яких мають здатнiсть гiдролiзувати субстрат при рН вiд 3,5 до 6,5 i температурах вiд 25 до 53 В° С. РЖзоамiлаза не стабiлiзуiться кальцiiм, за винятком ферменту з Cytophaga. Молекулярна маса iзоамiлаз коливаiться вiд 90 до 120 кДа.
α-глюкозидази (α-D-глюкозiдглюкогiдролаза) маi здатнiсть гiдролiзувати α-1 ,4-зв'язку вiд нередуцiрующего кiнця субстрату з вiдщеплення залишку глюкози. Фермент проявляi найбiльшу спорiдненiсть до низькомолекулярним субстрату, легко гiдролiзують мальтозу, олiгосахариди, а полiсахариди гiдролiзують повiльно або зовсiм не гiдролiзують. α-глюкозидази об'iднуi групу ферментiв i маi ряд iнших назв: мальтаза, глюкоiнвертаза, глюкозiдосахараза. Властивостi ферментiв, якi продукуються рiзними мiкроорганiзмами, можуть значно вiдрiзнятися. Фермент маi здатнiсть до перенесення α-D-глюкозiльних залишкiв на вiдповiднi акцептори, часто з утворенням α-1 ,6-зв'язкiв[5].
Декстраназа (1,6-α-D-глюкан-6-глюканогiдролаза) каталiзуi розщеплення α-1 ,6-зв'язкiв у бактерiальному полiсахариди декстрану. Серед продуцентiв декcтраназ слiд зазначити B. subtilis, B. megaterium, Lactobacillus befidus, Streptococcus mutans, Bravibacterium fuscum, Pseudomonas UQM-733, рiзнi грунтовi бактерii, а також численнi види мiкроскопiчних грибiв роду Penicilium, Aspergillus i Fusarium. Декстранази мають молекулярну масу вiд 35 до 71 кДа; вони i слабокислими бiлками. РЖзоелектричноi точка для всiх грибних декстраназ лежить в дiапазонi вiд 4,0 до 4,6. Для бiльшостi бактерiальних декстраназ оптимальна температура каталiтичноi дii 35-37 В° С; для грибних продуцентiв температура трохи вище - 55-60 В° С. Оптимальне значення рН коливаiться в залежностi вiд виду продуцента вiд 4,4 до 7,5. За допомогою ендодекстраназ можна отримувати з декстрану кровозамiнники необхiдноi молекулярноi маси; iх також використовують у стоматологii для зняття зубних бляшок, що складаються з декстраноподобних глюканов[5].

Рисунок 2.4. принциповий механiзм дii декстранази[2]
Амiлаза B. Macerans [1,4-α-D-глюкан-4-α-(1,4-α-глюкану) трансфераза (цiклiзующая)] Ця унiкальна амiлаза, яка вперше була знайдена в культурi B. macerans. Вона циклiзуi частину ланцюга 1,4-α-глюкану шляхом утворення 1,4-α-глюкозiдной зв'язку. Робоча назва цього ферменту тАУ циклодекстринглюканотрансфераза (ЦГТ-аза). При дii на крохмаль i аналогiчнi субстрати утво
Вместе с этим смотрят:
РЖсторiя виникнення та розвитку масажу
Аборты
Аденовирусная инфекция
Азотные и кислородные ванны, нафталановая нефть
Акушерська операцiя - накладання акушерських щипцiв