Гипотеза мира РНК
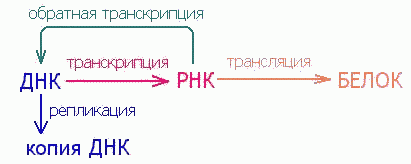
Почти полвека тому назад, в 1953 г., Д. Уотсон и Ф. Крик открыли принцип структурной (молекулярной) организации генного вещества - дезоксирибонуклеиновой кислоты (ДНК). Структура ДНК дала ключ к механизму точного воспроизведения - редупликации генного вещества. Возникла новая наука - молекулярная биология. Была сформулирована так называемая центральная догма молекулярной биологии: ДНК → РНК → белок. Смысл ее состоит в том, что генетическая информация, записанная в ДНК, реализуется в виде белков, но не непосредственно, а через родственного полимера - рибонуклеиновую кислоту (РНК), и этот путь от нуклеиновых кислот к белкам необратим. Таким образом, ДНК синтезируется на ДНК, обеспечивая собственную редупликацию, то есть воспроизведение исходного генетического материала в поколениях; РНК синтезируется на ДНК, в результате чего происходит переписывание, или транскрипция, генетической информации в форму многочисленных копий РНК; молекулы РНК служат матрицами для синтеза белков - генетическая информация транслируется в форму полипептидных цепей. При этом возникает отчетливое впечатление о значительно более разнообразных функциональных возможностях рибонуклеиновых кислот по сравнению с ДНК, существование которой связано исключительно с необходимостью сохранения и передачи из поколения в поколение наследственных признаков.
Рибонуклеиновые кислоты (РНК), присутствующие в клетках как про-, так и эукариот, бывают трех основных типов: информационная (матричная, мРНК), транспортная (тРНК) и рибосомная (рРНК). В ядре клеток эукариот содержится РНК четвертого типа - гетерогенная ядерная РНК (гяРНК). У некоторых вирусов РНК служит носителем генетической информации.
I. Современные представления, характеризующие концепцию ВлМир РНКВ»
I.1 Обратная транскрипция
Современные знания о структурном и функциональном разнообразии РНК уже не укладываются в те канонические представления об их роли в реализации генетической информации, которые возникли в самом начале развития молекулярной биологии. Представление о том, что РНК служит только инструментом трансформации генетической программы (генотипа), заложенной в структуре ДНК, в конкретный фенотип, формируемый разнообразием белков, было в значительной мере разрушено после открытия обратной транскрипции. Оказалось, что РНК может служить матрицей не только для воспроизведения своей собственной структуры в РНК-содержащих вирусных геномах, но и для биосинтеза ДНК у высших организмов. Этот процесс также используют в ходе своего развития многие вирусы, в том числе печально известные онкогенные вирусы и ВИЧ-1, вызывающий СПИД. РНК выполняет роль матричной молекулы в процессах обратной транскрипции (биосинтезе ДНК на матрице РНК) и своей собственной репликации у РНК-содержащих вирусов и фагов. В процессе обратной транскрипции роль затравки, необходимой для синтеза комплементарной цепи ДНК, выполняет тРНК. Матричные свойства РНК реализуются в процессе наращивания теломерных повторов в молекулах ДНК: РНК-матрица является важнейшим компонентом теломераз тАФ ферментов, осуществляющих синтез теломерных участков ДНК в хромосомах.
I.1.1 Репликация теломерных участков эукариотических хромосом
На концах хромосом эукариот находятся специализированные повторяющиеся последовательности ДНК, получившие название теломерной ДНК, а содержащие ее концы хромосом тАФ теломероми. В клетках животных количество хромосом, а следовательно, и теломерных участков невелико тАФ они составляют лишь небольшую часть от всех остальных последовательностей.
Использование в качестве объекта исследования теломерной ДНК ресничной инфузории Tetrahymena thermophila, в клетках которой находятся десятки тысяч мелких хромосом, а следовательно, и множество теломер, показало, что теломеры построены из коротких (содержат по 6 тАФ 8 нуклеотидных остатков) многократно повторяющихся последовательностей (блоков). При этом одна цепь ДНК обогащена остатками гуаниловой кислоты (G-богатая цепь, у тетрахимены тАФ это блок ТТGGGG), а комплементарная ее цепь обогащена остатками цитидиловой кислоты (С-богатая цепь). Теломерная ДНК человека построена из ТТАGGG-блоков, т.е. отличается от простейших всего лишь одним нуклеотидом в повторе. Из ТТАGGG-блоков построены теломерные ДНК (их богатые С-цепи) всех млекопитающих, рептилий, амфибий, птиц и рыб. Универсален и теломерный повтор (ТТТАGGG) у всех растений.
Теломеры играют важную роль в создании специфической архитектуры и внутренней упорядоченности клеточного ядра. Они предотвращают деградацию и слияние хромосом, а также ответственны за их прикрепление к специальной внутриклеточной структуре (своеобразному скелету клеточного ядра).
Механизмы репликации теломерных участков эукариотических хромосом и центральных областей ДНК принципиально различаются. Все известные ДНК-полимеразы, являющиеся ферментами сложного репликативного комплекса эукариот, неспособны полностью реплицировать концы линейных молекул ДНК. Известно, что ДНК-полимеразы, синтезируя дочернюю нить ДНК, прочитывают родительскую нить в направлении от ее З'-конца к 5'-концу. Соответственно дочерняя цепь синтезируется в направлении 5'→3'. Кроме того, ДНК-полимераза начинает синтез только со специального РНК-праймера, комплементарного ДНК. После окончания синтеза ДНК РНК-праймеры удаляются, а пропуски в одной из дочерних цепей ДНК (отстающей) заполняются ДНК-полимеразой β. Однако на З'-концевых участках ДНК такой пропуск заполнен быть не может, и поэтому они остаются однотяжевыми, а их 5'-концевые участки тАФ недореплицированными. Следовательно, при каждом раунде репликации хромосомы будут укорачиваться на 10 тАФ 20 нуклеотидов (у разных видов размер РНК-затравок различен), и в первую очередь сокращать длину теломерной ДНК. Возникла проблема Влконцевой недорепликации ДНКВ». В случае репликации кольцевых бактериальных ДНК этой проблемы не существует, так как первые по времени образования РНК-праймеры удаляются ферментом, который одновременно заполняет образующуюся брешь путем наращивания З'-ОН-конца растущей цепи ДНК, направленной в ВлхвостВ» удаляемому праймеру. Проблема недорепликации З'-концов линейных молекул решается эукариотическими клетками с помощью специального фермента тАФ теломеразы. Этот фермент был обнаружен впервые в 1985 г. у инфузории Tetrahymena thermophila, а впоследствии тАФ в дрожжах, растениях и у животных, в том числе в яичниках человека и бессмертных линиях раковых клеток НеLа.
Теломераза является ДНК-полимеразой, достраивающей 3'-концы линейных молекул ДНК хромосом короткими (6 тАФ 8 нуклеотидов) повторяющимися последовательностями (у позвоночных ТТАGGG). Согласно номенклатуре, этот фермент называют ДНК-нуклеотидилэкзотрансферазой, или теломерной терминальной трансферазой (мол. масса 103тАФ133 кДа). Помимо белковой части теломераза содержит РНК, выполняющую роль матрицы для наращивания ДНК повторами.
Длина теломерной РНК колеблется от 150 нуклеотидов тАФ у простейших до 1400 нуклеотидов тАФ у дрожжей, у человека тАФ 450 нуклеотидов. Наличие в молекуле теломеразы РНК-последовательности, по которой идет матричный синтез фрагмента ДНК, позволяет отнести теломеразу к своеобразной обратной транскриптазе, т.е. ферменту, способному вести синтез ДНК по матрице РНК. Основное назначение теломеразы тАФ синтезировать тандемно повторяющиеся блоки ДНК, из которых состоит G-цепь теломерной ДНК. Матричный участок представлен в теломеразной РНК только один раз. Его длина не превышает длину двух повторов в теломерной ДНК.
Механизм синтеза теломерных повторов, катализируемый теломеразой:
На первой стадии (связывание теломеры) происходит комплементарное взаимодействие части матричного участка теломеразной РНК с 3'-концевым выступающим одноцепочечным сегментом ДНК хромосом. При этом З'-концевой фрагмент ДНК служит затравкой для удлинения этой ДНК на РНК-матрице. На стадии элонгации выступающая цепь ДНК удлиняется до конца матрицы. Эта реакция осуществляется РНК-зависимой ДНК-полимеразной активностью теломеразы.
После удлинения выступающей цепи ДНК до конца матрицы происходит транслокация, т.е. перемещение матрицы и белковых субъединиц фермента на заново синтезированный конец теломеразной ДНК, и весь цикл повторяется вновь. После завершения удлинения одноцепочечной З'-концевой теломерной последовательности вторая цепь ДНК (С-цепь) достраивается с помощью обычной ДНК-полимеразы. Таким образом происходит решение проблемы концевой репликации ДНК у эукариот.

Рис. 1. Репликация теломерных участков эукариотических хромосом (Цитировано по [1]):
А тАФ возникновение недореплицирования 5'-конца линейной хромосомы и синтез на этом концевом участке теломерной ДНК с помощью теломеразы;
Б тАФ основные этапы синтеза теломерного повтора теломеразой
I.1.2 Механизм обратной транскрипции
На обратной транскрипции основано размножение ретровирусов (вирусы, у которых геномом служит не ДНК, как обычно, а РНК) и ретротранспозонов (являются транспозиционными элементами, которые не имеют вирионных частиц, и, следовательно, в отличие от ретровирусов, не могут независимо Влпереносить себяВ» между клетками), образование так называемых ретропсевдогенов (или процессированные псевдогены это ретропоследовательности, которые потеряли свою функцию, они несут все признаки функциональных ретропоследовательностей, но имеют молекулярные дефекты, которые не дают им экспрессироваться) и достройка кончиков хромосом (теломер), укорачивающихся при каждом клеточном делении. Если молекула ДНК повреждена тАФ например, подверглась разрыву (double-strand break, DSB) тАФ для ее починки необходима матрица, в которой последовательность нуклеотидов соответствует исходному, ВлправильномуВ» состоянию поврежденного участка. Ранее считалось, что в качестве таких матриц всегда используются другие молекулы ДНК. Позже было установлено, что иногда эти ДНК-матрицы синтезируются путем обратной транскрипции на основе РНК при участии ретротранспозонов.
При изучении ретровирусов, геном которых представлен молекулами одноцепочечной РНК, было обнаружено, что в процессе внутриклеточного развития ретровирус проходит стадию интеграции своего генома в виде двухцепочечной ДНК в хромосомы клетки-хозяина. В 1964 г. Темин выдвинул гипотезу о существовании вирусспецифичного фермента, способного синтезировать на РНК-матрице комплементарную ДНК. Усилия, направленные на выделение такого фермента, увенчались успехом, и в 1970 г. Темин с Мизутани, а также независимо от них Балтимор открыли искомый фермент в препарате внеклеточных вирионов вируса саркомы Рауса. Данная РНК-зависимая ДНК-полимераза получила название обратная транскриптаза, или ревертаза.
Каждый вирион (полноценная вирусная частица, состоящая из нуклеиновой кислоты и белковой оболочки) ретровирусов содержит две идентичные цепи РНК размером от 8000 до 10 000 нуклеотидов. Области 5'- и 3'-концов обеих цепей модифицированы, как у всех эукариотических мРНК (5'-кэпы, З'-полиадениловые хвосты). Вирусные РНК имеют 5 структурных элементов: 1) прямые повторы на 5'- и З'-концах РНК (R); 2) последовательность из 80 тАФ 120 нуклеотидов, находящуюся около 5 концевого повтора (U5); 3) последовательность из 170 тАФ 1200 нуклеотидов около З'-концевого повтора (U3); 4) последовательность из 15 20 нуклеотидов (Р), в пределах которой клеточная тРНК комплементарно взаимодействует с ретровирусной РНК, что создает праймер для синтеза первой цепи ДНК; 5) сегмент Pu, находящийся непосредственно перед повтором U3 и являющийся сайтом для праймирования второй цепи ДНК тАФ такой сегмент одинаков у РНК всех ретровирусов определенного типа.
Этапы обратной транскрипции:
1. Наращивание тРНК-праймера на матрицах U5 и R в направлении 3'→5'. Роль РНК-праймера выполняет одна из клеточных тРНК (например, триптофановая, пролиновая и т.д.). На расстоянии примерно 100 тАФ 200 нуклеотидов от 5'-конца РНК (для каждого вируса тАФ это величина постоянная) имеется участок, комплементарный З'-концевой последовательности молекулы тРНК, который используется в качестве затравки. Этот участок обычно обозначают как pbs (от англ.primer binding site участок связывания затравки). Обратная транскриптаза синтезирует сегмент ДНК, комплементарный 5'-концевой последовательности вирусной РНК. Этот сегмент принято называть (-) Влstrong-stopВ» ДНК, поскольку синтез ДНК после завершения копирования 5'-конца матрицы временно останавливается. (-) Влstrong-stopВ» ДНК содержит последовательности, комплементарные концевому району R и району U5. Таким образом, синтез ДНК начинается недалеко от 5'-конца матрицы и образуется короткий продукт. Но этот короткий продукт (-) Влstrong-stopВ» имеет последовательность, комплементарную также и З'-концу вирусной РНК, а как известно, для снятия ДНК-копии с З'-конца матрицы всегда требуется праймер. У ретровирусов комплемент З'-конца матрицы производится в ВлудобномВ» месте, а затем переносится на ВлсвоеВ» место. Это происходит следующим образом: 5'-конец вирусной РНК, образующий дуплекс с (-) Влstrong-stopВ» ДНК, разрушается под влиянием присущей обратной транскриптазе активности РНКазы Н.
2. РНКаза Н, специфичная к РНК в составе гибридного РНК-ДНК дуплекса, расщепляет сегмент РНК этого дуплекса. В результате (-) Влstrong-stopВ» (RU5) оказывается в однонитевой форме и может взаимодействовать с З'-концом (с участком R) той же самой или другой молекулы вирусной РНК, поскольку на З'-конце РНК имеется повтор R.
3. Новосинтезированная короткая цепь ДНК вместе с праймером ВлперепрыгиваетВ» на З'-конец матрицы и взаимодействует там с комплементарным ей участком К.
4. Цепь ДНК удлиняется, в качестве матрицы используется остальная часть вирусной РНК. На этой стадии в качестве затравки выступает уже (-)Влstrong-stopВ» ДНК; элонгация затравки приводит к синтезу (-) цепи ДНК, в которой отсутствует комплемент района RU5, поскольку соответствующий участок (+) матрицы был разрушен РНКазой Н.
5. К моменту завершения синтеза первой цепи ДНК большая часть вирусной РНК разрушается РНКазой Н.
6. Синтез З'-конца второй цепи ДНК.
7. Удаление тРНК и оставшегося участка вирусной (+) РНК РНКазой Н.
8. Второй прыжок, в результате которого новосинтезированная вторая цепь ДНК комплементарно взаимодействует с тРНК-связывающей последовательностью первой цепи.
9. Удлинение З'-концов каждой цепи, образование дуплекса ДНК.
Вся последовательность реакций протекает без явного участия ферментов репликации клетки-хозяина (топоизомеразы, хеликазы, праймазы, ДНК-связывающего белка, лигазы и т.д.). При этом следует отметить, что молекулы вирусных ДНК длиннее молекул вирусных РНК, которые послужили матрицей для обратной транскрипции. Действительно, к 5'-концу (+) цепи вирусной ДНК добавилась последовательность U3, а к 3 -концу этой цепи тАФ последовательность U5. В результате на концах молекулы вирус специфической ДНК появился длинный (несколько сотен нуклеотидов) концевой повтор (ДКП или LTR.), имеющий структуру U3U5.
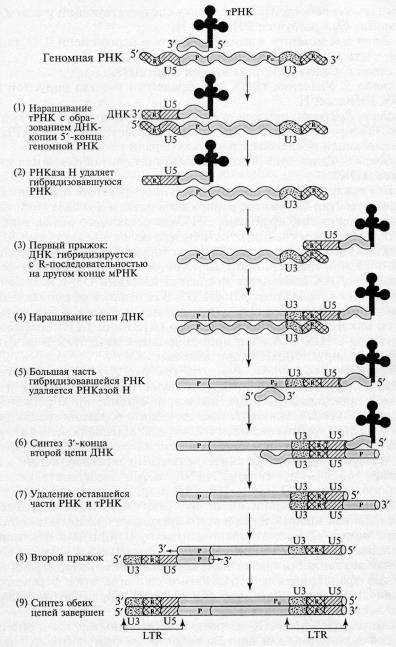
Рис.2. Схема обратной транскрипции ретровирусной РНК с образованием двуцепочечной ДНК (Darnell J., et.al. Molecular Cell Biology. тАУ N. Y.: Scientific Amer. Books, 1986. тАУ P. 1052)
Синтез ДНК на РНК-матрице in vitro и ревертаза используется в генетической инженерии для синтеза генов и их фрагментов, а также целенаправленного синтеза на матричных РНК комплементарных молекул ДНК (кДНК) для расшифровки первичной структуры РНК и белков.
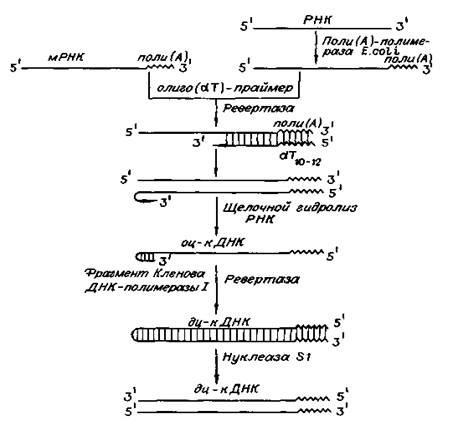
Рис. 3. Схема получения кДНК с использованием ревертазы вируса и трех дополнительных ферментов: поли (А)-полимеразы, фрагмента Кленова ДНК-полимеразы I и нуклеазы S1. (Цитировано по)
Реакцию обратной транскрипции проводят в специально подобранных условиях с использованием сильных ингибиторов РНКазной активности. При этом удается получать полноразмерные ДНК-копии целевых молекул РНК. В качестве праймера при обратной транскрипции поли (А) - содержащих мРНК используют олигo (dT)-праймер, а для молекул РНК, не имеющих З'-поли (А) концов, тАФ химически синтезированные олигонуклеотиды, комплементарные З'-концу изучаемой РНК. После синтеза на мРНК комплементарной цепи ДНК и разрушения РНК (обычно применяют обработку щелочью) осуществляют синтез второй цепи ДНК. При этом используют способность ревертазы образовывать на 3'-концах одноцепочечных кДНК самокомплементарные шпильки, которые могут выполнять функции праймера. Матрицей служит первая цепь кДНК. Данная реакция может катализироваться как ревертазой, так и ДНК-полимеразой I E. coli. Показано, что сочетание этих двух ферментов позволяет повысить выход полноценных двухцепочечных молекул кДНК. По окончании синтеза первая и вторая цепи кДНК остаются ковалентно связанными петлей шпильки, служившей праймером при синтезе второй цепи. Эту петлю расщепляют эндонуклеазой S1, специфически разрушающей одноцепочечные участки нуклеиновых кислот. Образующиеся при этом концы не всегда оказываются тупыми, и для повышения эффективности последующего клонирования их репарируют до тупых с помощью фрагмента Кленова ДНК-полимеразы I E. сoli (остающаяся часть молекулы, которая сохраняет присущие ей каталитические активности).
Уже одно это открытие формально поставило РНК в центр основного постулата молекулярной генетики, так как показало, что поток генетической информации распространяется от РНК не в одном, а в двух направлениях: не только к белку, но и к ДНК. Все более глубокое проникновение в механизмы основных молекулярно-генетических процессов (репликацию, транскрипцию и трансляцию) способствовало возникновению понятия о неканонических функциях РНК, осознанию полифункциональности рибонуклеиновых кислот.
I.2 Функциональные возможности РНК
Для того чтобы оценить значение РНК в природе в целом, следует попытаться ответить на вопрос: что могут РНК?
К достаточно давно определенным каноническим функциям РНК относятся: способность выполнять роль мессенджера при передаче наследственной информации о структуре белка от ДНК к белоксинтезирующему аппарату клеток (мРНК), участвовать в формировании структуры рибосом (рРНК), обеспечивать специфическое акцептирование и перенос аминокислот к рибосомам (тРНК).
Вместе с тем РНК свойственны особые неканонические функции, реализуемые на разных этапах программы жизни тех или иных организмов.
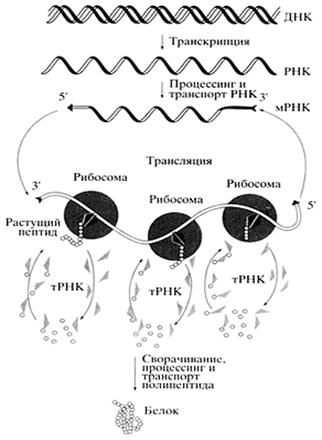
Рис. 4 Общая схема биосинтеза белка (Цитировано по Спирину А.С.)
В биосинтезе белка (трансляции) РНК безусловно играет определяющую роль. Различные по структуре рРНК формируют основу субчастиц рибосомы и определяют взаимодействие субчастиц при сборке полной рибосомы. Присоединение мРНК к рибосоме детерминируется комплементарным взаимодействием определенных участков мРНК и рРНК. Активация аминокислот, их специфическое акцептирование и доставка к рибосомам осуществляется тРНК. Кодон-антикодоновое взаимодействие между мРНК и тРНК обеспечивает перевод нуклеотидной последовательности информационных макромолекул в аминокислотную последовательность синтезируемых белков. Сама реакция образования пептидной связи (транс-пептидирование) и продвижение рибосомы по мРНК (транслокация) также, по всей видимости, связаны с функционированием рРНК. Пространственная структура мРНК непосредственно влияет на скорость трансляции, а ее способность взаимодействовать с разнообразными регуляторными белками, особенно характерная для высших эукариот, является основой для тонкой регуляции биосинтеза белка.
При ВлвключенииВ» гена происходит локальное расплетение спирали ДНК. Затем с гена, кодирующего белковую молекулу, синтезируется его РНК-копия. После ряда ВлпревращенийВ» она становится матричной РНК, т. е. матрицей для синтеза белка. мРНК переносится из ядра клетки в цитоплазму, где связывается с рибосомами, на которых и ВлпроизводитсяВ» белок. Он синтезируется из активированных аминокислот, присоединенных к специальным транспортным РНК.
В процесс трансляции вовлечено множество макромолекул и макромолекулярных комплексов. При трансляции происходит считывание генетической информации, заключенной в мРНК, рибосомами и ее передача полипептидным цепям белков, т.е. биосинтез полипептидных цепей, последовательность аминокислот в которых определена последовательностью нуклеотидов в мРНК в соответствии с генетическим кодом.
Свободные аминокислоты не узнаются рибосомами. Чтобы это произошло, аминокислоты должны поступать в рибосомы в виде конъюгатов с тРНК (аминоацилированных тРНК), последовательности нуклеотидов которых распознаются аппаратом трансляции. В каждой молекуле тРНК имеется участок из трех нуклеотидов, комплементарный кодону мРНК. Именно эта последовательность, называемая
антикодоном
, определяет положение аминокислоты в полипептидной цепи. В ходе каждого индивидуального акта трансляции
рибосома распознает кодон мРНК и в соответствии с ним выбирает аминоацилированную тРНК, антикодон которой соответствует транслируемому кодону. После этого происходит соединение посредством пептидной связи очередной аминокислоты с С-концевой аминокислотой растущей цепи полипептида.
Таким образом, во время трансляции рибосома после связывания мРНК начинает последовательно, кодон за кодоном, перемещаться вдоль матрицы, выбирая из окружающей среды молекулы аминоацилированных тРНК. При этом каждый индивидуальный акт трансляции завершается присоединением выбранной молекулы аминокислоты к С-концевой аминокислоте синтезируемой цепи белка посредством пептидной связи.
Процесс биосинтеза белка рибосомами, как и биосинтез любой другой макромолекулы клетки, условно разделяют на три этапа: инициацию, элонгацию и терминацию.
Во время инициации трансляции происходит сборка нативной
70S
или
80S рибосомы на транслируемой мРНК и подготовка к образованию пептидной связи между первыми двумя N-концевыми аминокислотными остатками синтезируемого полипептида.
При элонгации происходит последовательное удлинение растущей цепи полипептида аминокислотными остатками, а терминация трансляции сопровождается прекращением синтеза полипептида и его высвобождением из трансляционного комплекса. При этом наблюдается разделение рибосомы и мРНК, после чего они вступают в новый цикл трансляции.
В ходе трансляции рибосома последовательно перемещается вдоль транслируемой молекулы мРНК, считывая заключенную в ней генетическую информацию в виде триплетного генетического кода. Трансляция начинается в 5'-концевой части мРНК, а завершается в ее 3'-концевой части. При этом биосинтез полипептида начинается с его N-концевой аминокислоты [3].
РНК участвуют в репликации ДНК, выступая в роли затравок (праймеров), необходимых для инициации синтеза комплементарных цепей ДНК. Особая ВлантисмысловаяВ» РНК (РНК I) выполняет роль регулятора инициации репликации ДНК в точках начала репликации, обладая возможностью связывать праймеры и тем самым останавливать биосинтез ДНК.
В процессе транскрипции (биосинтезе РНК на матрице ДНК) большое значение имеет способность РНК образовывать разнообразные элементы вторичной структуры (шпильки), которые влияют как на инициацию, так и на терминацию синтеза РНК. РНК активно участвует в процессе своего собственного созревания тАФ процессинге первичных транскриптов (про-РНК). У примитивных одноклеточных организмов выявлена способность РНК к аутостайсингу тАФ вырезанию некодирующих участков (интронов) и сшиванию кодирующих фрагментов (экзонов) без участия белков-ферментов. У организмов, утративших способность к аутосплайсингу, в сплайсировании РНК тем не менее принимают участие особые молекулы тАФ малые ядерные РНК (мяРНК), необходимые для безошибочного вычленения интронов из молекул РНК-предшественников.
Посттрансляционные модификации синтезированных в ходе трансляции полипептидов, в результате которых образуются функционально активные молекулы, также нередко сопряжены с присоединением к ним значительных по размерам молекул РНК. Таким путем возникают РНК-содержащие ферменты тАФ рибонуклеопротеины - комплекс РНК
и белка; среди рибонуклеопротеинов
наибольшей функциональной значимостью обладают информосомы, а также РНП-частицы, участвующие в процессинге мРНК
(сплайсомы, РНКаза и др.), теломеразы.
Информосомы, частицы, присутствующие в животных клетках и состоящие из высокомолекулярной (нерибосомной) рибонуклеиновой кислоты (РНК) и особого белка. Информосомы обнаружены впервые советским биохимиком А. С. Спириным с сотрудниками в 1964 в цитоплазме зародышей рыб, где они представлены смесью частиц разных размеров Отношение массы РНК к массе белка в информосомах постоянно (около 1:4) и одинаково у всех частиц, независимо от их размера. Аналогичные частицы найдены в клетках млекопитающих, в том числе зараженных вирусами, а также у иглокожих и насекомых. В них содержится, по-видимому, информационная РНК (иРНК) - отсюда название. Белок информосом служит, вероятно, для переноса иРНК из ядра в цитоплазму, а также для защиты иРНК от разрушения и регуляции скорости белкового синтеза.
Малые ядерные РНК присутствуют в ядрах в комплексах с белками, получившими название малые рибонуклеопротеиновые частицы (мяРНП). Стабильным компонентом мяРНП является белок фибрилларин тАФ очень консервативный по структуре белок с молекулярной массой 34 кДа, локализованный в ядрышках. Комплекс, состоящий из множества мяРНП, который катализирует сплайсинг ядерных про-мРНК, носит название сплайсингосомы. Сплайсингосома собирается на интроне перед его выщеплением и содержит несколько различных мяРНП. Малые ядерные РНП собираются в сплайсингосомы в определенной последовательности.
И наконец, нельзя обойти вниманием тот факт, что многие катализаторы белковой природы (ферменты), катализирующие различные биохимические превращения в клетке, функционируют благодаря содержанию в них коферментов рибонуклеотидной природы (NAD, FAD, АТР и др.).
I.3 тмРНК
Помимо основных видов РНК существует особый вид - тмРНК (10Sа РНК) - небольшая стабильная молекула, совмещающая в себе свойства транспортной и матричной РНК. Хотя тмРНК была открыта более 20 лет назад в пост-рибосомном супернатанте, полученном из клеток Escherichia coli ее функция была установлена только в 1996 году. тмРНК Е. coli состоит из 363 н. В современной модели вторичной структуры тмРНК Е. coli, основанной на сравнительном филогенетическом анализе нуклеотидных последовательностей тмРНК из 50 организмов, можно выделить три района. Первый включает 3'- и 5'-концы молекулы и образует тРНК-подобную структуру, состоящую из аминоакцепторного стебля и ТΨС-шпильки. Второй район представляет собой одноцепочечный участок, кодирующий tag-пептид, а третий соединяет тРНК - и мРНК-подобные части молекулы. Этот район сильно структурирован и содержит четыре псевдоузла (рк1, рк2, рк3 и рК4).
Матричная часть тмРНК кодирует пептид, являющейся сигналом узнавания специфическими протеазами (tag-пептид). тРНК-подобная часть может быть аминоацилирована. В аминоацилированном состоянии тмРНК взаимодействует с рибосомой, запрограммированной мРНК, в которой в результате случайной деградации отсутствует стоп-кодон. В результате такие рибосомы оказываются "арестованными", они не могут освободиться от мРНК, тРНК и пептида и не могут участвовать в трансляции нужных клетке мРНК. После взаимодействия с тмРНК трансляция переключается на матричную часть этой РНК, что приводит к считыванию tag-пептида, кодируемого матричной частью мРНК. В результате tag-пептид присоединяется к недосинтезированному пептиду, который содержится в рибосоме до ее взаимодействия с тмРНК. При этом происходит терминация трансляции на стоп-кодоне матричной части тмРНК, а пептид, освободившийся из рибосомы, содержит участок, узнаваемый специфическими протеазами, что способствует его быстрой деградации.
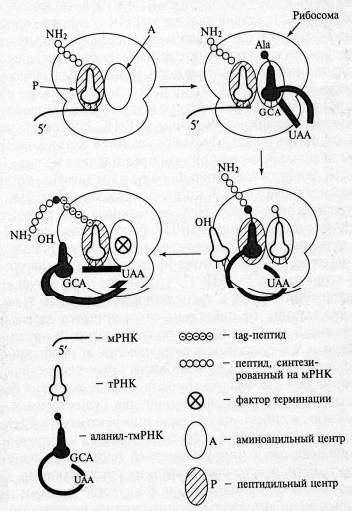
Рис. 5. Схема транс-трансляции (Цитировано по Зверевой М.Э. и соавт.)
В 1996 г. Кейлер предложил в качестве механизма функционирования тмРНК модель транс-трансляции (биосинтез полипептидной цепи белка с использованием различных матричных последовательностей). Она предлагает механизм синтеза дополнительного пептида, основанный на наблюдении, что добавление нового пептида происходит в случае трансляции мРНК, в которой отсутствует стоп-кодон. Согласно этой модели, заряженная аланином тмРНК входит в А-центр рибосомы тогда, когда трансляция останавливается на З'-конце поврежденной мРНК, не содержащей стоп-кодон. Остановившаяся пептидная цепь переносится на аланил-тмРНК (реакция транспептидирования), и рибосома продолжает синтез по матричной части тмРНК. Синтез продолжается до поступления в А-центр стоп-кодона тмРНК, после чего вступает в действие фактор терминации и трансляция завершается. В результате гибридный белок, состоящий из пептидов, соединенных аланином из тмРНК, уходит из рибосомы, а освободившаяся рибосома может участвовать в синтезе другого белка.
Особенность такой транс-трансляционной системы состоит в том, что одна пептидная цепь синтезируется с двух различных молекул мРНК. Необходимо отметить, что способ установления рамки считывания (ОРС) матричной части тмРНК отличен от всех известных способов установления рамки считывания. Первая включаемая аминокислота не определена обычным кодон-антикодоновым взаимодействием, а аденозиновый остаток, отстоящий на 3 н. в 5'-направлении от первого транслируемого кодона, важен для транс-трансляции. В природных тмРНК этот аденозин находится в центре таких триплетов, как UАА и UАG, которые обычно узнаются с помощью фактора терминации. Возможно, для установления правильной ОРС тмРНК необходим фактор терминации. Это предположение требует дальнейшего экспериментального подтверждения.
С помощью тмРНК клетка решает две задачи: с одной стороны, освобождаются остановившиеся рибосомы, а с другой, неправильные белки быстро расщепляются специфической протеазой, узнающей сигнальный пептид, кодируемый матричной частью тмРНК. тмРНК активно исследуется на протяжении последних лет. Это связано с открытием процесса транс-трансляции, а именно с возможностью синтеза одного белка на основе двух различных мРНК. Способность тмРНК объединять в одной молекуле функции тРНК и мРНК и присоединять аланин из тРНК-части без обычного кодон-антикодонового взаимодействия делает тмРНК интересным объектом исследований. Кроме того, отсутствие тмРНК у высших организмов указывает на возможность ее использования в качестве хорошей мишени при создании новых антибактериальных средств. Функция тмРНК особенно важна для жизнедеятельности бактерий при повышенных температурах. Известно, что многие бактериальные инфекции сопровождаются повышением температуры, поэтому создание препарата, блокирующего функцию тмРНК, приведет к гибели бактерий и не повлияет на биосинтез белков человека.
I.4 Интерференция РНК
Одним из наиболее важных механизмов регуляции экспрессии генов является интерференция РНК. Регуляция экспрессии эукариотических генов может осуществляться на нескольких уровнях: во время транскрипции, на стадии процессинга РНК, при трансляции и на уровне созревания белка. В последнее время в связи с открытием явления интерференции РНК большое внимание ученых привлекает посттранскрипционный уровень регуляции.
Интерференция РНК - высокоспецифичный механизм подавления экспрессии гена на посттранскрипционном уровне за счет деградации считанной с него мРНК. Деградация мРНК происходит в результате комплементарного связывания комплексов, содержащих малые интерферирующие РНК (siРНК), которые относятся к семейству малых РНК, и белки, в том числе эндонуклеазы. Малые РНК - регуляторные некодирующие РНК размером от 19 до 28 н., образующиеся в клетке из более длинных двухцепочечных РНК (дцРНК). Малые РНК могут регулировать экспрессию генов не только посредством интерференции, но также подавляя трансляцию, транскрипцию или способствуя удалению гена-мишени из клеточного генома. Последнее наблюдается у некоторых простейших в процессе созревания макронуклеуса. Феномен интерференции РНК обнаружен у различных эукариотических организмов, в частности, у одноклеточных, низших грибов, растений, нематод, насекомых, а также у позвоночных, включая мышей и человека. Подобная высокая консервативность механизма интерференции РНК свидетельствует о его большой значимости. И хотя функции некоторых видов малых РНК до сих пор не установлены, предполагают, что основная их роль - защита генома клетки от внедрения мобильных генетических элементов (вирусов, транспозонов), а также участие в регуляции дифференцировки многоклеточных организмов.
Малые РНК представляют значительный интерес для фундаментальной молекулярной биологии и таких прикладных ее областей, как биомедицина и биотехнология. Одним из наиболее эффективных способов изучения функции гена является анализ фенотипа организмов, у которых этот ген не экспрессируется. Существует ряд методов, позволяющих подавлять экспрессию определенных генов, в том числе, использование антисмысловых олигонуклеотидов, рибозимов, химических блокаторов, а также разрушение нужного гена во всем организме путем внесения соответствующих мутаций в зиготу. Однако эти методики либо сложны, либо не всегда эффективны и не обеспечивают полного сайленсинга гена (т.е. подавления экспрессии) в экспериментальных моделях млекопитающих. В отличие от перечисленных методик, технологии, основанные на явлении интерференции РНК (деградация мРНК при введении в клетку соответствующих им 81РНК или экспрессирующих их конструкций), просты в исполнении, эффективны и обладают большой специфичностью распознавания молекулы-мишени.
Выделяют два основных типа малых регуляторных РНК: малые интерферирующие РНК (siРНК) и микроРНК (miРНК). Биохимически и функционально это молекулы практически неразличимы, и принцип их подразделения основан на природе предшественников.
siРНК - малые дцРНК длиной 19-25 п.н. образуются из длинных дцРНК.
miРНК - малые оцРНК длиной 18-24 н. образуются из внутримолекулярных двухцепочечных структур (шпилек) РНК-предшественниц, транскрибируемых с генов, содержащих повторяющиеся инвертированные последовательности (палиндромы).
По происхождению малые РНК можно разделить на экзогенные (индуцируемые или кодируемые вирусами, либо введенные искусственно) и эндогенные (образующиеся при транскрипции собственных генов клетки).
Сигналом для инициации интерференции РНК служит появление в клетке экзогенной (вирусной или введенной в ходе эксперимента) либо эндогенной (транскрибированной с собственных генов клетки) дцРНК. Эффективность интерференции РНК прямо зависит от длины молекулы дцРНК: чем длиннее дцРНК, тем больше siРНК образуется, и тем большее число сайтов-мишеней на молекуле мРНК будет распознано. Минимальный размер дцРНК, достаточный для индукции интерференции, - 26 п.н. Скорее всего, такое ограничение защищает от деградации собственную клеточную мРНК с короткими внутримолекулярными самокомплементарными структурами. дцРНК распознается и нарезается ферментом Dicer. Молекула Dicer содержит N-концевой хеликазный домен - РАZ, функция которого не совсем ясна, парные РНКазные домены, а также расположенный на С-конце домен, необходимый для распознавания и связывания дцРНК. Предполагают, что расщепление дцРНК у млекопитающих осуществляется последовательно с одного конца молекулы. При этом происходит АТР-зависимая транслокация Dicer вдоль молекулы дцРНК.
В результате работы Dicer образуются двухцепочечные siРНК длиной 20-25 п.н. (видоспецифический признак). Эти молекулы содержат гидроксильные группы на З'-концах и фосфатные на 5'-концах, а также по два выступающих неспаренных нук
Вместе с этим смотрят:
Бодрствование - нейрофизиологический процесс человека
Генетична iнформацiя
Деятельность центральной нервной системы
Естественнонаучные представления Алкмеона
Естествознание в системе наук