Барий и его соединения
Реферат
Барий и его соединения
Выполнил студент: Глушков А.М
Принял преподаватель:
Красноярск, 2002 г.
Содержание
ВВЕДЕНИЕ. 3
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. 3
ПОЛУЧЕНИЕ МЕТАЛЛИЧЕСКОГО БАРИЯ. 4
Термическое разложение гидрида и Ва(NH3)6 6
Электролиз хлорида бария. 6
Очистка. 6
ХИМИЧЕСКИЕ И ФИЗИЧЕСКИЕ СВОЙСТВА. 6
ПРИМЕНЕНИЕ. 8
СОЕДИНЕНИЯ (ОБЩИЕ СВОЙСТВА) 8
Неорганические соединения. 9
ПОЛУЧЕНИЕ ТИТОНАТА БАРИЯ. 12
Использование титоната бария в радиоэлектронике. 15
Список использованных источников. 16
ВВЕДЕНИЕТяжелый шпат, BaSO4, был первым известным соединением барин. Его открыл в начале XVII в. итальянский алхимик Касциароло. Он же установил, что этот минерал после сильного нагреВнвания с углем светится в темноте красным светом и дал ему название Влляпис соларисВ» (солнечный камень).
Окись бария ВаО открыл в 1774 г. Шееле. Он назвал ее Влтяжелой землейВ». В 1797 г., прокаливая нитрат бария, Вокелен получил : окись бария. Карбонат бария был открыт в 1783 г. в Шотландии , и назван ВлвитеритомВ».
Металлический барий впервые получил Дэви в 1808 г. Название , ВлбарийВ» происходит от слова ВлбарисВ» (тяжелый).
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ В природе барий встречается в виде соединений (сульфатов, карбонатов, силикатов, алюмосиликатов и т.д.) в различных минералах. Содержание бария в земной коре 0,05 вес. % тАФ больше, чем содержание стронция. Ниже перечислены важнейшие минералы бария:
Барит (персидский шпат), BaSO4, содержит 65,7 Ва0, встреВнчается в виде гранул или бесцветных прозрачных трубчатых кристаллов (иногда окрашенных примесями в желтый, коричневый, красВнный, серый, голубой, зеленый или черный цвет) с плотностью 4,3тАФ4,7 г/см3и твердостью 3тАФ3,5 по шкале Mooca. Залежи барита есть в России, США, Франции, Румынии и других странах. В природе встречаются разновидности барита, которые содержат сульфат стронВнция (баритоцелестин), сульфат свинца и радия.
Барит применяют в химической промышленности для получения солей бария, используемых в пиротехнике, производстве красок и лаков, бумажной промышленности, для приготовления фотобуВнмаги, цементирования рыхлых пород во время бурения нефтяных скважин, защитной облицовки стен рентгеновских камер.
Витерит, ВаСОз, содержит 77,7% Ва0. Встречается в небольших количествах в России, Англии, Японии, США. Это белая масса с сероВнватым или желтым оттенком; твердость 3тАФ3,5 по шкале Mooca, плотность 4,25тАФ4,35 г/см". Некоторые разновидности витерита содерВнжат карбонат кальция или карбонат стронция (ВаСО3*СаСО3, ВаСО3*SrСО3).
Гиалофан (бариевый полевой шпат) K2Ba[AI2Si4O12], встречается в виде прозрачных бесцветВнных (или окрашенных примесями в желтый, голубой, красный цвета) моноклинных кристаллов с плотностью 2,6тАФ2,82 г1смР.
Известны также другие минералы бария:
бариевый брюстериг SrBa[Al2Si6O16(OH)2]*3H20, бариевый апатит [Ba10(PO4)6]Cl2, бариевая селитра Ba(NO3)2
Соединения бария найдены во многих силикатных и известняВнковых породах, подземных и морских, водах, на солнце.
ПОЛУЧЕНИЕ МЕТАЛЛИЧЕСКОГО БАРИЯМеталлический барий получают металлотермическим восстановВнлением окиси или хлорида бария, термическим разложением гидрида и нитрида бария или Ba(NH.3)e, электролизом расплавленного хлоВнрида бария (смесей BaCl2 и NaCI, BaCI2 и BaF2) или насыщенного раствора BaCI2*H2O на ртутном катоде. Во избежание контактов с воздухом все эти процессы ведут в вакууме или защитной атмосфере. В процессе промышленной переработки барита или витерита получают хлорид или окись бария, из которых металлотермическим восстановлением вырабатывают технический барий (см. схему 1).
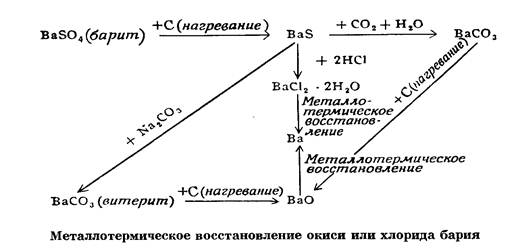
Схема 1 Восстановление окиси или хлорида бария
В промышленности металлический барий получают термическим восстановлением окиси бария порошком металлического алюминия (избыток) при температуре 1200тАФ1250В°. Процесс идет в вакууме (0,1 мм рт. ст.).
ЗВаО + 2А1 = ЗВа + Аl2О3 тАФ 25 ккал
Восстановление проводится в кварцевых или герметичных фарфоровых капсулах. После удаления воздуха током водорода в них создается вакуум, затем окись бария и порошок алюминия в течеВнние 2тАФ3 час нагревают при температуре 1250В°. По окончании восстаВнновления нагревание прекращают. После охлаждения перед разборВнкой установки в нее подают сухой воздух.
Силикотермическое восстановление окиси бария проводится в вакууме в стальной трубке (температура 1200В°):
ЗВаО + Si = 2Ва + ВаSiO3 тАФ 37 ккал
В процессе магнийтермического восстановления окиси бария в вакууме получается металлический барий. В этом случае обраВнзуется промежуточный окисел Ba2O:
2ВаО + Mg = Ba2O + Mg0 Вa2О = Ва0 + Ва
При цинкотермическом восстановлении окиси бария в вакууме образуется сплав цинка и бария.
Металлотермическое восстановление хлорида бария натрием, калием или металлическим цинком в вакууме приводит к образоваВннию сплавов бария с натрием, бария с калием и бария с цинком. Если восстановление хлорида бария идет при нагревании с карбиВндом кальция CaC2, образуется сплав бария и кальция.
Термическая вакуумная диссоциация гидрида бария (900тАФ1000В°), нитрида Ва3N2 (160тАФ180В°) и Ва(NH3)6 (комнатная температура) сопровождается образованием металлического бария.
При электролизе расплавленного хлорида бария (или расплавленВнной смеси BaCl2тАФ NaCI, BaCl2 тАФ BaF2) с расплавленным свинцоВнвым или оловянным катодом образуются сплавы бария со свинцом или оловом. Во время электролиза насыщенного раствора хлорида бария на ртутном катоде образуется амальгама бария.
Электролитический метод вследствие трудоемкости практически не используется в промышленности.
Сырой металлический барий очищают перегонкой в вакууме (1тАФ1,5 мм рт. ст., температура 800В°) в аппаратуре, подобной приВнменяемой для очистки магния.
ХИМИЧЕСКИЕ И ФИЗИЧЕСКИЕ СВОЙСТВАБарий тАФ белый серебристый металл с объемно-центрированной кубической решеткой (модификация α-Ва устойчива ниже 375В°, модификация β-Ва тАФ от 375 до 710В°). Плотность бария 3,74 г1см3, твердость 3 по шкале Мооса (тверже свинца). Ковкий металл. При загрязнении ртутью становится хрупким. Т. пл. 710В°, т. кип. 1696В°. Соли бария окрашивают пламя газовой горелки в желто-зеленый цвет.
Самый важный радиоактивный изотоп бария тАФ (β- и γ-активный 140Ва тАФ образуется при распаде урана, тория и плутония; период полураспада 13,4 дня.140Ва извлекают хроматографически из смеси продуктов распада. Распад изотопа 140Ва сопровождается выделеВннием радиоактивного 140La.
При облучении цезия дейтронами образуется ядерный изотоп 133Ва с периодом полураспада 1,77 дней. Со свинцом, никелем, сурьВнмой, оловом и железом барий образует сплавы.
Барий химически активнее кальция и стронция. Металлический барий хранят в герметичных сосудах под петролейным эфиром или парафиновым маслом. На воздухе металлический барий теряет блеск, покрывается коричневато-желтой, а затем серой пленкой окиси и нитВнрида:
Ва + 1/202 = Ва0 + 133,1 ккал.
ЗВа +N2= Ba3N2 + 89,9 ккал
Под действием галогенов металлический барий образует безводВнные галогениды ВаХ2 (X == F ˉ, С1ˉ , Вг ˉ, I ˉ ). Металлический барий разлагает воду:
Ва + 2Н2О = Ва(ОН)2 + 112 + 92,5 ккал
Растворение металлического бария в жидком аммиаке (тАФ40") сопровождается образованием аммиаката Ba(NH3)6-При обычной температуре барий реагирует с двуокисью углерода:
5Ва + 2C02 = ВаС2 + 4Bа0
Металлический барий тАФ сильный восстановитель. С его помощью при восстановлении хлорида америция (1100В°) и фторида кюрия (1300В°) были получены элементы америций (N 95) и кюрий (N 96). При высокой температуре барий восстанавливает закись углерода, а выдеВнляющийся свободный углерод реагирует с барием с образованием карбида ВаС2.
Приведенная ниже схема иллюстрирует химическую активность бария.

Растворимые соли бария чрезвычайно ядовиты. Введенный внутривенно хлорид бария мгновенно вызывает смерть. Карбонат и сульфит бария ядовиты, так как они растворяются в соляной кислоте, которая содержится в желудочном соке.
ПРИМЕНЕНИЕМеталлический барий применяется для металлотермического восВнстановления америция и кюрия, в антифрикционных сплавах на осноВнве свинца, а также в вакуумной технике. Сплавы свинец тАФ барий вытесняют полиграфические сплавы свинец тАФ сурьма.
СОЕДИНЕНИЯ (ОБЩИЕ СВОЙСТВА)Известны многочисленные соединения, в которых барий присутВнствует в виде двухвалентного катиона. Ион Ва2+ бесцветен, имеет устойчивую восьмиэлектронную конфигурацию. Радиус иона 1,34 А. Он обладает относительно большим объемом и слабо выраженной тенденцией к поляризации, поэтому не образует устойчивых комВнплексных соединений. Гидроокись Ba(OH)g представляет собой сильВнное основание.
Гидрид бария, ВаН2, получают нагреванием металлического бария, сплавов кадмий тАФ барий, ртуть тАФ барий или окиси бария в атмосфере водорода:
Ва + Н2= ВаН2 + 55 ккал Ва0+ 2Н2 = BaH2 + Н2О
BaH2 тАФ серовато-белые кристаллы с плотностью 4,21 г/см3. Выше 675В° они подвергаются термической диссоциации. Гидрид бария разлагает воду и взаимодействует с азотом, соляной кислотой и аммиаком.
Гидрид бария применяют в качестве катализатора реакций гидроВнгенизации.
Окись бария, ВаО, получают непосредственным синтезом из элеВнментов. Кроме того, используют термическое разложение гидроокиси, перекиси, карбоната или нитрата бария. Применяют также прокалиВнвание смеси карбоната бария с углем, сульфата бария с односерниВнстым железом или нагревание сульфида бария с окисью магния и водой.
ВаО представляет собой кубические (решетка типа NaCI) или гексагональные бесцветные кристаллы (или белый аморфный пороВншок), очень гигроскопичные, с плотностью 5,72 г/см3 (для кубичеВнской модификации) и 5,32 г/см3 (для гексагональной) и твердостью 3,3 по шкале Mooca; т. пл. 1923В°, т. кип. 2000В°. Ва0 люминесцирует под действием ультрафиолетовых лучей и фосфоресцирует в рентгеВнновских лучах.
Растворяясь в воде, окись бария дает гидроокись бария Ba(OH)2. В отличие от окислов кальция и стронция окись бария при темпераВнтуре 500В° в заметных количествах поглощает двуокись углерода. На холоду окись бария взаимодействует с хлором, а при нагреВнвании тАФ с кислородом, серой, азотом, углеродом, двуокисью серы, сероуглеродом, двуокисью кремния, двуокисью свинца, окисью железа, хрома, а также с солями аммония.
При нагревании окись бария восстанавливается магнием, цинВнком, алюминием, кремнием и цианидами щелочных металлов.
Окись бария применяют для изготовления стекла, эмалей и термо' катализаторов. В результате замещения в цементе окиси кальция окисью бария получают цементы с исключительной устойчивостью по отношению к воде, содержащей сульфат-ионы.
Перекись бария, ВаО2, получают, сильно прокаливая гидроокись, нитрат или карбонат бария в токе воздуха в присутстВнвии следов воды. Другие способы получения: непосредственный синтез из элементов при нагревании, прокаливание окиси бария с окисью меди, нагревание окиси бария с хлоратом калия, нагревание окиси бария до 350В°, дегидратация кристаллогидрата
BaO2*8H2O при 120В°:
Ва + 02 = Ва02 + 145,7 ккал Ba0 + СиО = Ва02 + Сu
Ba0 +1/2 02 = Ва02 + 12,1 ккал 3ВаО + КclO3 = ЗВа02 + КСl
Ba02 представляет собой белый парамагнитный порошок с плотВнностью 4,96 г1см3 и т. пл. 450В°. Он разлагается до Ba0 (600В°) или до кислорода (795В°), устойчив при обычной температуре (может храниться годами), плохо растворяется в воде, спирте и эфире, растворяется в разбавленных кислотах.
Термическое разложение перекиси бария ускоряют окислы - СеО, Cr2O3,
Fe2 O3 и Cu0.
Известны кристаллогидраты BaO2*8H2O и BaO2H2O. Октагид-рат Ba02тАвH2O получают действием перекиси водорода на бариВнтовую поду в слабощелочных растворах, а также обработкой на холоду раствора хлорида пли гидроокиси бария перекисью натрия:
Ва(ОН)2 + H2O2 + 6H2O = Ва02*8Н2О
BaO2*8H2O выделяется в виде бесцветных гексагональных криВнсталлов, трудно растворимых в воде, спирте, эфире. Нагретое с переВнкисью водорода это соединение превращается в желтое вещество тАФ надперекнсь бария ВаО^.
Перекись бария реагирует при нагревании с водородом, серой, углеродом, аммиаком, солями аммония, феррицианидом калия и т. д.
С концентрированной соляной кислотой перекись бария реагирует, выделяя хлор:
ВаO2 + 4НС1конц. = BaCl2 + Cl2 + 2H2O
Перекись бария восстанавливает соли благородных металлов (обладающие малой химической активностью) до соответствующего металла. Перекись бария применяют для получения перекиси водоВнрода, в зажигательных бомбах, а также в качестве катализатора крекинг-процесса.
BaO2тАвH2O2 представляет собой желтые моноклинные микрокриВнсталлы, устойчивые при 0В°, трудно растворимые в обычных раствоВнрителях.
Гидроокись бария, Ва(ОН)2, получают действием воды на металВнлический барий или ВаО. Используют также обработку растворов солей бария (особенно нитрата) щелочами. В промышленности приВнменяют действие перегретого пара на сульфид бария. С этой же целью можно нагреть до 175" (под давлением) метаспликат бария BaSiOs с раствором NaOH. Описан метод, основанный на восстановВнлении перекиси бария при 550В°:
Ba(OH)2тАФ белый порошок с плотностью 4,495 г/см3 и т. пл. 408В°. В катодных лучах гидроокись бария фосфоресцирует желто-оранВнжевым цветом. Растворяется в воде, трудно растворима в ацетоне и метплацетате.
При растворении Ва(ОН)2 в воде получается бесцветный раствор с сильно щелочной реакцией тАФ баритовая вода, которая в присутВнствии двуокиси углерода быстро покрывается поверхностной пленВнкой карбоната бария.
Известны кристаллогидраты Ва(ОН)2*8Н2О, Ва(ОН)2*7H2O, Ва(ОН) тАв2Н2O и Ва(ОН)2*H2O. Кристаллогидрат Ва(ОН)2*8H2O выделяется в виде бесцветных моноклинных призм с плотностью 2,18 г/cм3 и т. пл. 78В°. При нагревании до 650В° в токе воздуха криВнсталлогидрат превращается в окись или перекись бария.
Пропускание хлора через баритовую воду сопровождается обраВнзованием хлорида, хлората и очень незначительных количеств гино-хлорита бария:
6Ва(ОН)2 + 6CL2= 5BaCl2 + Ва(ClO3)2 + 6H2О
Баритовая вода реагирует при 100В° с сероуглеродом:
2Ва(ОН)2 + CS2= ВаСО3 + Ba(HS)2 + H2O
Металлический алюминий взаимодействует с баритовой водой с образованием гидроксоалюмината бария и водорода:
2Аl + Ва(ОН)2 + 10H2O = Ba[Al(OH)4(H2O)2]2+3H2
Выше 1000В° гидроокись бария подвергается термической диссоциации:
Ва(ОН)2 → ВаО + Н2O
Баритовая вода Ва(ОН)2 применяется в качестве очень чувствиВнтельного химического реактива на двуокись углерода.
Фторид бария, BaF2, получают непосредственным синтезом из элементов, действием фтористого водорода на окись, гидроокись, карбонат или хлорид бария, обработкой баритовой воды фтористо-водородной кислотой, обработкой нитрата или хлорида бария фто-ридом натрия или калия, а также сплавленном хлорида магния с фторидом кальция или магния в атмосфере CO2 и термическим разложением гексафторосиликата бария в атмосфере инертного газа.
Бесцветные кубические кристаллы BaF2 имеют решетку типа CaF2 с расстоянием между центром иона Ва2+ и иона Fֿ 2,68 А. Плотность 4,83 г/см3, т.пл. 1280В°, т. кип. 2137В°. Кристаллы мало растворимы в воде (1,63 г/л при 18В°), растворяются в фтористоводо-родной, соляной и азотной кислотах. Применяются для изготовлеВнния эмалей и оптических стекол. Температура плавления смеси BaF2*LiF 850В°, а смеси BaF2*BaCl2 1010В°.
ПОЛУЧЕНИЕ ТИТОНАТА БАРИЯПод титанатом бария понимают соединение BaO-TiO2 , в котором соотношение катионов и анионов может быть различным от BaTiO3 до Ba6Ti17O40, промежуточные вещества тАУ политканаты нестехлометричны и в них могут добавлены вещества, частично замещающие Ba и Ti, то есть проведено легирование.
BaTiO3 имеет структуру неравномерно, а с кубической гране или объёмо-центрированной кристаллической решёткой. Кубическая структура характерна до 120 В°C.
При более низких температурах происходит искажения структуры, она переходит в тирагональную, и , возникает деформация кислородной подрешётки, как Ti несколько смещается.
Деформация вызывает поляризацию. Для иона существует 2 энергетически равновесных стабильных положения, симметричных относительно центра. Направление поляризации едино внутри домена так как поляризация возникает без внешнего тАж поля, то она спонтанная. Внешнее напряжение вызывает упорядочение ориентации диполей. Между поляризацией и напряжённостью поля возникает гистерезисы.
При Т>120В°C=Тс сегнетоэлектрические свойства пропадают из за высоты симметрии кристалла (кубическая структура). При Т>Тс диэлектрическая проницаемость Еr зависит от температуры поз Кюри-Вейтса
Хорошие нелигированные вещества BaTiO3 тАУ диэлектрики. С D Е~ 3Эв. И тип энергия активации докоров 0,1 Эв. То есть при номинальной температуре эти носители полностью ионизированы. Кроме легированных элементов роль донора играет кислородные вариации при кислородной мстехлометрии за счёт отчёта.
s =rBaTiO3-1В»10ом-1м-1
NdВ»5*10^25м-3
Из РЭДС и Холла
Таким образом часть примеси носит акцепторный характер. Акцепторы захватывают электроны и на поверхности кристалита создаётся отрицательный поверхностный заряд. Отрицательный поверхностный заряд вызывает увеличение электростатического потенциала на границе зерна. Удельная проводимость зависит от высоты потенциального барьера С ростом температуры проводимость растёт. Для сохранения электронейтральности образца в приповерхностном слое кристалла возникает положительный пространственный заряд. В том слое, толщиной S подвижных носителей заряда мало и плотность. Пространственный заряда определяется практически только легирующей примесью доноров nD
r =e*nд
Внутри кристалла отсутствуют акцепторы, способные компенсировать доноры.
Если А тАУ площадь приповерхностной области с глубиной ОЗ тАЬSтАЭ, то
r*А*S тАУ приграничный тАЬ+тАЭ ОЗ
NтАЩа тАУ концентрация акцепторов, захвативших электроны, заряд ОПЗ тАЬ-тАЭ e* NтАЩа
По условию нейтронейтральности
r*А*S- e* NтАЩа=0 Во S=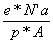 =
=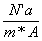
По уравнению пуассона потенциал ПЗ
Dj =-r /(x r*x 0) так как r=e*nд, a*x? S
j 0=(e/(2*nд*x r*x 0))*(NтАЩa/A)^2
b - константа, связанная с NтАЩa По полученному уравнению с ростом температуры R растёт.
В некотором интервале температур так как при высокой температуре Nа уменьшается из за высвобождения электронов с захваченных по границам зёрнен.
Использование титоната бария в радиоэлектронике Особое место среди п/п приборов с aR>0 занимают приборы на основе тинаната бария BaTiO3. В диапазоне ΔT 100 тАУ 150 K они обладают очень высоким ТКС, до 0,3К-1. Термисторы с положительным температурным коэффициентом сопротивления тАУ РТС тАУ термисторы-позисторы.
aR=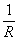
 >0 тАУ ТКС.
>0 тАУ ТКС.
Термисторы с a>0 называются РТС-термисторами или позисторами. ТКС>0 имеет большиство металлови некоторые поликристаллические п/п
Керамические позисторы имеют ТКС>0 в узком диапазоне температур. Вне этого диапазона их ТКС<0, как у обычных полупроводников.
Список использованных источников
1. Локшин Э.П., Воскобойников Н.Б. Барий. тАУ Барий и его свойства, изд.КНЦ РАН. - 1996 г. - 168 с.
2. Лебедев В.Н., Локшин Э.П., Маслобоев В.А., Дозорова Р.Б., Михлин Е.Б. Сырьевые источники металлов России и проблемы их вовлечения в переработку // Цветные металлы. - 1997. - №8. - С.46-50.
3. Гуцол А.Ф. Титонат бария // Успехи физ. наук. - 1997. - Т.167. - №6. - С.165-187.
Вместе с этим смотрят:
11-этажный жилой дом с мансардой
14-этажный 84-квартирный жилой дом
16-этажный жилой дом с монолитным каркасом в г. Краснодаре
180-квартирный жилой дом в г. Тихорецке
2-этажный 3-секционный 18-квартирный жилой дом в г. Мирном