Термодинамические характеристики расплавов на основе железа
1 ТЕРМОДИНАМИКА РАСТВОРОВ
1.1 Основные понятия
1.1.1 Энтальпия.
Величина равная (E+PV) , часто встречается в термодинамических расчетах процессов, происходящих в системах при постоянном давлении; её обозначают через Н и называют энтальпией и иногда теплосодержанием.
Т
(1)
аким образом,
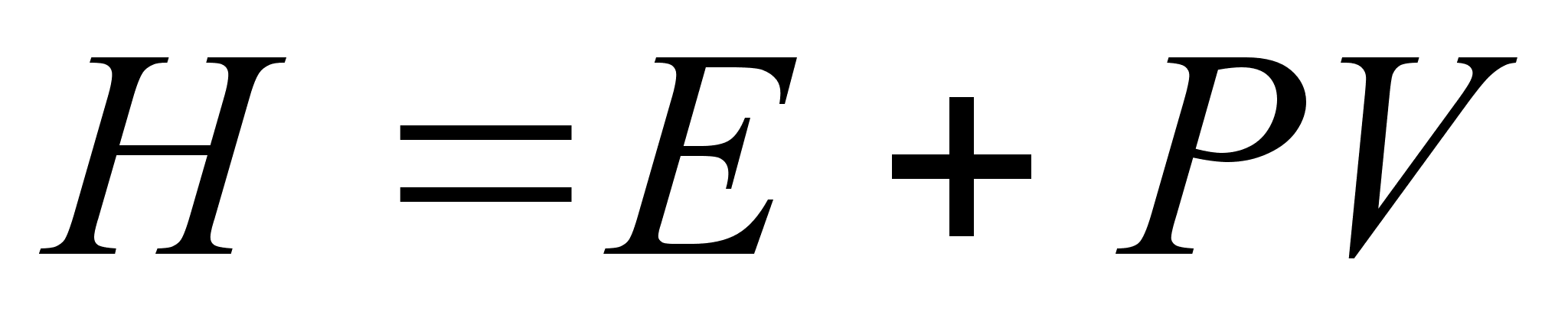 ,
,
где Е тАУ внутренняя энергия системы;
Р тАУ давление в системе;
VтАУ объем.
Из определения энтальпии следует, что она, подобно энергии, является функцией состояния системы, так как она выражена через энергию (функцию состояния) и переменные состояния P и V. Следовательно, изменение энтальпии для любого термодинамического цикла (циклического процесса) равно нулю.
Если процесс не циклический, то при постоянном давлении изменение энтальпии системы равно полученной ею (системой) теплоте:
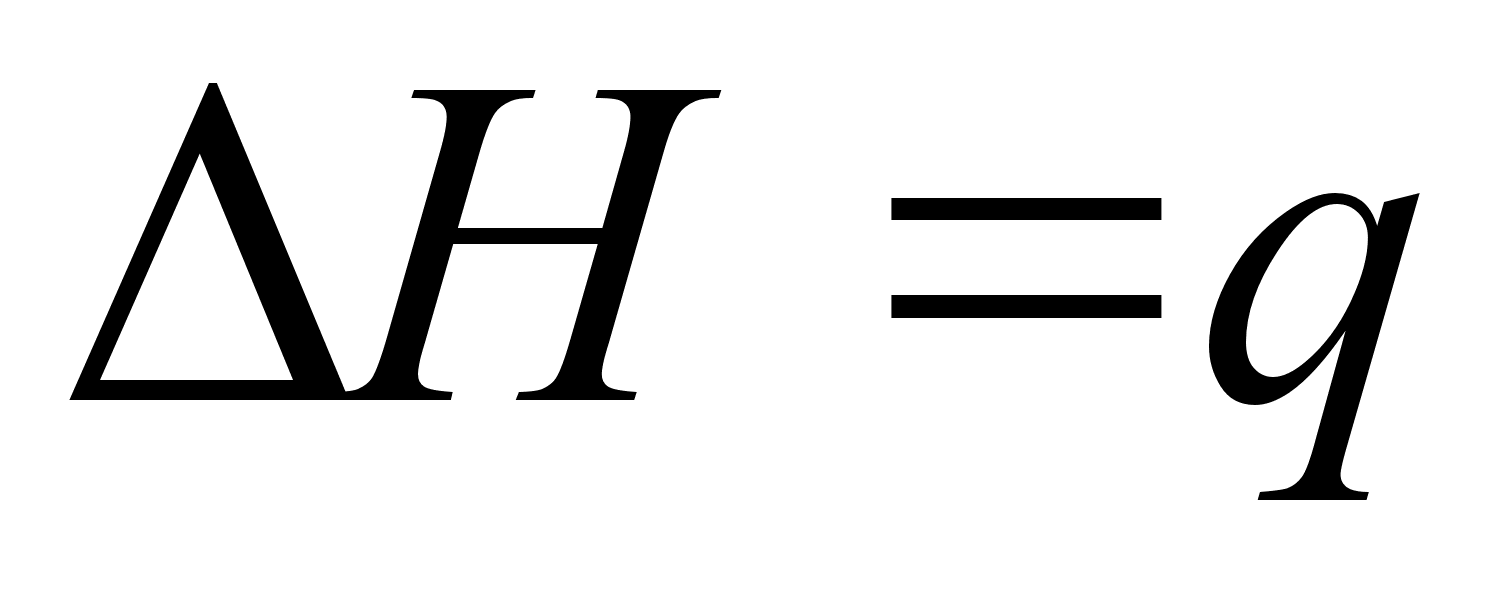
(2)
.
Таким образом, для изобарического процесса обмениваемая между системой и внешней средой теплота представляет разность между начальной и конечной энтальпией самой системы и не зависим от пути достижения конечного состояния системы. Этот вывод следует из уравнения (2) и первоначально установленного факта, что энтальпия системы является функцией только её состояния. Следует подчеркнуть, что уравнение (2) применимо только к системе при постоянном давлении, так как теплота q вообще является не только функцией начального и конечного состояний, но зависит также от пути процесса. [2]
1.1.2 Энтропия.
Пусть две системы с термодинамическими вероятностями W1 и W2образуют одну сложную систему, для которой термодинамическая вероятность W1+2. Так как каждый способ, которым осуществляется состояние первой системы, может сочетаться со всеми способами осуществления второй системы, то общее число способов, которыми может быть осуществлена сложная система, составляет:

(3)
Это свойство мультипликативности делает функцию W неудобной для непосредственных расчетов. [1]
Х
(4)
арактеризовать в этом смысле состояние системы оказалось удобнее не самой вероятностью осуществления данного макросостояния, а величиной, пропорциональной её логарифму. Эта величина называется энтропией. Энтропия (S) связана с числом (W) равновероятных микроскопических состояний, которыми можно реализовать данное макроскопическое состояние системы, уравнением:
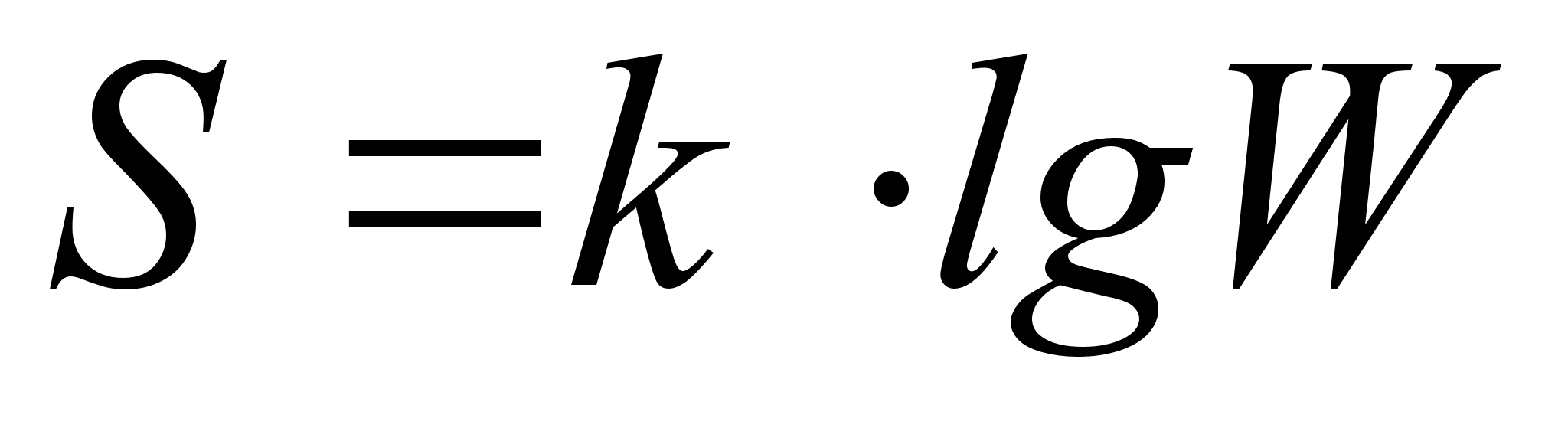
где k тАУ коэффициент пропорциональности
Наименьшую энтропию имеют идеально правильно построенные кристаллы при абсолютном нуле. Энтропия кристалла, в структуре которого имеются какие-либо неправильности, уже при абсолютном нуле в несколько раз больше, так как нарушения идеальности могут реализоваться не единственным способом. С повышением температуры энтропия всегда возрастает, так как возрастет число способов их расположения. Возрастает она также при превращении вещества из кристаллического состояния в жидкое и, в особенности, при переходе из жидкого состояния в газообразное. Изменяется энтропия и при протекании химических процессов. Эти изменения обычно особенно велики в случае реакций, приводящих к изменению числа молекул газов: увеличение числа газовых молекул приводит к возрастанию энтропии, уменьшение тАУ к её понижению. [4]
Изменение энтропии при различных процессах. Энтропия это функция, дифференциал которой равен 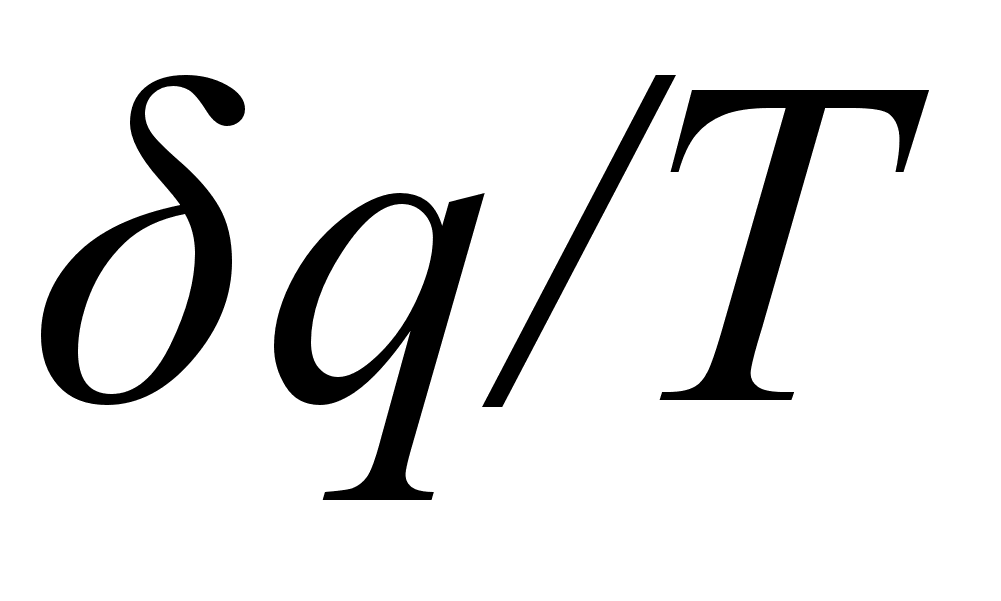 . Из определительного соотношения:
. Из определительного соотношения:
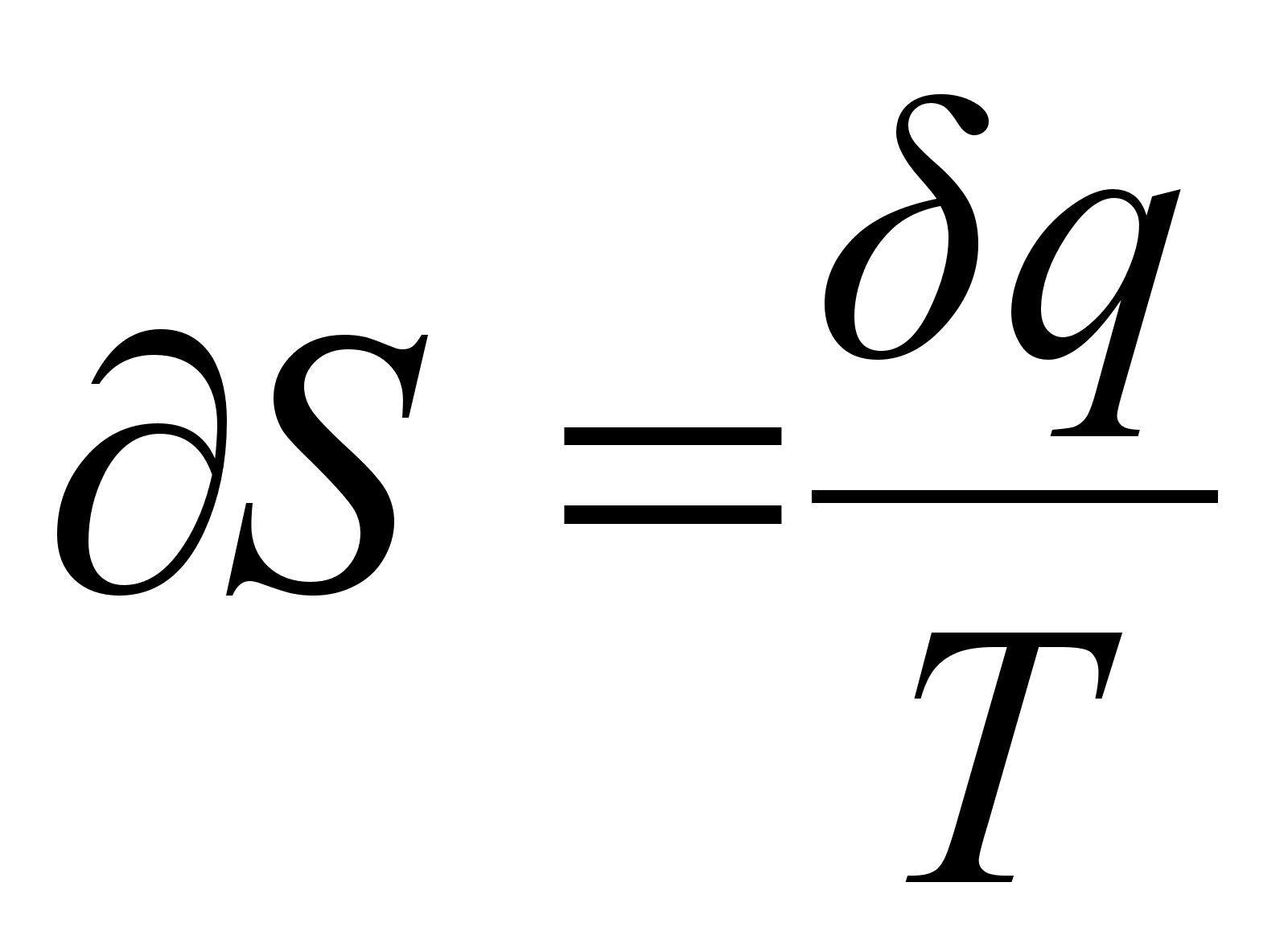
(5)
,
где 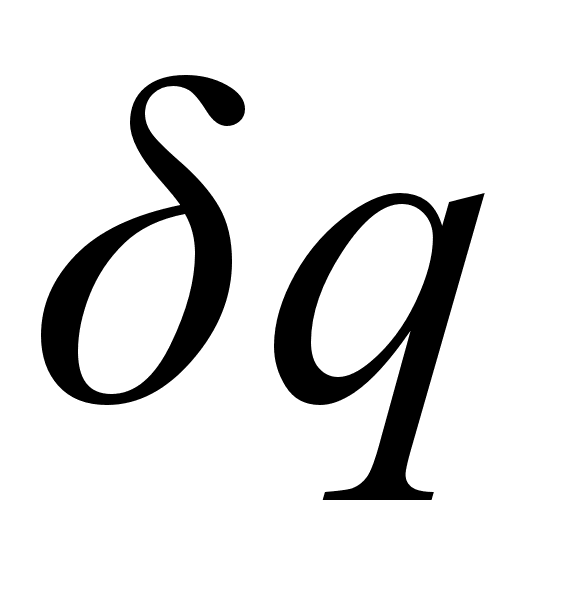 - приращение теплоты, следует, что для любого обратимого процесса, протекающего при постоянной температуре, изменение энтропии системы:
- приращение теплоты, следует, что для любого обратимого процесса, протекающего при постоянной температуре, изменение энтропии системы:
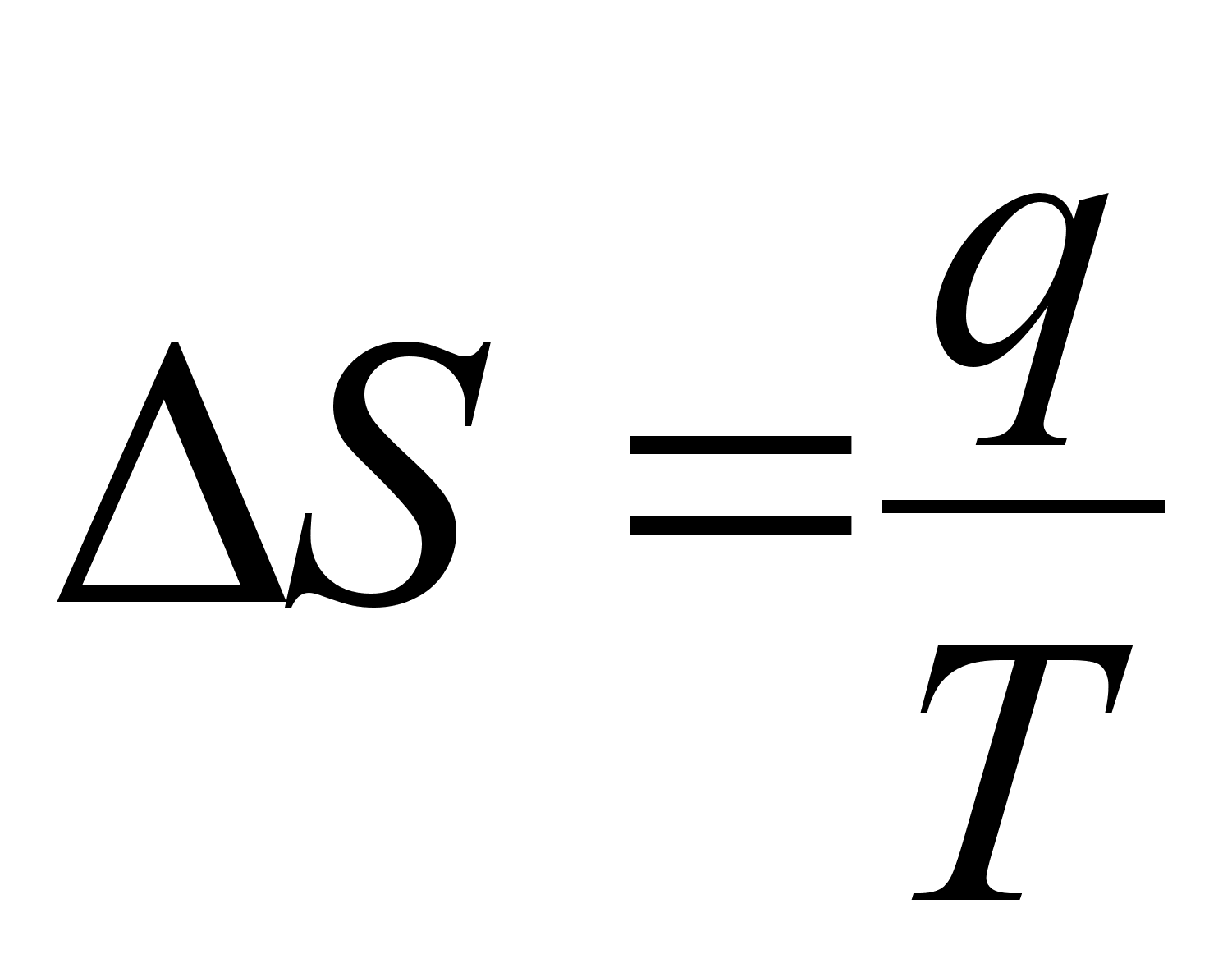
(6)
.
Для процессов, протекающих при постоянных давлении и температуре, имеем:
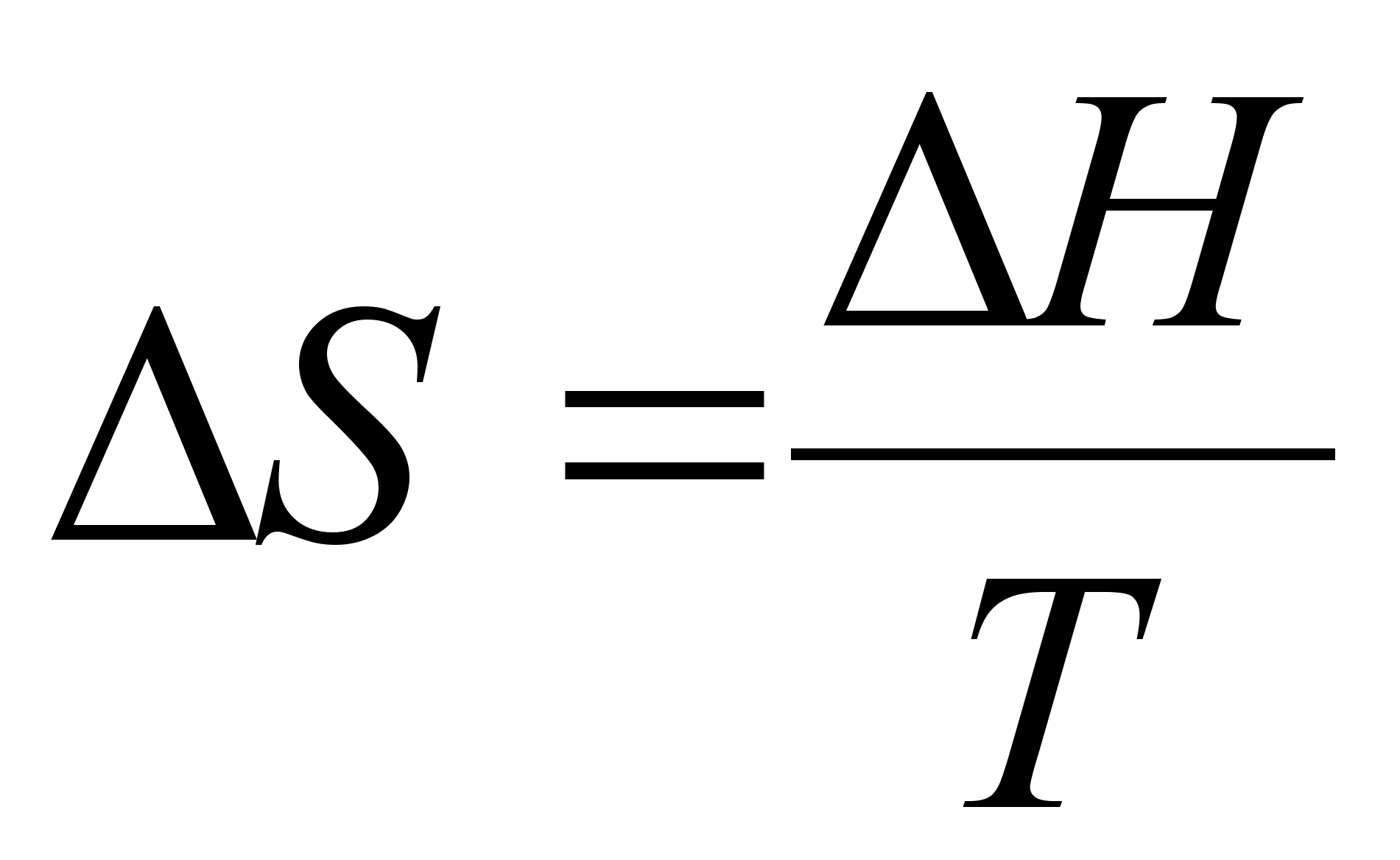
(7)
.
Для термодинамического вещества, нагретого и охлажденного при постоянном давлении,
 ,
,
где СР - теплоемкость вещества при постоянном давлении; и, следовательно,
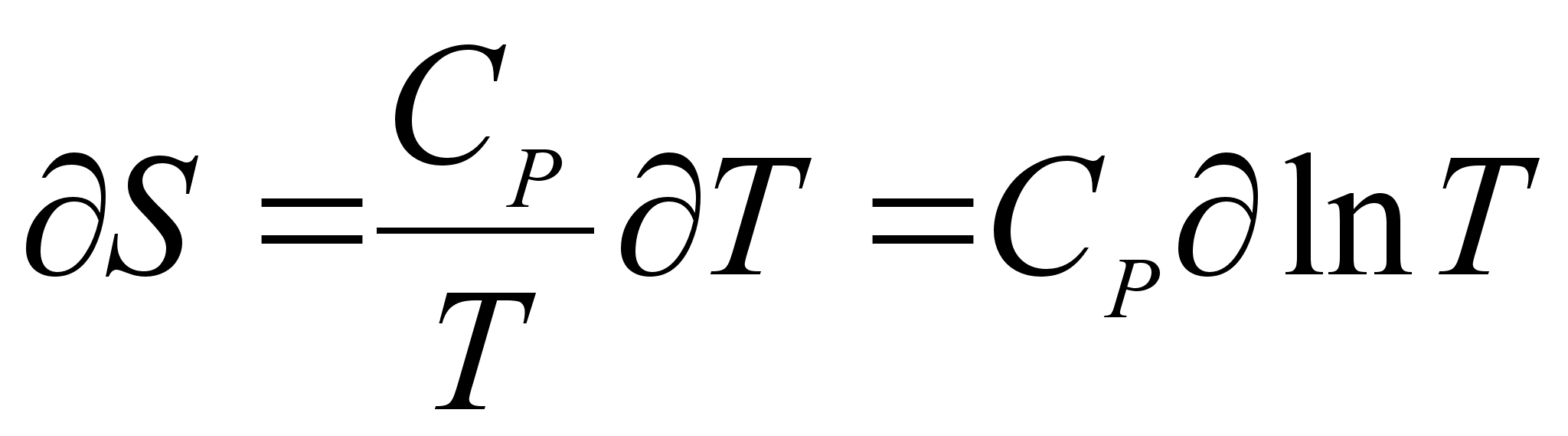
(8)
Точно также при нагреве и охлаждении вещества при постоянном объеме имеем: [2]
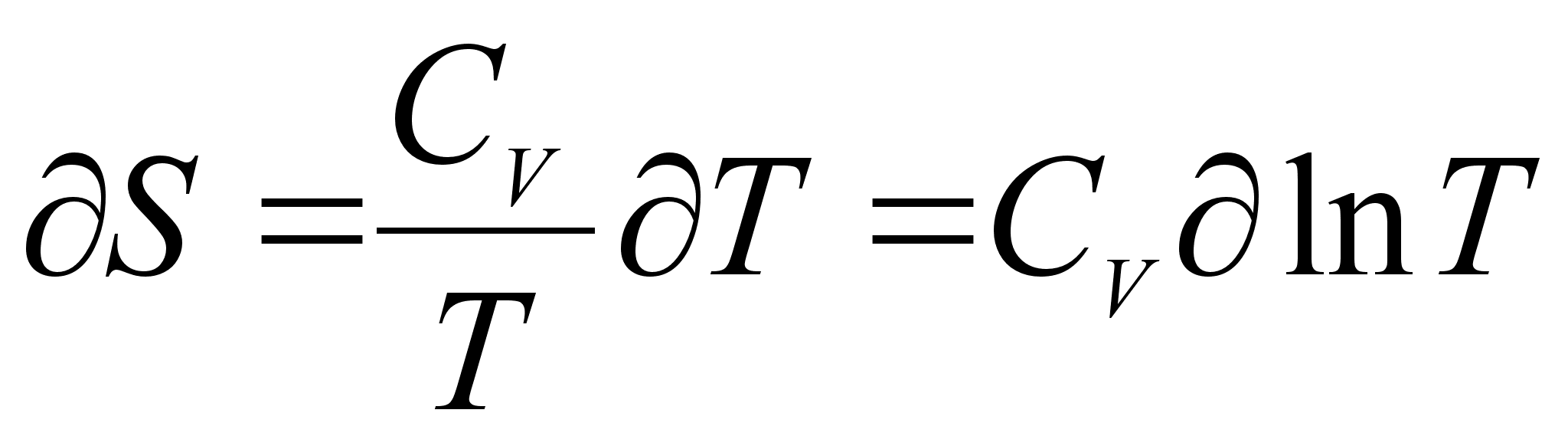
(9)
Если система изолирована от окружающей среды, то 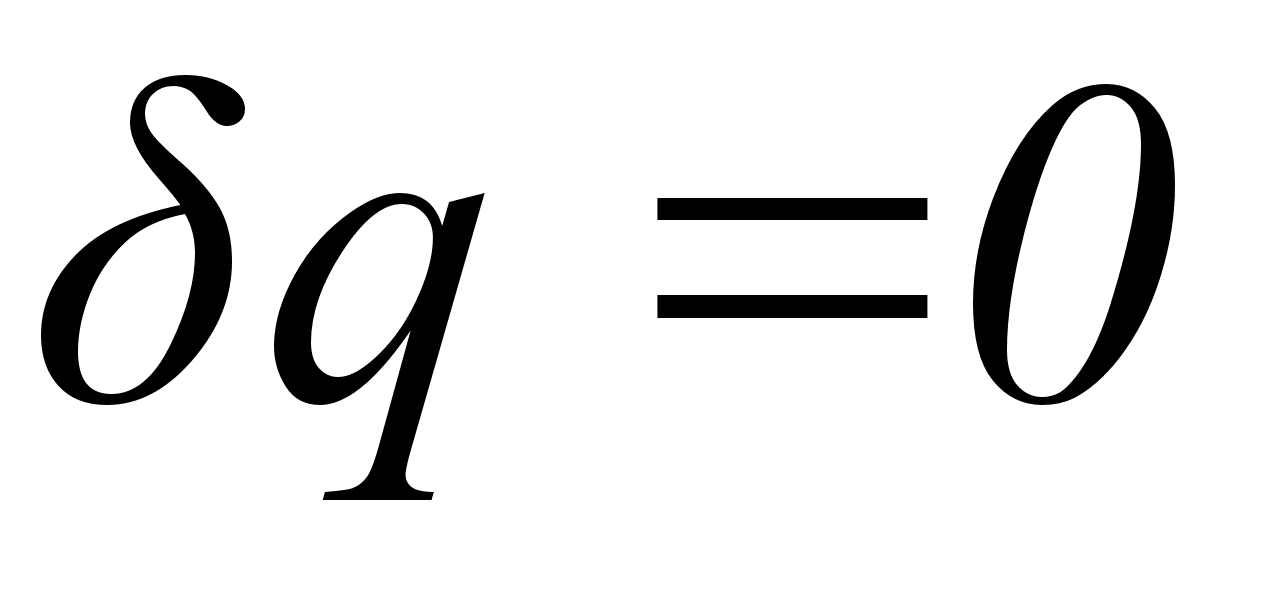 и, следовательно,
и, следовательно,  . Протекание любого самопроизвольного процесса характеризуется неравенством:
. Протекание любого самопроизвольного процесса характеризуется неравенством:

(10)
.
Следовательно, в замкнутой системе такие процессы сопровождаются увеличением энтропии. При равновесии энтропия замкнутой системы остается постоянной. [1]
1.1.3 Энергия Гиббса.
Термодинамические характеристики реакций включают значения тепловых эффектов и величины 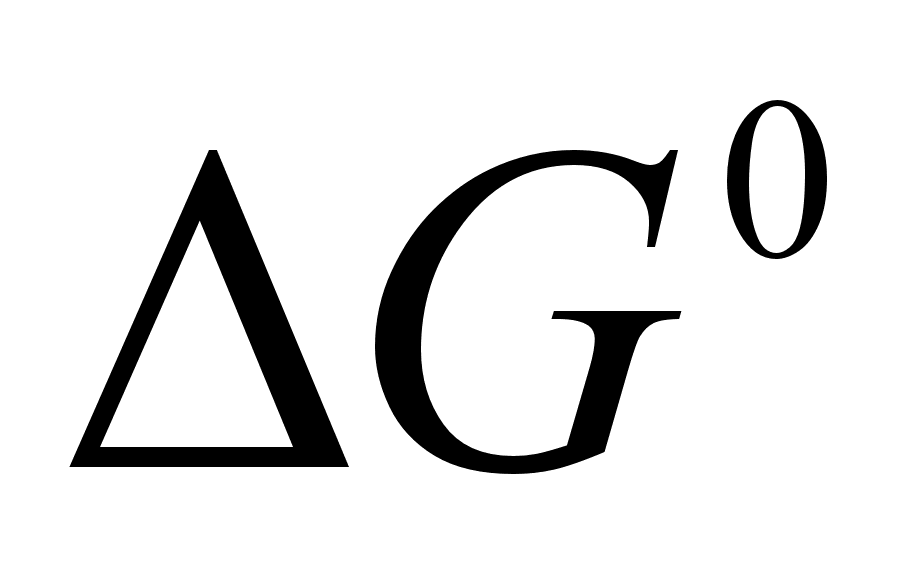 - стандартного изменения свободной энергии для соответствующих реакций. [5]
- стандартного изменения свободной энергии для соответствующих реакций. [5]
Изменение энергии Гиббса системы является основной термодинамической характеристикой химической реакции. Для определенности исходные вещества и продукты реакции принимают обычно находящимися в их стандартных состояниях. Соответствующую величину и называют стандартной энергией Гиббса химической реакции 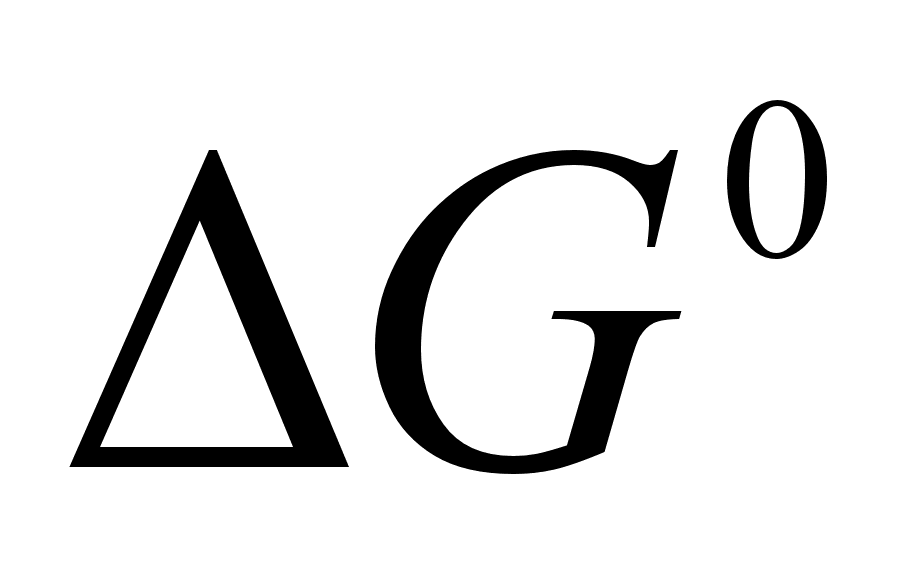 . [6]
. [6]
З
(11)
ависимость
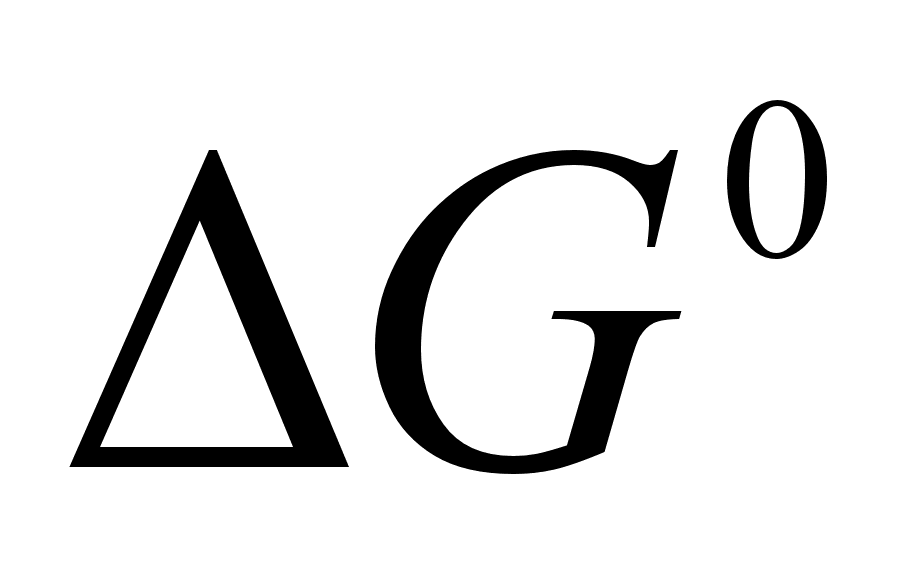
от различных реакций от температуры с достаточной точностью выражается формулой:
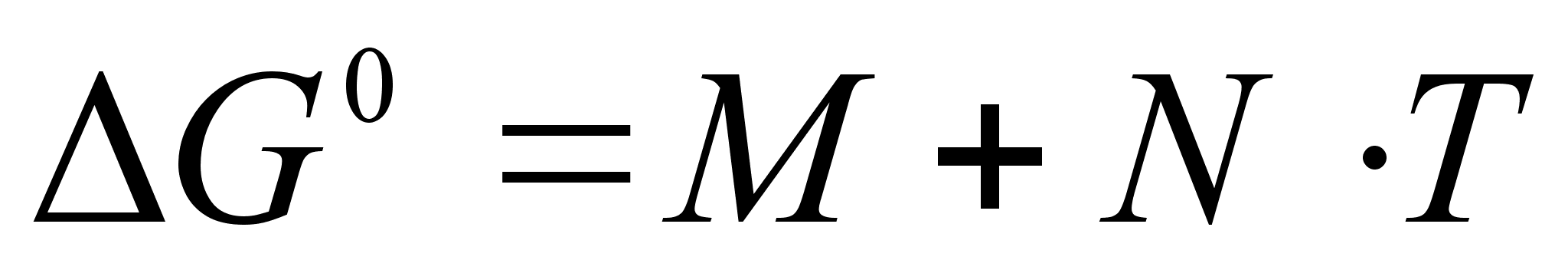
К
(12)
оэффициенты
М и
N для различных реакций приведены в справочной литературе. Эти коэффициенты определяются на основе обобщения экспериментальных данных по равновесиям различных реакций. Величины
M и
Nблизки к средним значениям тепловых эффектов (

) и изменения энтропии (
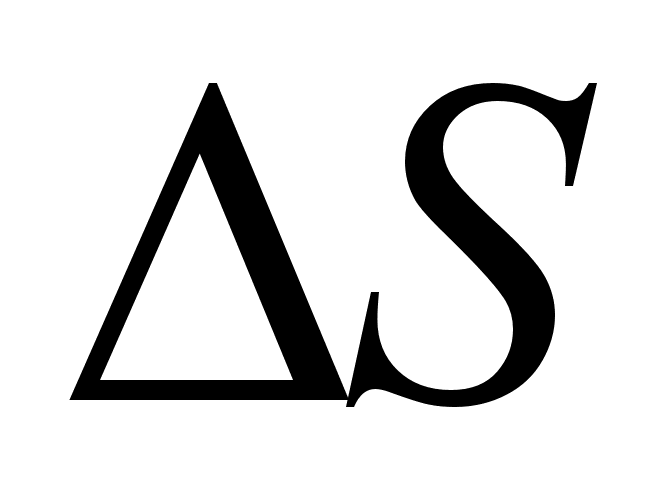
) для соответствующих реакций: [5]
 .
.
(13)
В некоторых справочных изданиях приведены не энергии Гиббса веществ
GT , а приведенные энергии Гиббса
ФТ, которые связаны с
GTсоотношением:

.
Д
(14)
ля энергии Гиббса реакции
aA+bB=cC+dD, как и для некоторых других величин, применимо выражение:

Согласно второму закону термодинамики, энергия Гиббса при необратимых процессах может только убывать. Отсюда следует, что 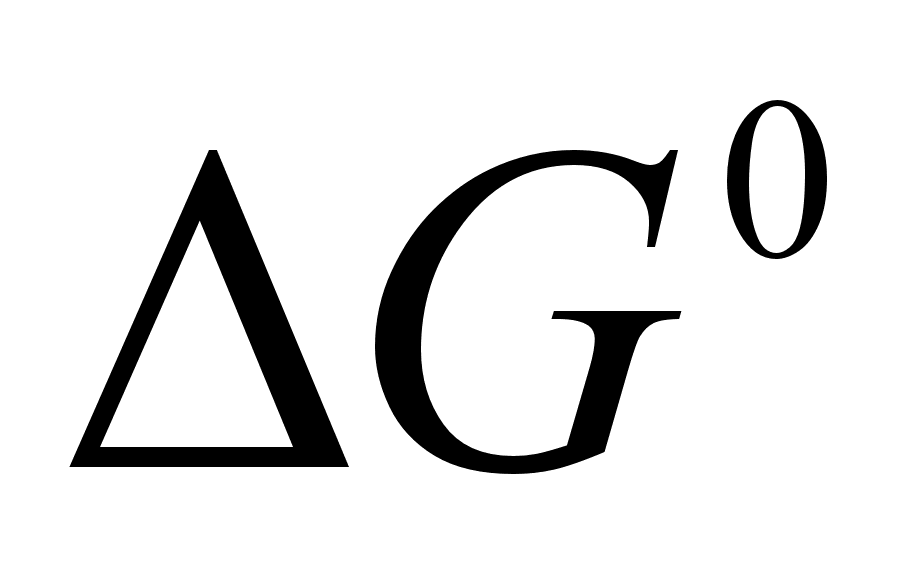 является критерием направления и полноты протекания реакции между веществами, взятыми в стандартном состоянии. Реакция может протекать только в том направлении, которое характеризуется отрицательным значением
является критерием направления и полноты протекания реакции между веществами, взятыми в стандартном состоянии. Реакция может протекать только в том направлении, которое характеризуется отрицательным значением 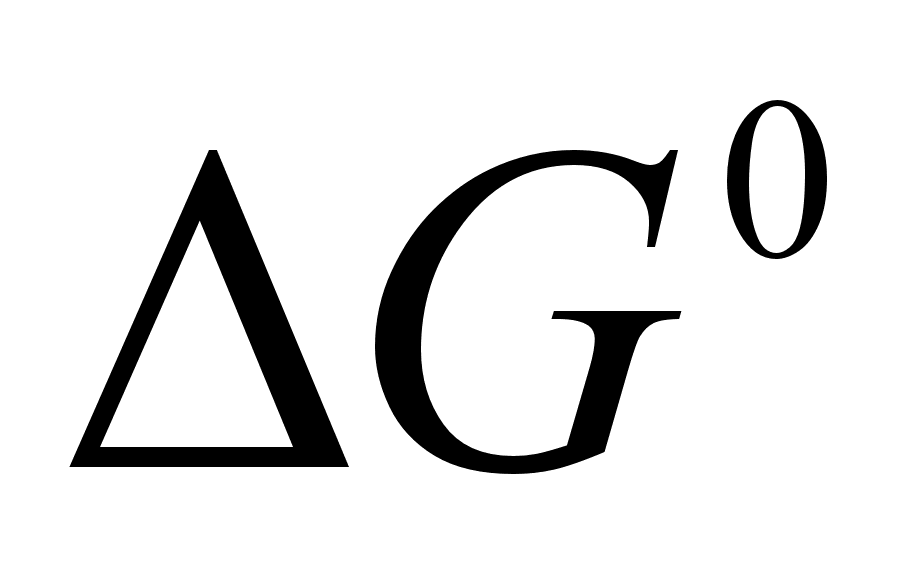 , т.е. реакция всегда идет в направлении снижения энергии Гиббса системы. Если
, т.е. реакция всегда идет в направлении снижения энергии Гиббса системы. Если  , то это указывает на равновесие между реагентами в их стандартных состояниях (реакция не идет). Полнота протекания реакции характеризуется константой равновесия К, связанной с
, то это указывает на равновесие между реагентами в их стандартных состояниях (реакция не идет). Полнота протекания реакции характеризуется константой равновесия К, связанной с 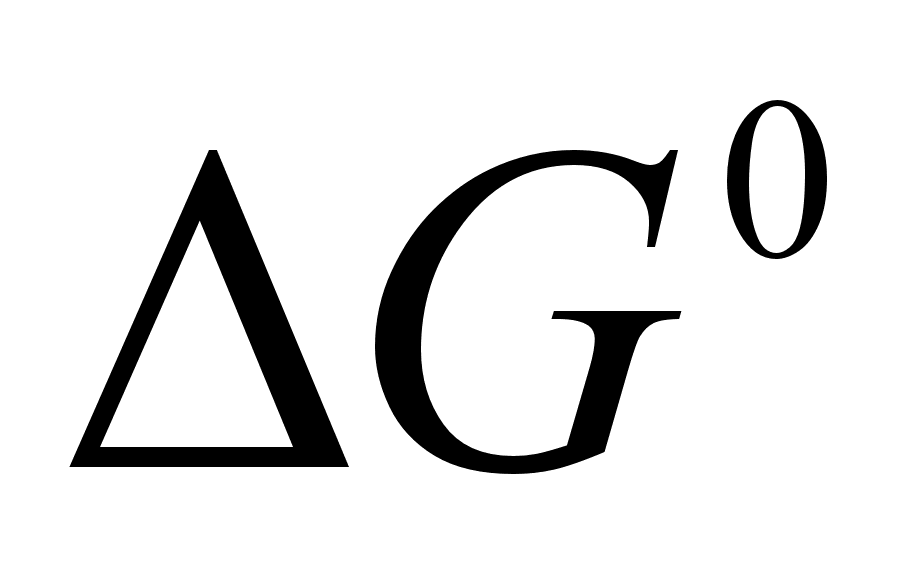 уравнением изотермы:
уравнением изотермы:  .
.
Поскольку R=8,3192 Дж/(моль*К):  .
.
При переходе к десятичным логарифмам получаем: 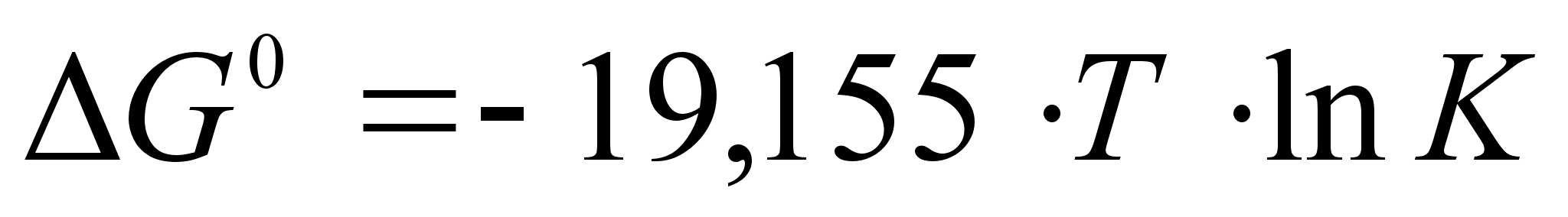 .
.
Пользуясь этим уравнением, можно по известному значению 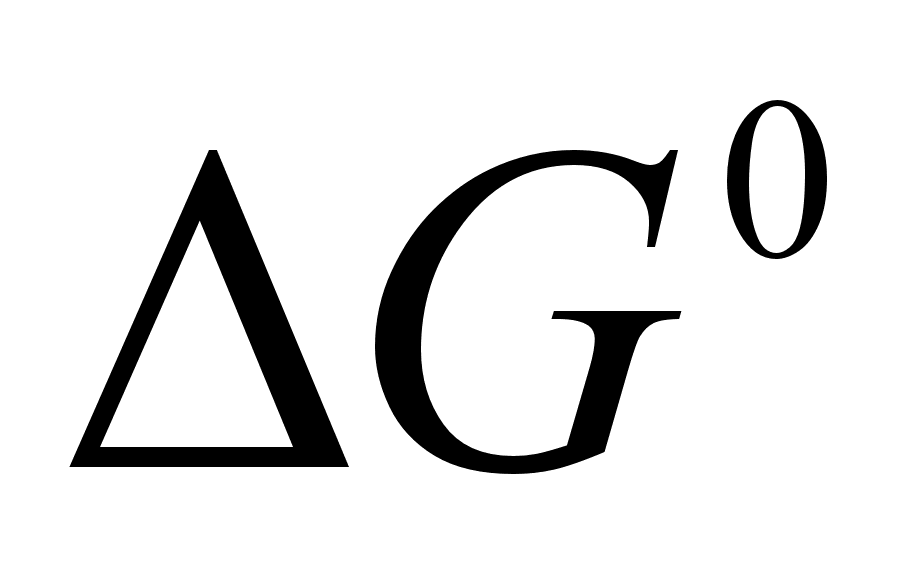 определить константу равновесия реакции, и найти необходимые для практики равновесные концентрации и другие характеристики. Например, для реакции получения TiC (
определить константу равновесия реакции, и найти необходимые для практики равновесные концентрации и другие характеристики. Например, для реакции получения TiC ( ), исходя из последнего уравнения и температурной зависимости
), исходя из последнего уравнения и температурной зависимости  , можно получить следующее выражение для константы равновесия:
, можно получить следующее выражение для константы равновесия:

(15)
1.1.4 Экстенсивные, интенсивные свойства; парциальные величины.
Э
(16)
кстенсивными называют свойства, которые зависят от количества вещества :
V, H, S, Gи т.д. Для определения экстенсивного свойства
gраствора необходимо просуммировать интенсивные (парциальные мольные) характеристики компонентов
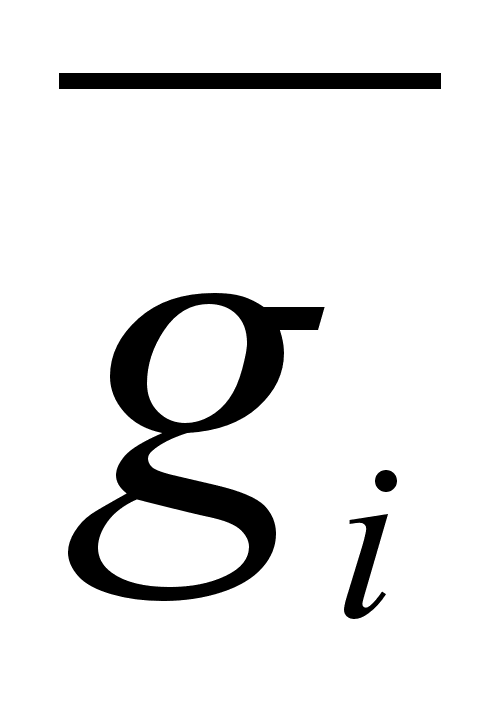
, умноженные на соответствующие числа молей
i. Например, для энтальпии раствора имеем

, или для 1 моля раствора:
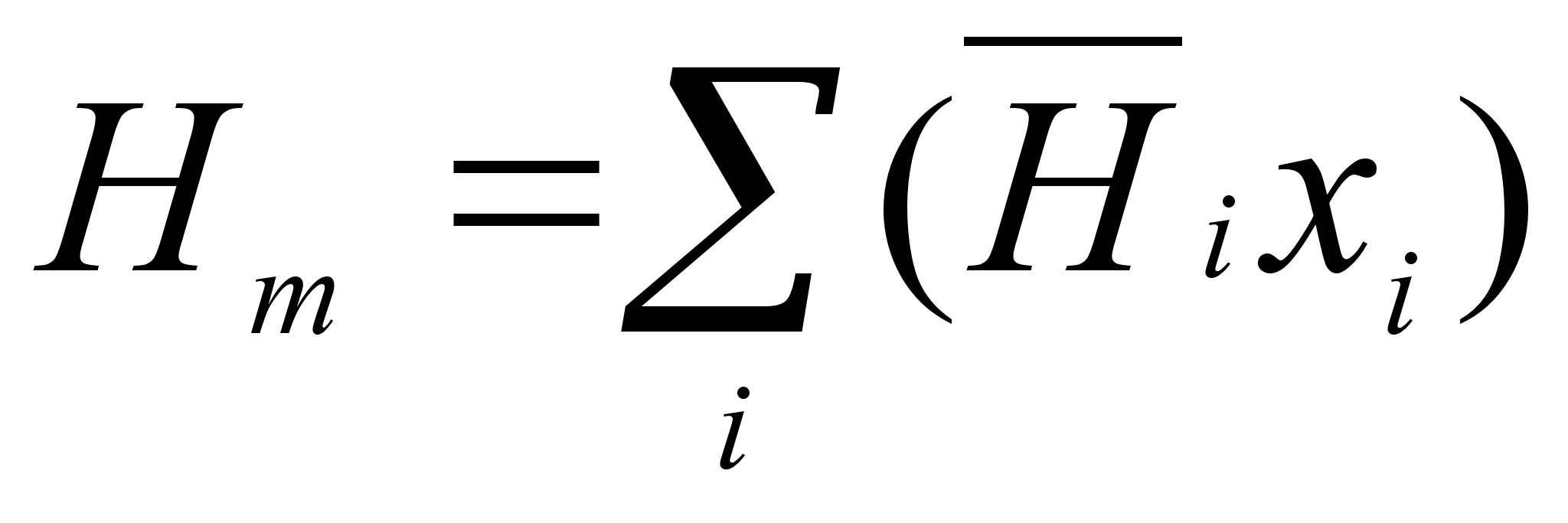
.
Интенсивные свойства раствора тАУ свойства, не зависящие от количества вещества, такие, например, как температура, давление. К числу интенсивных принадлежат и парциальные мольные характеристики 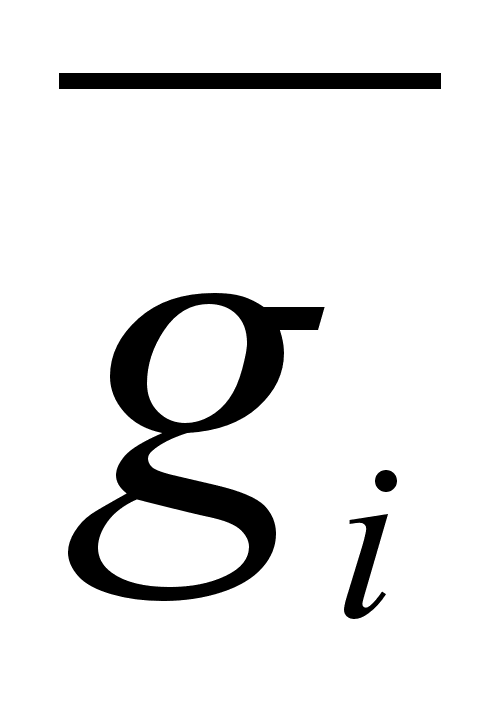 . Интенсивные свойства представляют собой частные производные от соответствующих экстенсивных свойств раствора по числу молей данного компонента при постоянных температуре, давлении и числах молей других компонентов:
. Интенсивные свойства представляют собой частные производные от соответствующих экстенсивных свойств раствора по числу молей данного компонента при постоянных температуре, давлении и числах молей других компонентов:

(17)
.
Таким образом, 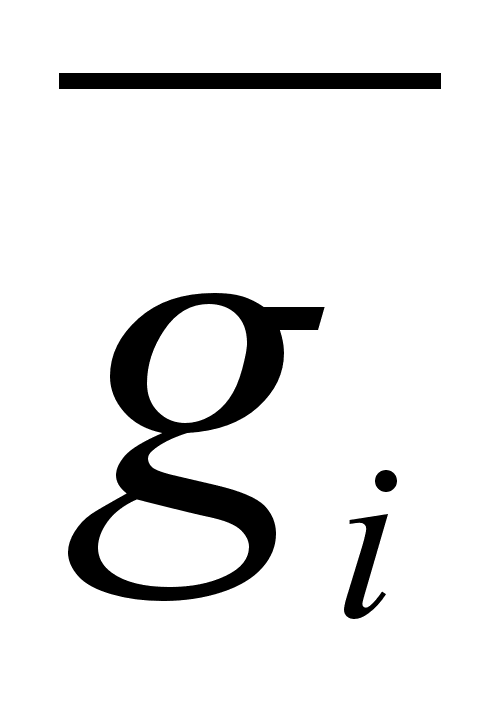 представляет собой приращение свойства бесконечно большого количества раствора при добавлении 1 моля i-того компонента. Например, парциальный мольный объём компонента в растворе заданного состава показывает, на какую величину изменится объём этого раствора (взятого в бесконечно большом количестве) при добавлении 1 моля данного компонента. [6]
представляет собой приращение свойства бесконечно большого количества раствора при добавлении 1 моля i-того компонента. Например, парциальный мольный объём компонента в растворе заданного состава показывает, на какую величину изменится объём этого раствора (взятого в бесконечно большом количестве) при добавлении 1 моля данного компонента. [6]
1.2 Растворы
Раствором называется однородная смесь, состоящая из двух или большего числа веществ, состав которой в известных пределах может непрерывно изменяться.
Однородными являются и химические соединения, однако их состав не может изменяться непрерывно, так как они подчиняются законам постоянства состава и кратных отношений.
1.2.1 Идеальные растворы
Цель термодинамической теории расплавов состоит в том, чтобы связать различные свойства растворов и найти способы предсказания свойств растворов, исходя из свойств чистых компонентов. Ввиду очень сложного характера взаимодействия компонентов в растворах решение этой задачи в общем виде невозможно. Поэтому целесообразно сначала рассмотреть идеализированные случаи, в которых можно отделить главные черты явления от второстепенных. [1]
Раствор называется идеальным, если :
а) теплота смешения равна нулю 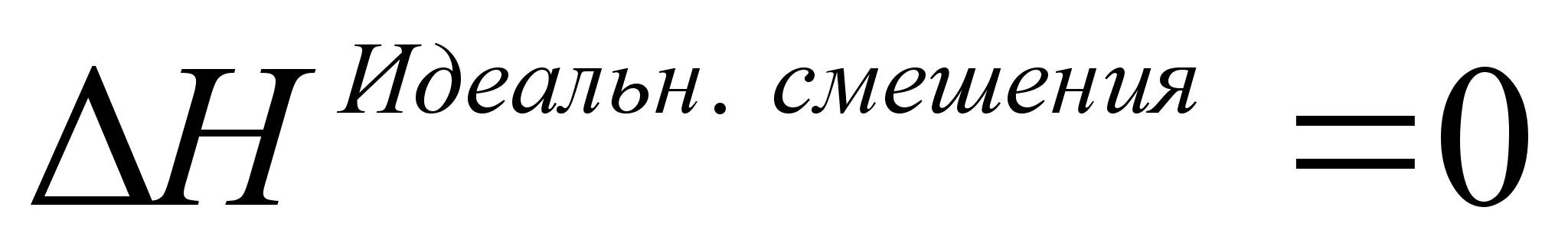 ,
,
б) изменение объема при смешении чистых компонентов равно нулю
 ,
,
в) парциальное давление пара каждого компонента пропорционально его молярной доле. Это означает, при всех концентрациях соблюдается закон Рауля при условии, что пары следуют законам идеальных газов и, следовательно, парциальные давления равны летучим. [7]
Идеальным называется раствор, в котором соблюдается закон Рауля при температурах и давлениях, при которых возможно его существование. Закон Рауля гласит, что для ограниченного числа растворов парциальное давление каждого компонента i равно произведению молярной доли компонента xi на упругость пара в его чистом виде (давление пара чистого компонента)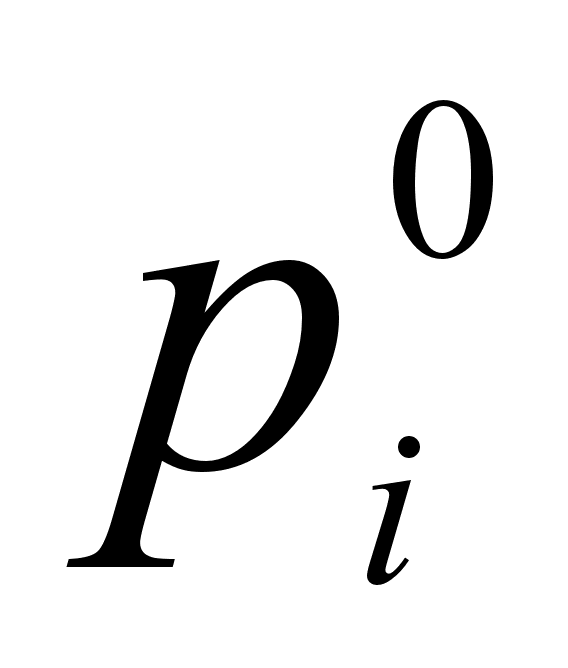 : [2]
: [2]

(18)
Теплота образования идеального раствора. Поскольку, суммарная энергия взаимодействия частиц при образовании идеального раствора из чистых компонентов не изменяется (такие растворы называют совершенными), парциальные объемы компонентов и их парциальные энтальпии будут равны соответствующим мольным характеристикам:  . [6] Таким образом, теплота испарения компонента в идеальном растворе равна теплоте испарения его в чистом виде. [2] В этом случае энтальпия раствора аддитивно складываются из мольных величин:
. [6] Таким образом, теплота испарения компонента в идеальном растворе равна теплоте испарения его в чистом виде. [2] В этом случае энтальпия раствора аддитивно складываются из мольных величин:
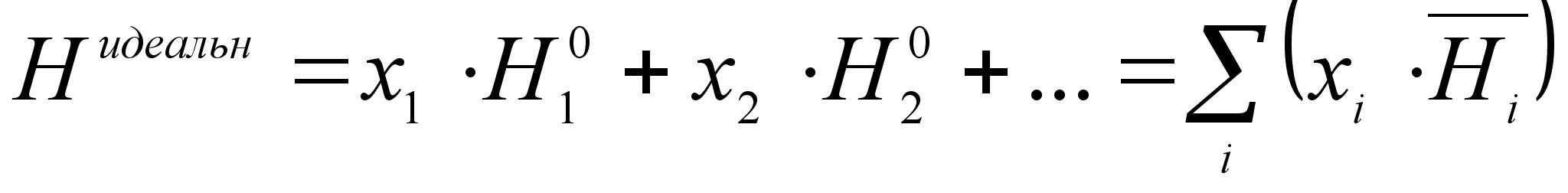
(19)
где Нидеальн - энтальпия 1 моля идеального раствора;
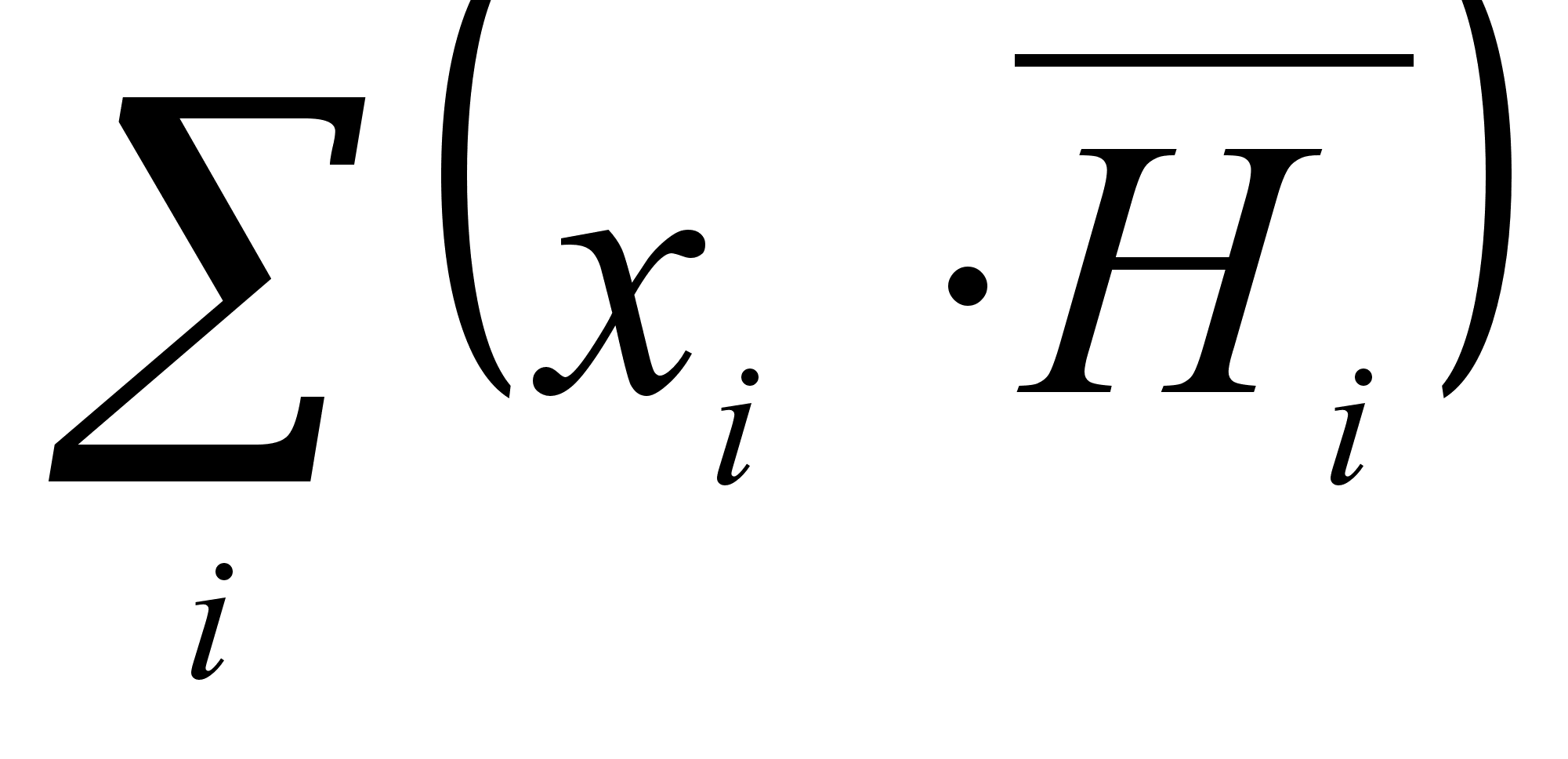 - энтальпия всех компонентов раствора до смешения.
- энтальпия всех компонентов раствора до смешения.
Из этого следует, что энтальпия, или теплота смешения для идеального раствора 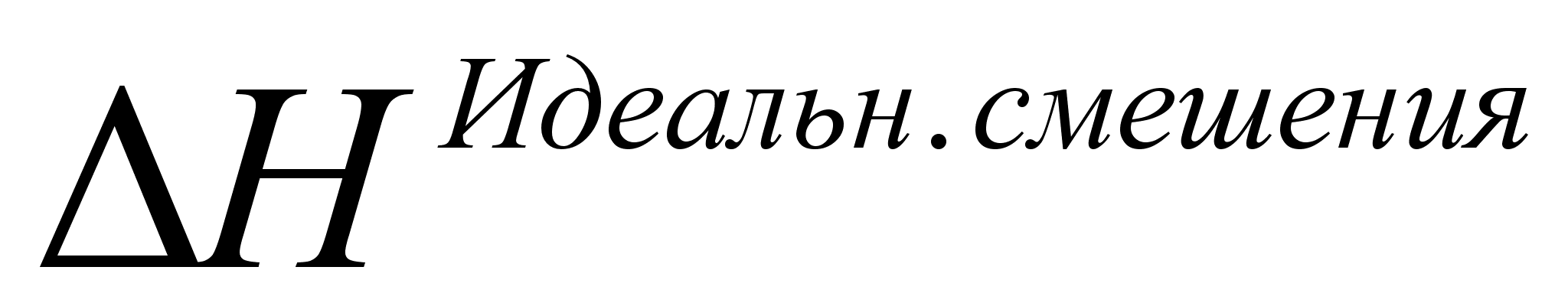 , равна нулю, т.е. [2]
, равна нулю, т.е. [2]
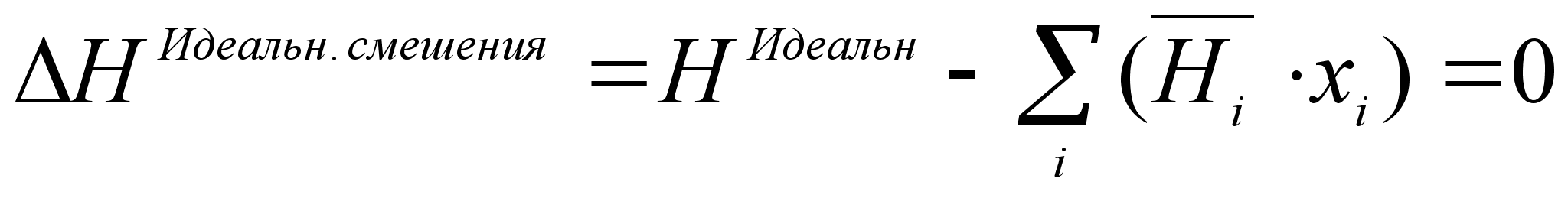
(20)
.
Изменение объема при образовании идеального раствора. Можно показать таким же образом, как это было сделано выше, что изменение объема при образовании идеального раствора по отношению к аддитивному равно нулю.
Как было сказано ранее,  , т.е. парциальный объем компонента идеального раствора равен молярному объему чистого компонента. Подставляя значение
, т.е. парциальный объем компонента идеального раствора равен молярному объему чистого компонента. Подставляя значение 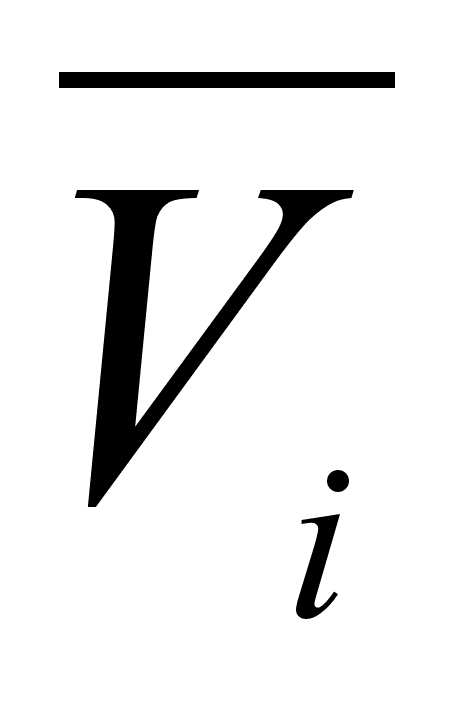 для каждого компонента в уравнение аддитивного сложения характеристик раствора, получим:
для каждого компонента в уравнение аддитивного сложения характеристик раствора, получим:
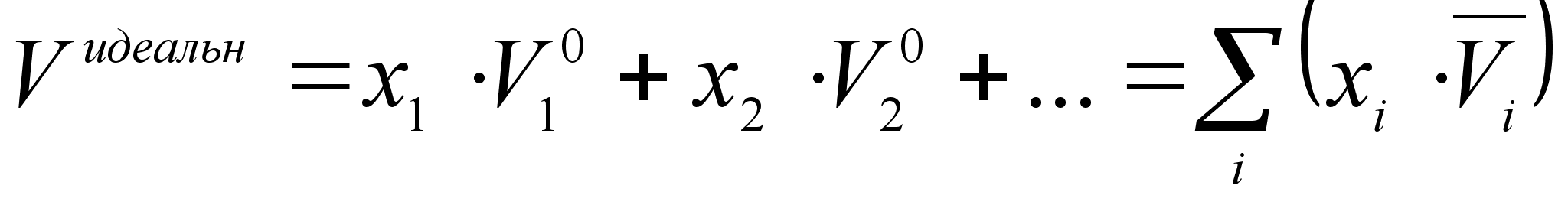
(21)
где Vидеальн- объем 1 моля идеального раствора;
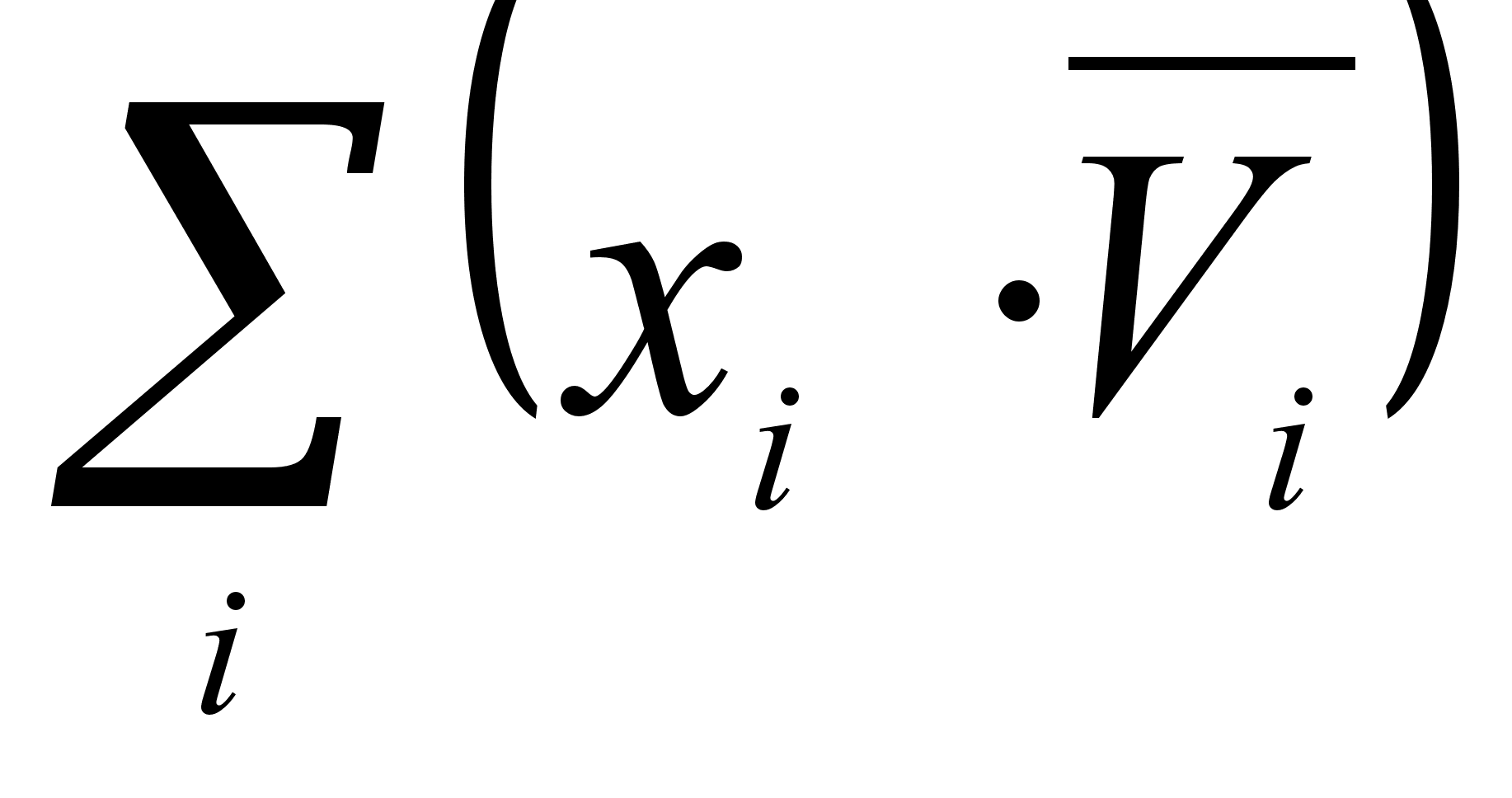 - объем всех компонентов раствора до смешения.
- объем всех компонентов раствора до смешения.
1.2.1.1 Совершенные растворы.
Как уже говорилось, идеальный совершенный раствор представляет такую модель, в которой закон Рауля выполняется с абсолютной точностью во всем интервале составов. Суммарная энергия взаимодействия частиц при образовании такого раствора из чистых компонентов не изменяется. [6] Такие растворы характеризуется благодаря близости свойств компонентов тем, что они образуются без теплового эффекта и без изменения объема. [1]
Фактором, который вызывает самопроизвольное образование совершенного раствора из чистых компонентов, является изменение энтропии. Оно обусловлено тем, что термодинамическая вероятность раствора (в котором каждая из молекул может находиться в любой части занимаемого им объема) выше, чем вероятность системы, где каждый из компонентов занимает только свой объем, составляющий лишь часть общего объема. Никакого дополнительного изменения энтропии, связанного с упорядочением хаотичного движением молекул, при образовании совершенного раствора не происходит. [6]
Таким образом, в отличие от величин H и V свободная энергия и энтропия при образовании совершенного раствора неаддитивны. Очевидно, энтропия раствора определяется уравнением: [1]

(22)
О
(23)
пределение энтропии образования совершенного раствора с использованием формул молекулярной статистики дает следующие выражения:
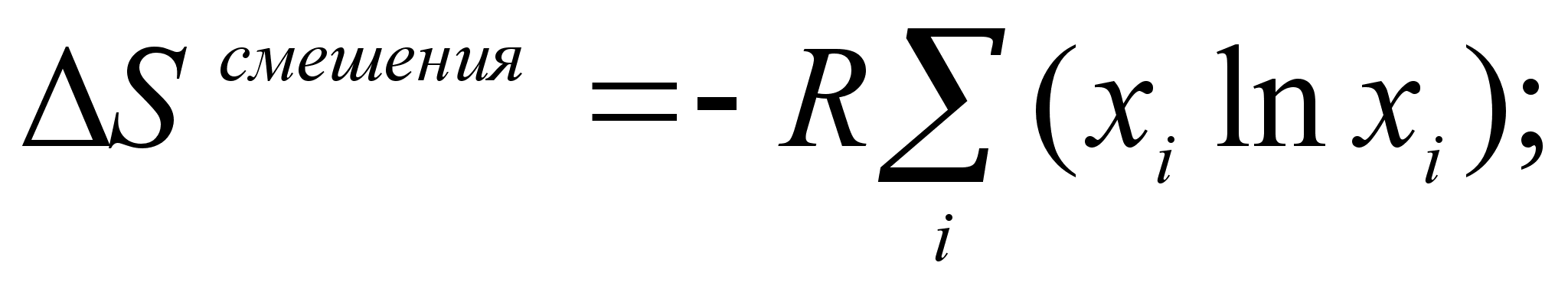
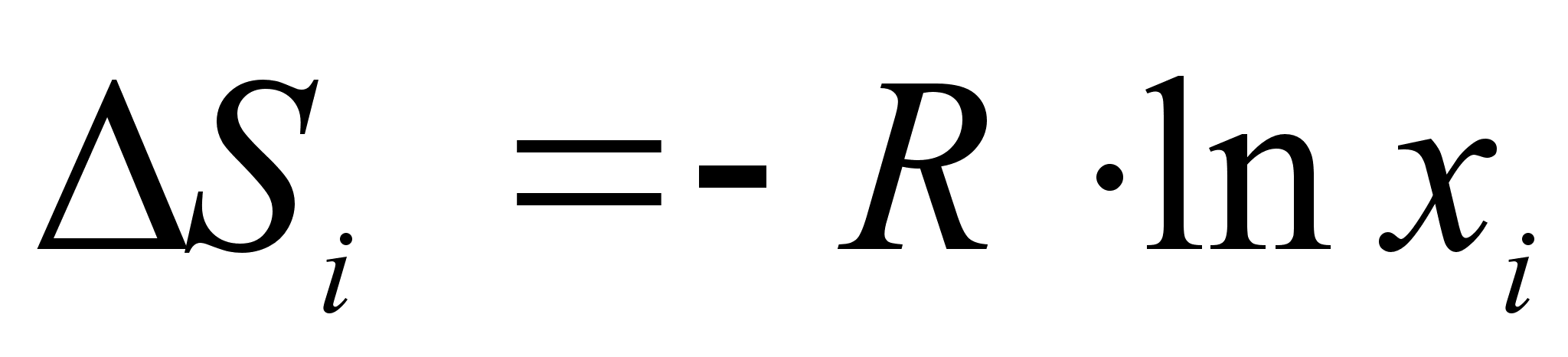
(24)
.
Отсюда следует:

(25)

(26)
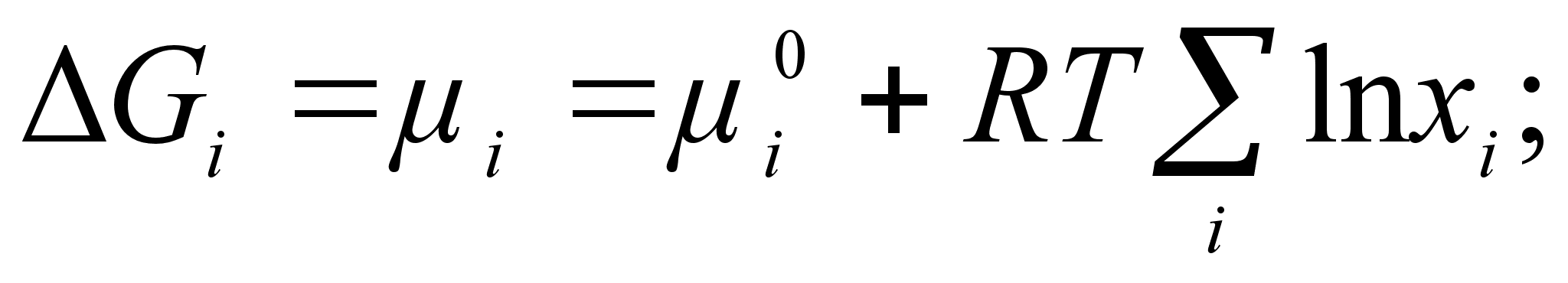
(27)
где  - химический потенциал компонента в стандартном состоянии (при xi=1). Из приведенных выражений (с учетом xi
- химический потенциал компонента в стандартном состоянии (при xi=1). Из приведенных выражений (с учетом xi характеризуется симметричной кривой (см. рисунок 1) с максимумом в точке х1=х2=0,5 , для которой
характеризуется симметричной кривой (см. рисунок 1) с максимумом в точке х1=х2=0,5 , для которой  =5,77 Дж/(моль*К).
=5,77 Дж/(моль*К).
П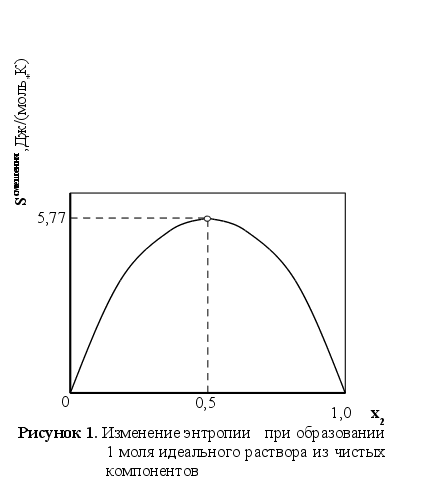 од активностью компонента в растворе понимают отношение давления насыщенного пара компонента над раствором к аналогичной величине для компонента в стандартном состоянии:
од активностью компонента в растворе понимают отношение давления насыщенного пара компонента над раствором к аналогичной величине для компонента в стандартном состоянии:

(28)
,
где aiтАУ активность компонентаiв растворе;
Pi тАУ давление насыщенного пара компонента i над раствором;
 - давление насыщенного пара компонента в стандартном состоянии.
- давление насыщенного пара компонента в стандартном состоянии.
В бинарном растворе 1-2 (рисунок 1) активность компонента 2 при его молярной доле х2:
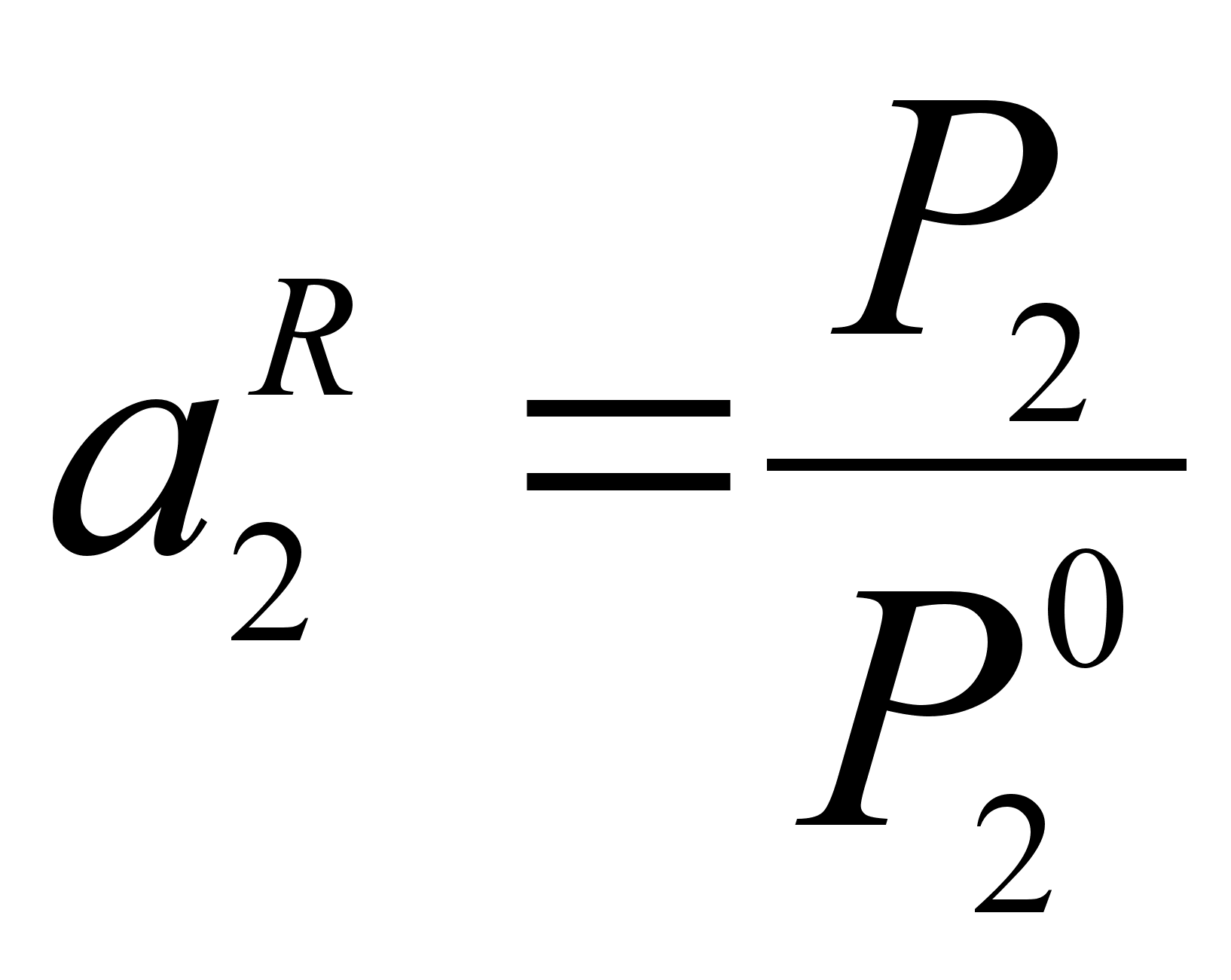
(29)
,
где Р2 тАУ давление насыщенного пара компонента 2 над раствором с концентрацией 2, равной х2;
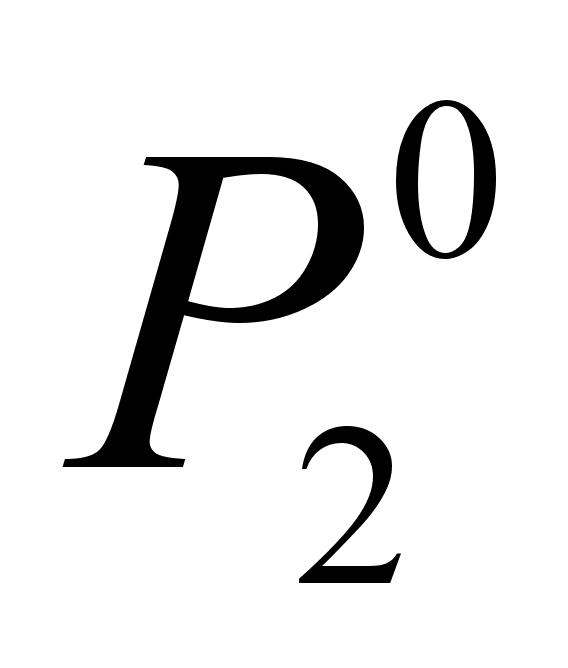 - давление насыщенного пара компонента 2 над чистым веществом 2 при той же температуре.
- давление насыщенного пара компонента 2 над чистым веществом 2 при той же температуре.
Из закона Рауля при той же концентрации х2 (см. рисунок 1) имеем:
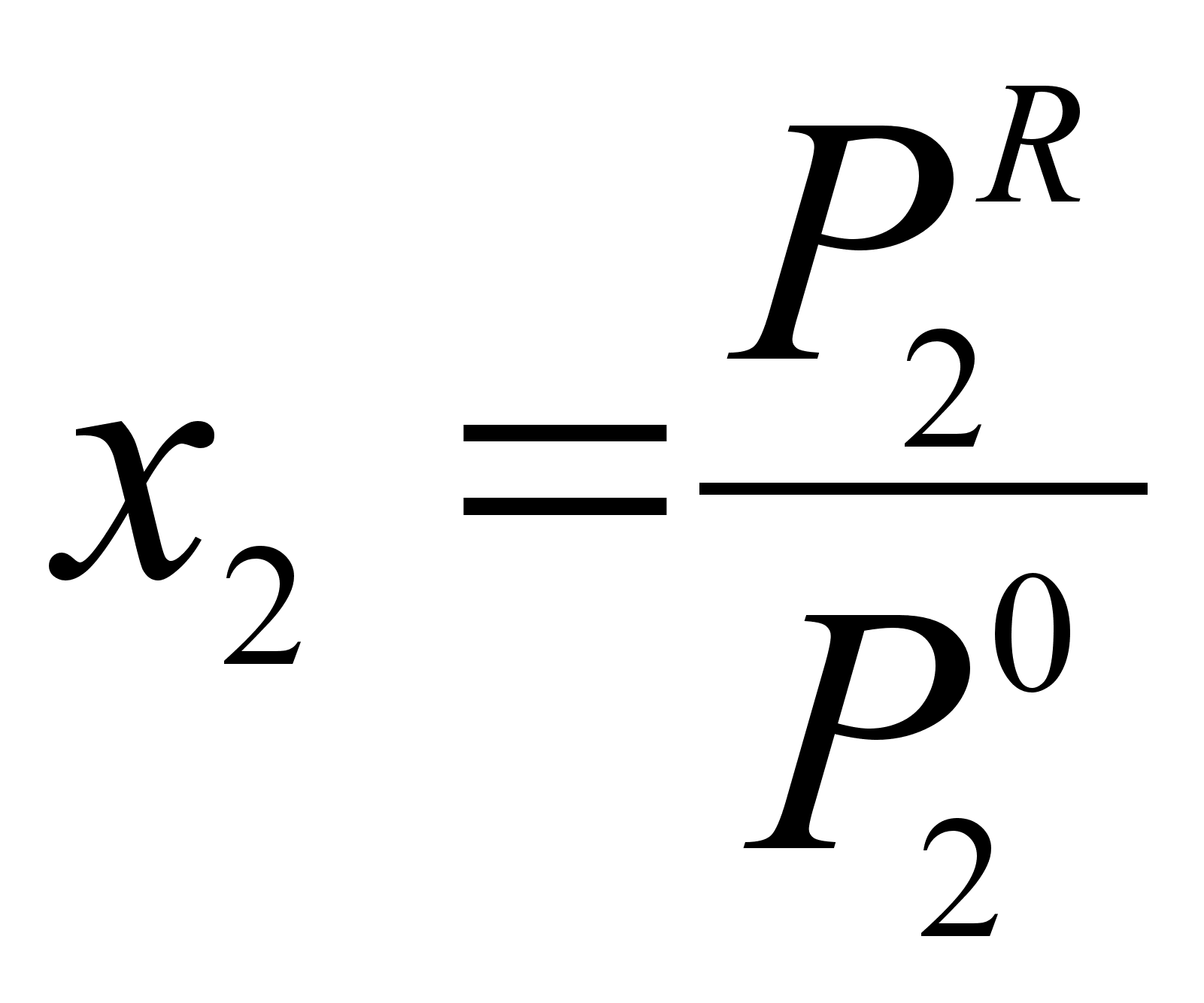
(30)
,
где 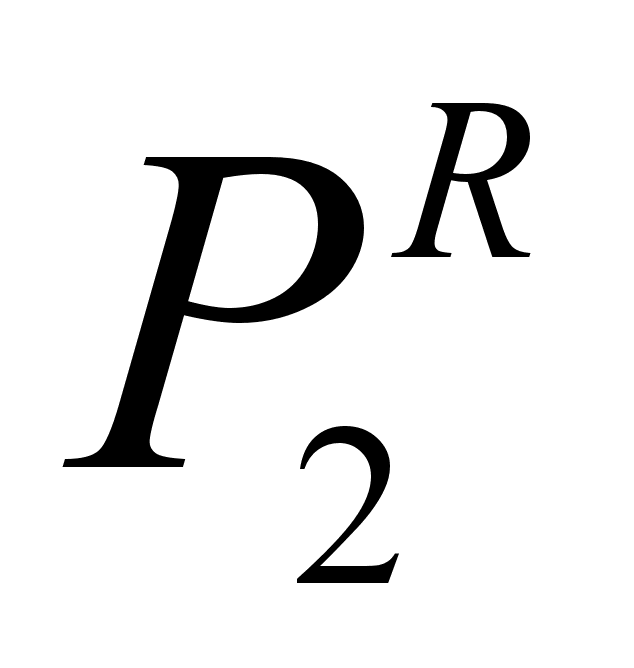 - давление насыщенного пара компонента 2, полученное расчетом по закону Рауля для концентрации х2.
- давление насыщенного пара компонента 2, полученное расчетом по закону Рауля для концентрации х2.
Для количественной оценки отклонения от закона Рауля вводится коэффициент активности 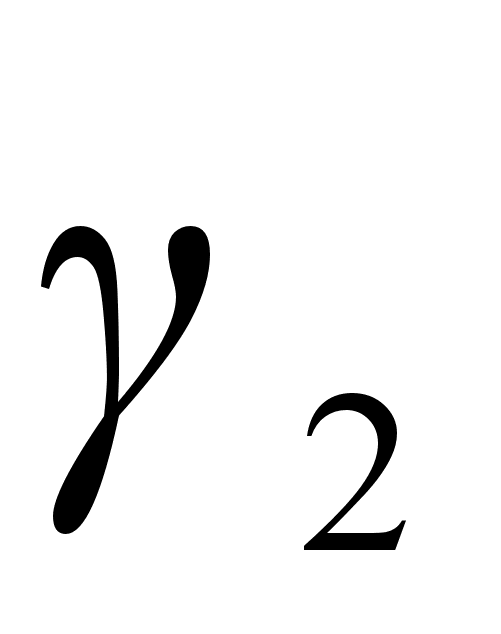 , который устанавливает связь между активностью и концентрацией:
, который устанавливает связь между активностью и концентрацией:
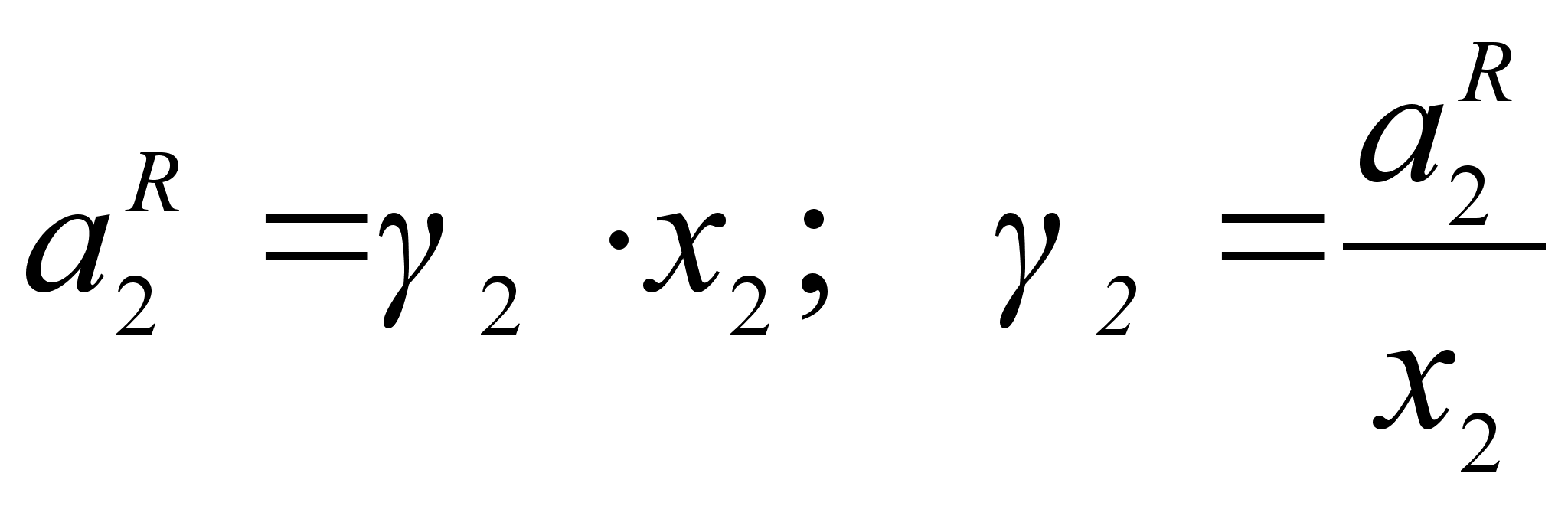
(31)
.
И
(32)
з рисунка 1 следует также, что
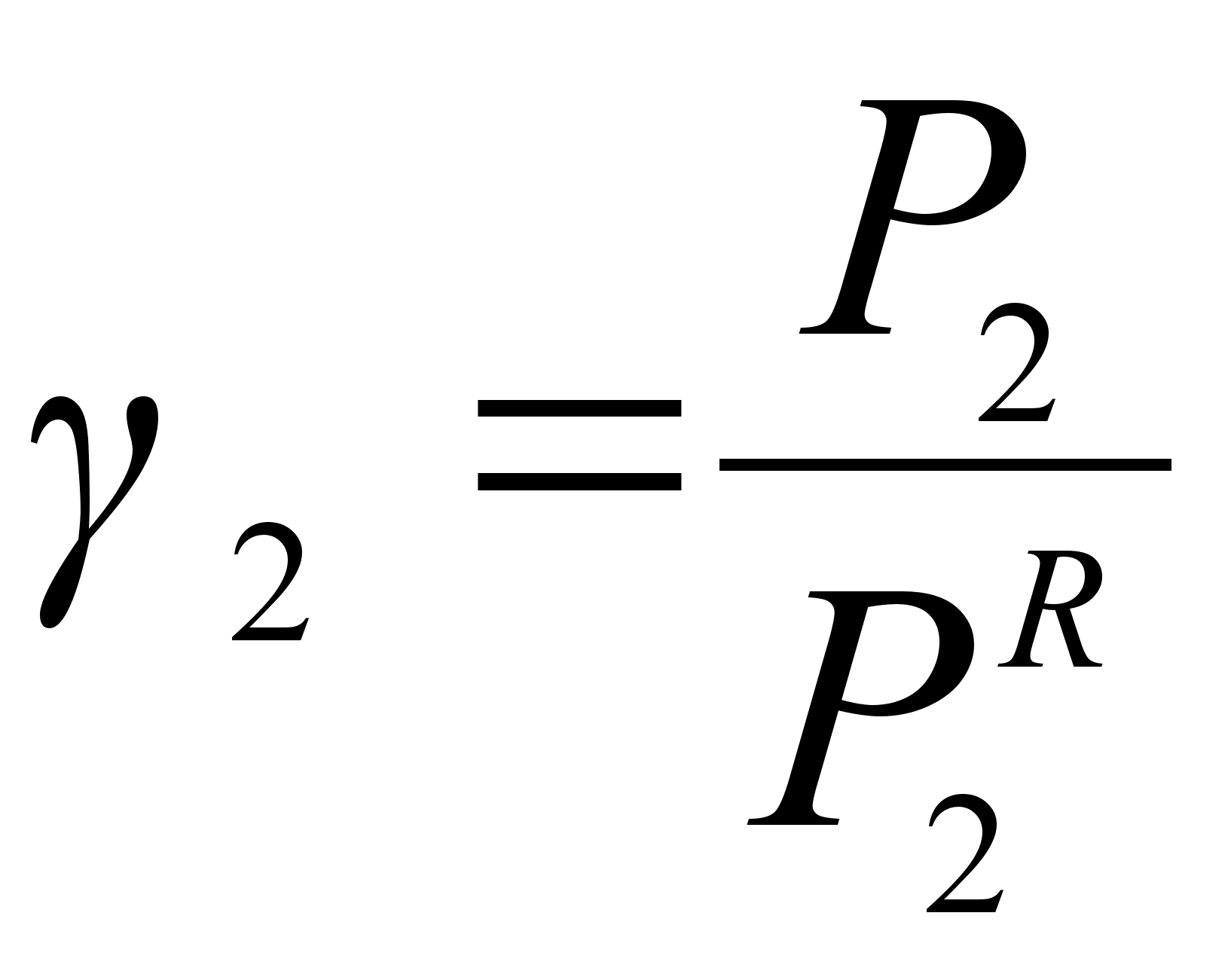
Для идеальных растворов 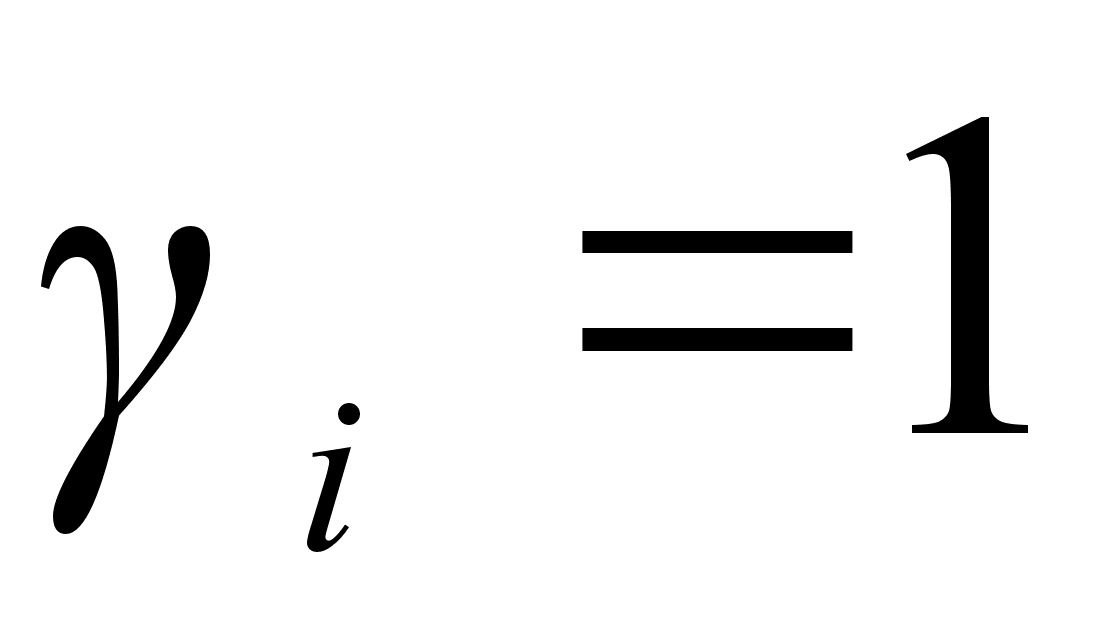 и
и 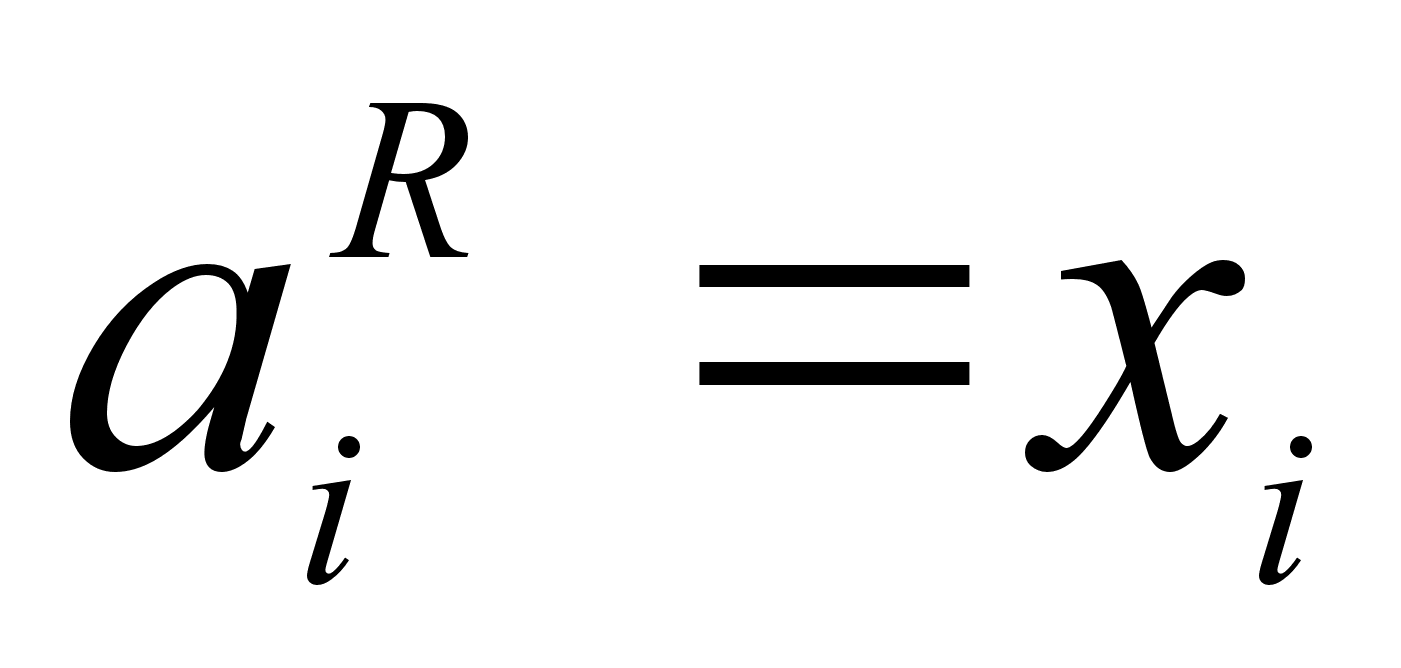 . В случае отрицательных отклонений от закона Рауля
. В случае отрицательных отклонений от закона Рауля 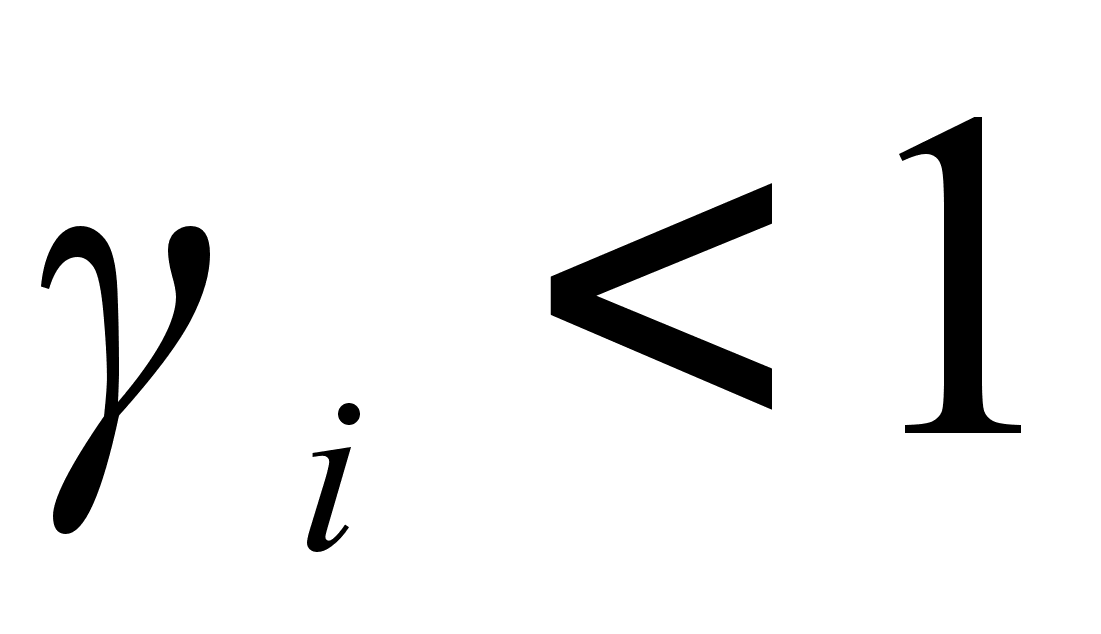 . При положительных отклонений от закона Рауля
. При положительных отклонений от закона Рауля 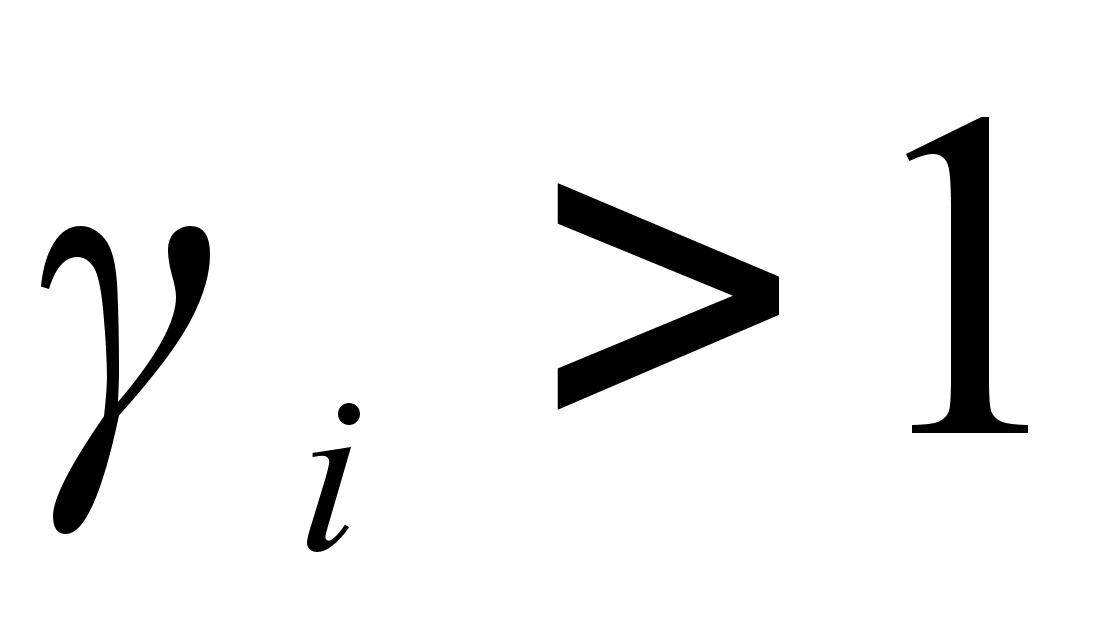 . [6]
. [6]
1.2.1.2 Совершенные растворы
Применительно к растворам различных компонентов в металлах, мы обычно имеем дело с разбавленными растворами этих компонентов. Термин Влразбавленный растворВ» применяют к системам, в жидкой фазе которых содержание одного элемента значительно превышает содержание других компонентов. В количественном отношении этот термин является довольно неопределенным, так как нельзя указать какие-то концентрационные границы, в пределах которых раствор следует считать разбавленным. В каждом отдельном случае представление о степени разбавленности раствора связано с тем, какие свойства его и с какой точностью исследуют. [3]
В таких разбавленных растворах термодинамические характеристики растворенного вещества пропорциональны его концентрации, несмотря на значительные отклонения от закона Рауля. Такое поведение растворенного вещества в разбавленном растворе соответствует закону Генри. [5]
С
(33)
огласно закону Генри, при малых концентрациях растворенного вещества его парциальное давление (давление насыщенного пара над раствором) прямо пропорционально мольной доле этого компонента:
Рi=kici
(при условии, что вещество i - не растворитель),
где ki тАУ коэффициент (константа) Генри, зависящий от химической природы компонентов, а также от выбранных единиц измерения концентрации.
Особенность модели разбавленного раствора заключается в том, что она (в отличие от модели совершенного раствора) не определяет величину энергии взаимодействия растворенного вещества с растворителем. Для упрощения (необходимого в любой модели) не учитывается взаимодействие молекул растворенного вещества друг с другом (в связи с их малой концентрацией), они реагируют лишь с молекулами растворителя. Таким образом, добавление растворенного вещества в разбавленный раствор вызывает такое же изменение внутренней энергии и энтальпии системы, как добавление его в чистый растворитель (при условии, что раствор и после добавления останется разбавленным), т.е. парциальная мольная энтальпия растворенного вещества в разбавленном растворе 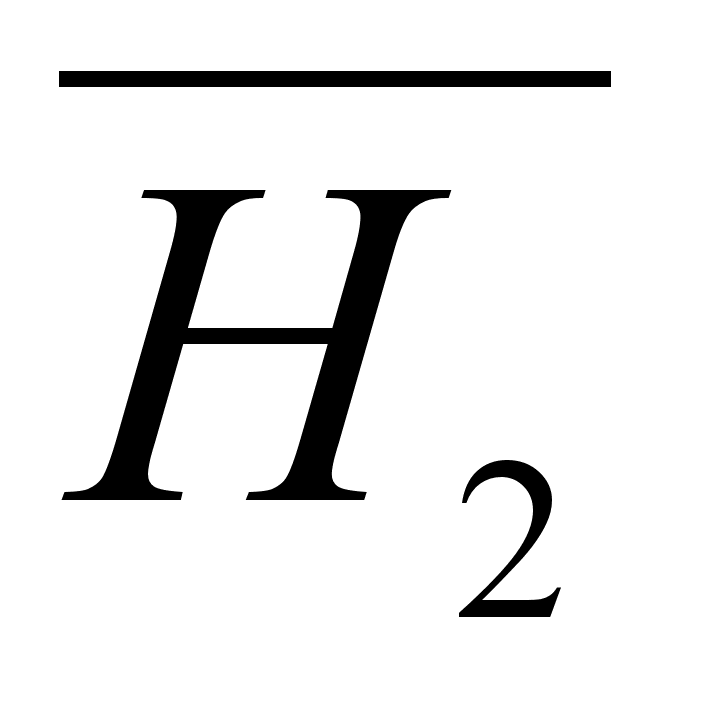 не зависит от концентрации:
не зависит от концентрации:

(34)
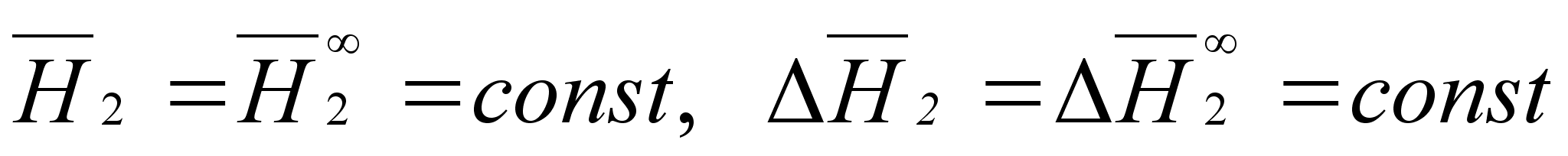
.
Знак 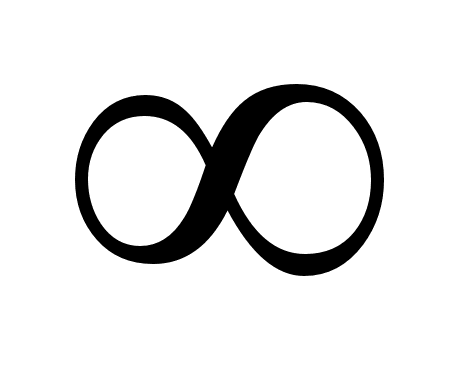 означает, что величина относится к начальной области концентраций и имеет такое же значение, как в бесконечно разбавленном растворе. [6]
означает, что величина относится к начальной области концентраций и имеет такое же значение, как в бесконечно разбавленном растворе. [6]
Гипотетическое стандартное состояние вещества (Генриево гипотетическое состояние) получают путем экстраполяции закона Генри от крайне низких концентраций  до значения
до значения 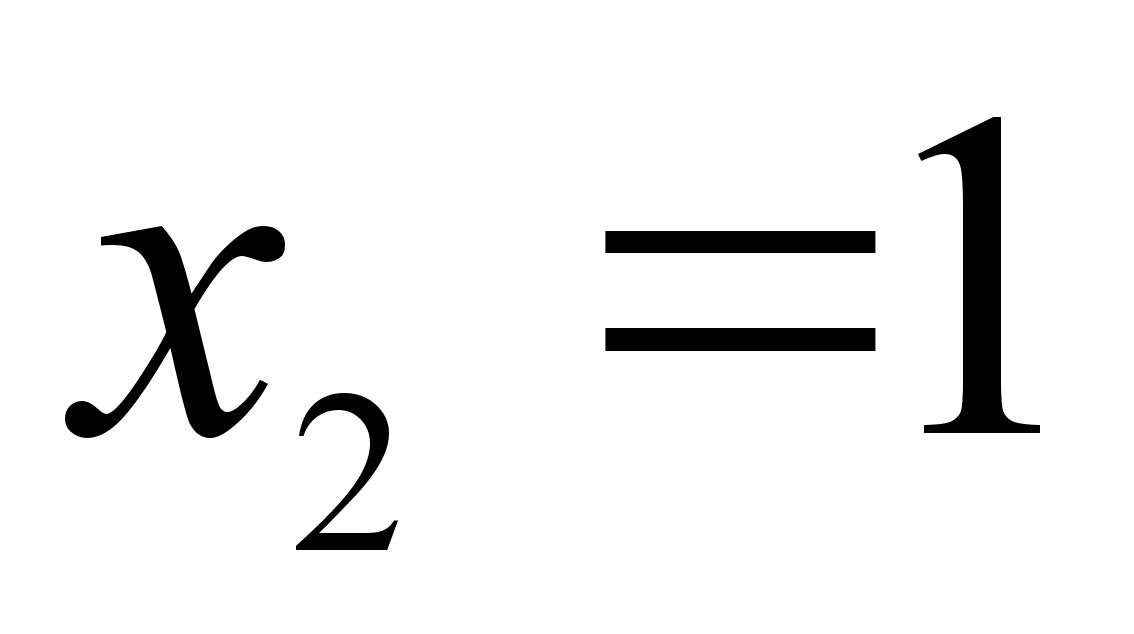 . Это состояние (точка h на рисунке 2) представляет собой чистое вещество 2 в гипотетическом, нереальном состоянии, в котором оно существовало как чистый компонент, если бы подчинялось закону Генри во всем интервале концентраций, вплоть до чистого вещества. Иными словами, если бы вещество в чистом виде характеризовалось теми же свойствами, что и в бесконечно разбавленном растворе. [5]
. Это состояние (точка h на рисунке 2) представляет собой чистое вещество 2 в гипотетическом, нереальном состоянии, в котором оно существовало как чистый компонент, если бы подчинялось закону Генри во всем интервале концентраций, вплоть до чистого вещества. Иными словами, если бы вещество в чистом виде характеризовалось теми же свойствами, что и в бесконечно разбавленном растворе. [5]
И
(35)
зменение энтропии
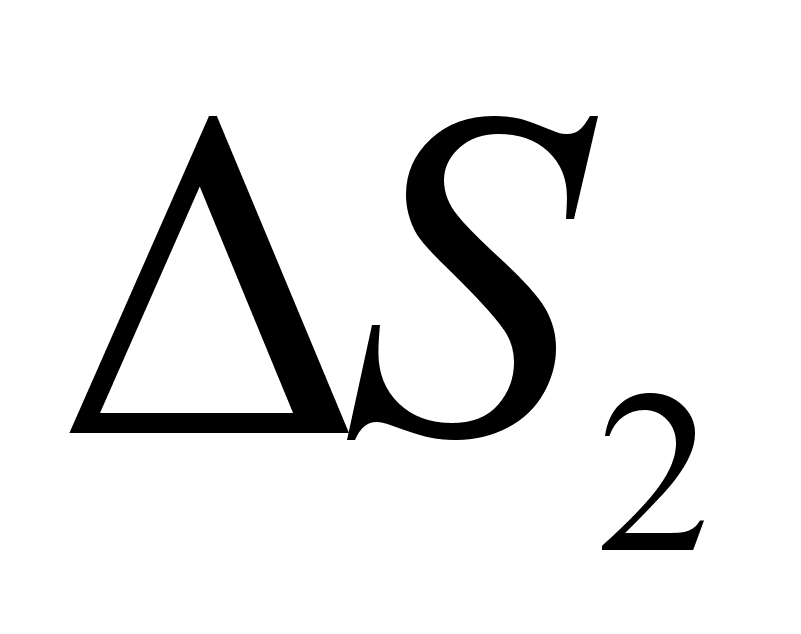
при образовании разбавленного раствора представляет собой сумму двух величин. Первая величина связана с изменением состояния молекул и, следовательно, в области разбавленных растворов не зависит от состава. Вторая величина, как и в случае совершенных растворов, обусловлена увеличением объема, предоставленного молекулам растворенного вещества при переходе их из индивидуального компонента в раствор. Эта величина пропорциональна логарифму объема раствора, приходящегося на единицу количества компонента
2, т.е. обратно пропорциональна логарифму концентрации
с2, выраженной в любых единицах. Таким образом:
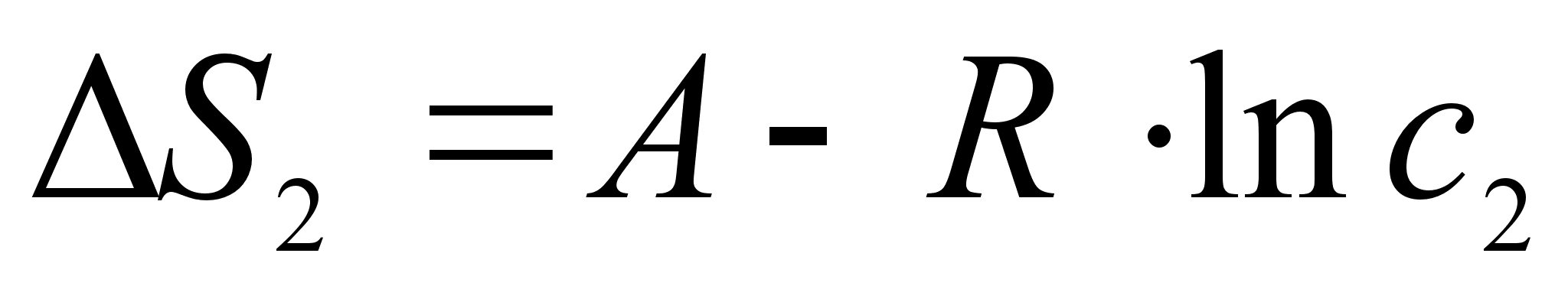
где А - постоянная величина, не зависящая от состава раствора, но зависящая от выбора единиц измерения с2. [6]
О
(36)
(37)
тсюда:
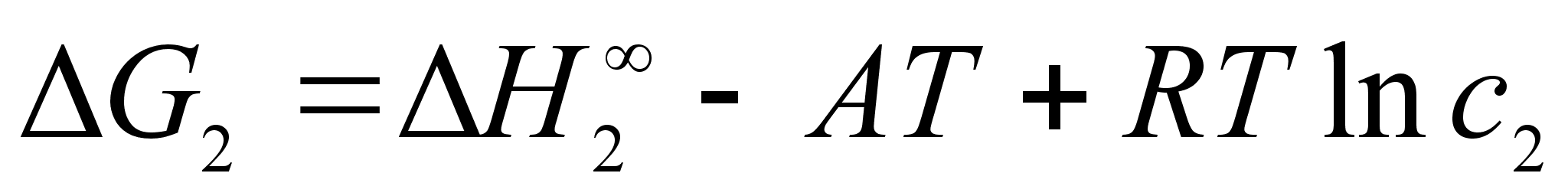
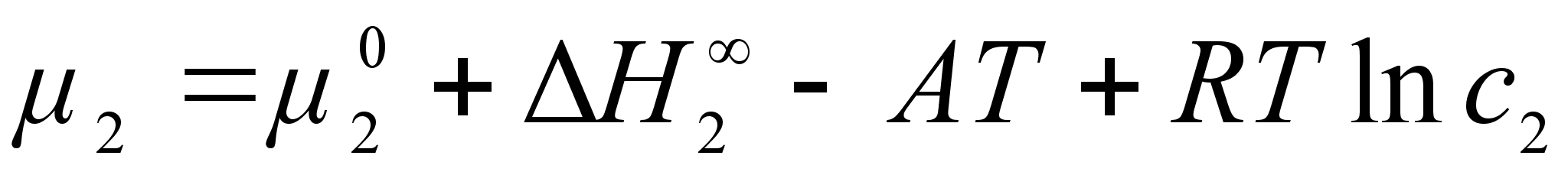
Активность компонента 2 при его концентрации х2 по отношению к гипотетическому стандартному состоянию (см. рисунок 2):
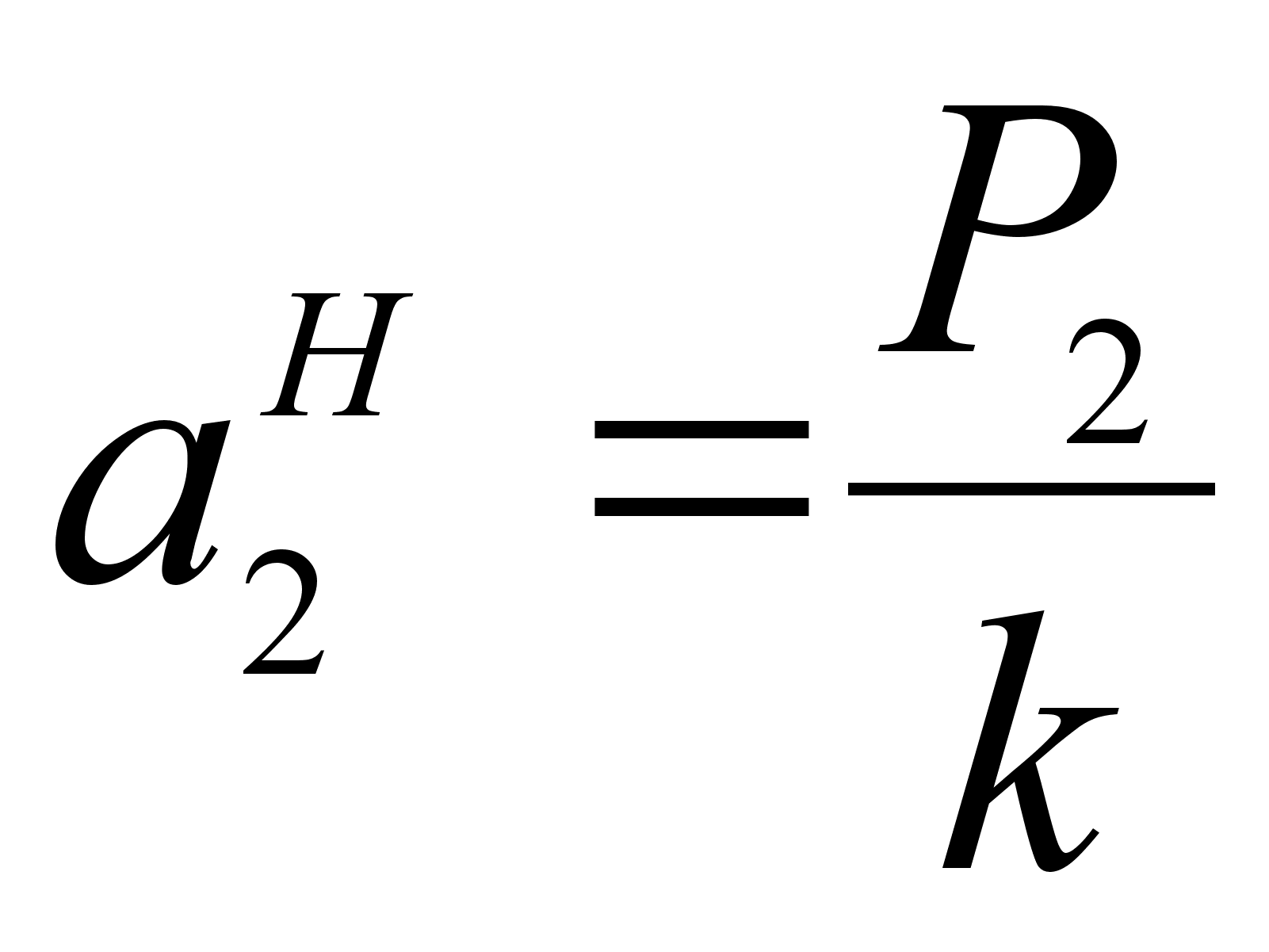
(38)
Т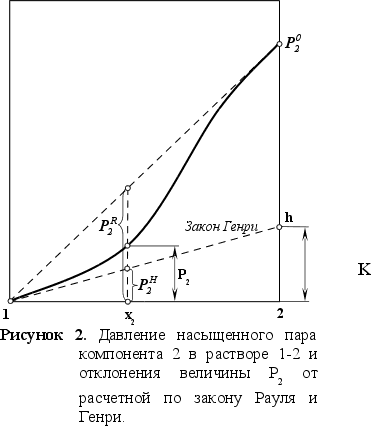 акое же выражение получается из закона Генри путем замены концентрации на активность:
акое же выражение получается из закона Генри путем замены концентрации на активность:
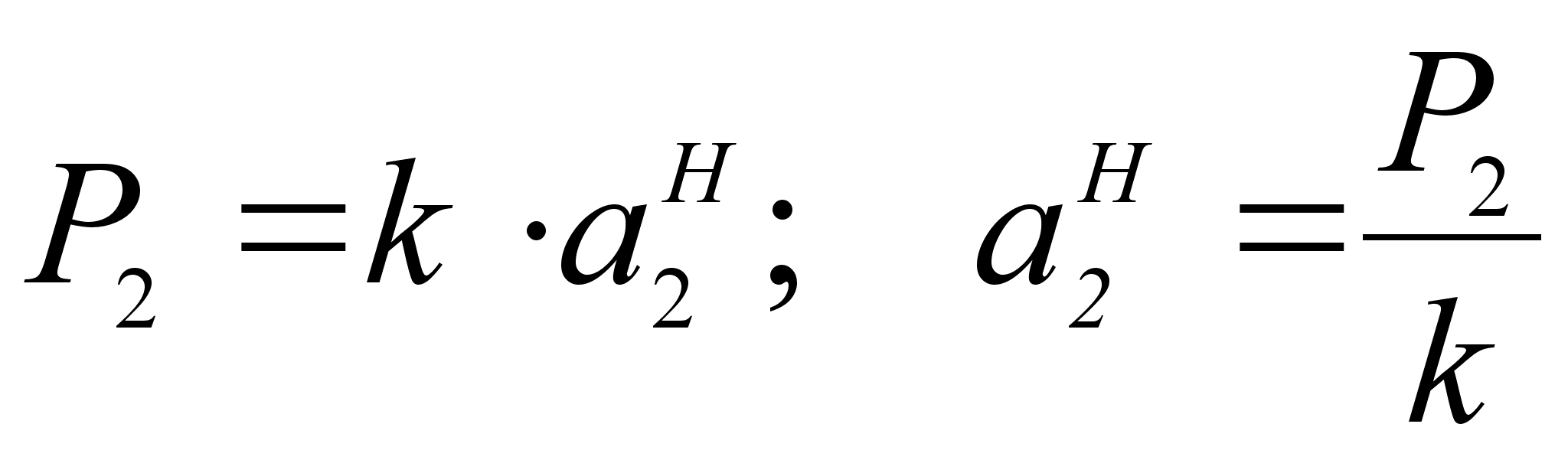 .
.
Отклонение от закона Генри характеризуется коэффициентом активности f2. Такое обозначение для коэффициента активности веществ в разбавленных растворах введено для того, чтобы отличить этот коэффициент активности, показывающий отклонения от закона Генри от коэффициента активности 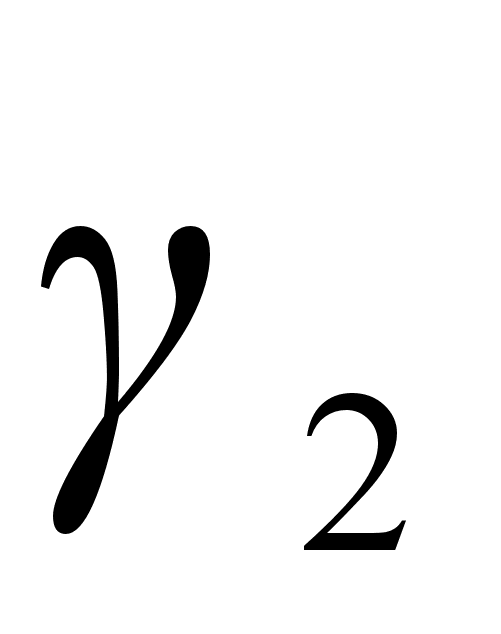 , показывающего отклонения от закона Рауля.
, показывающего отклонения от закона Рауля.
Коэффициент активности f2 связывает концентрацию компонента х2с его активностью в разбавленном растворе по отношению к гипотетическому стандартному состоянию в виде следующего выражения:

(39)
.
Из закона Генри следует, что :
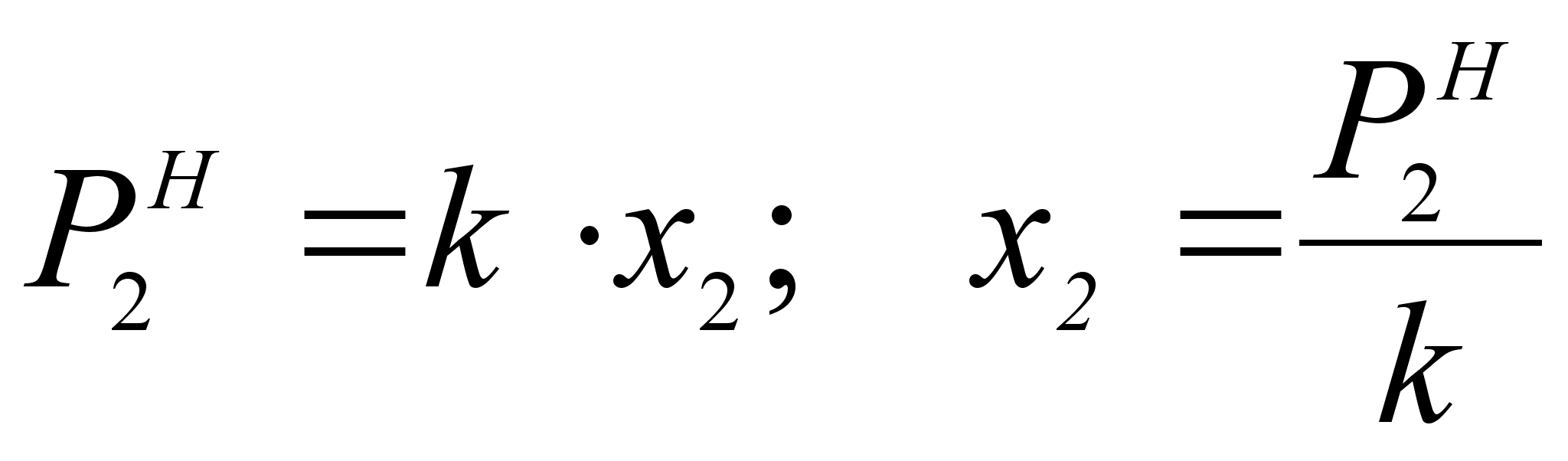
(40)
.
Поэтому коэффициент активности можно определить по соотношению (см. рисунок 2):
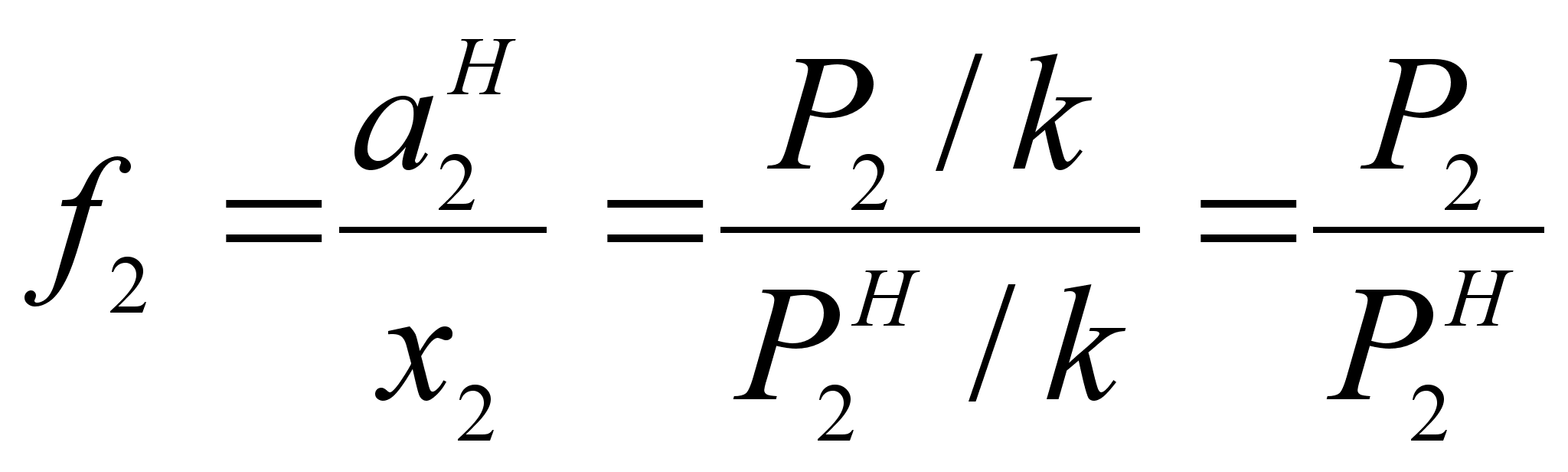
(41)
.
В области разбавленных растворов разница между Р2 и 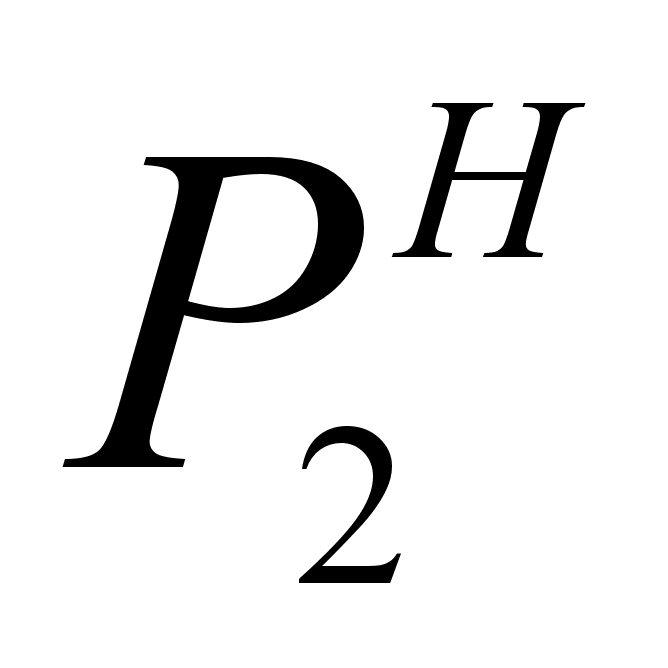 обычно мала, поэтому для области низких концентраций растворенного вещества
обычно мала, поэтому для области низких концентраций растворенного вещества 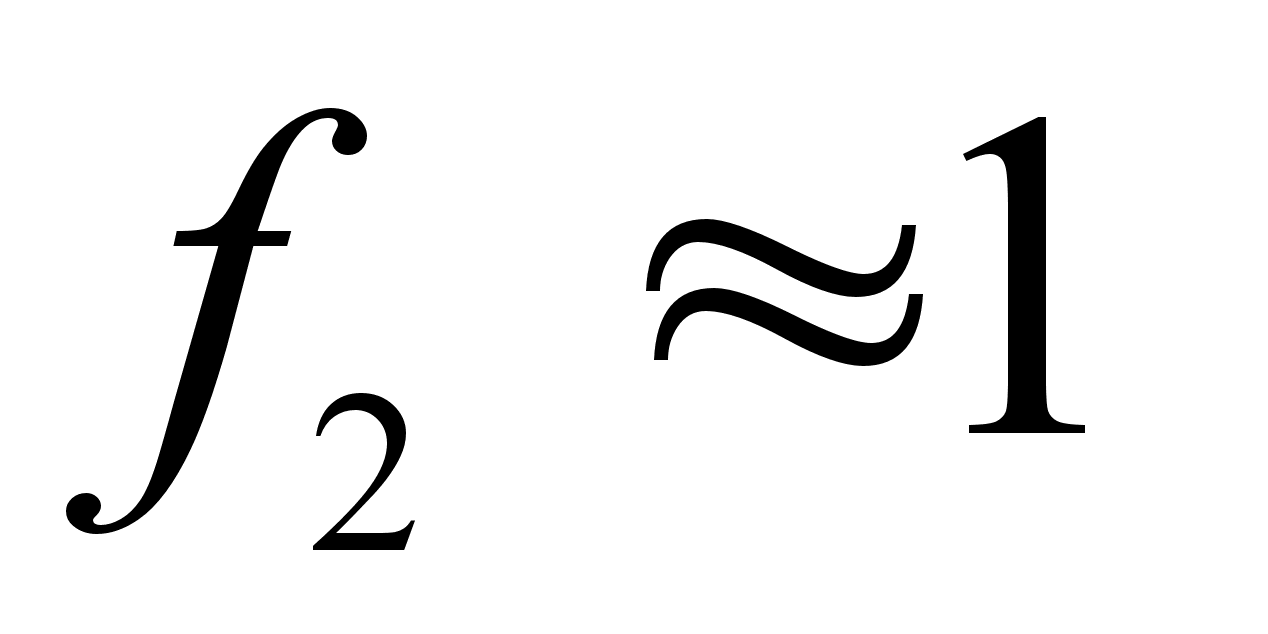 и
и 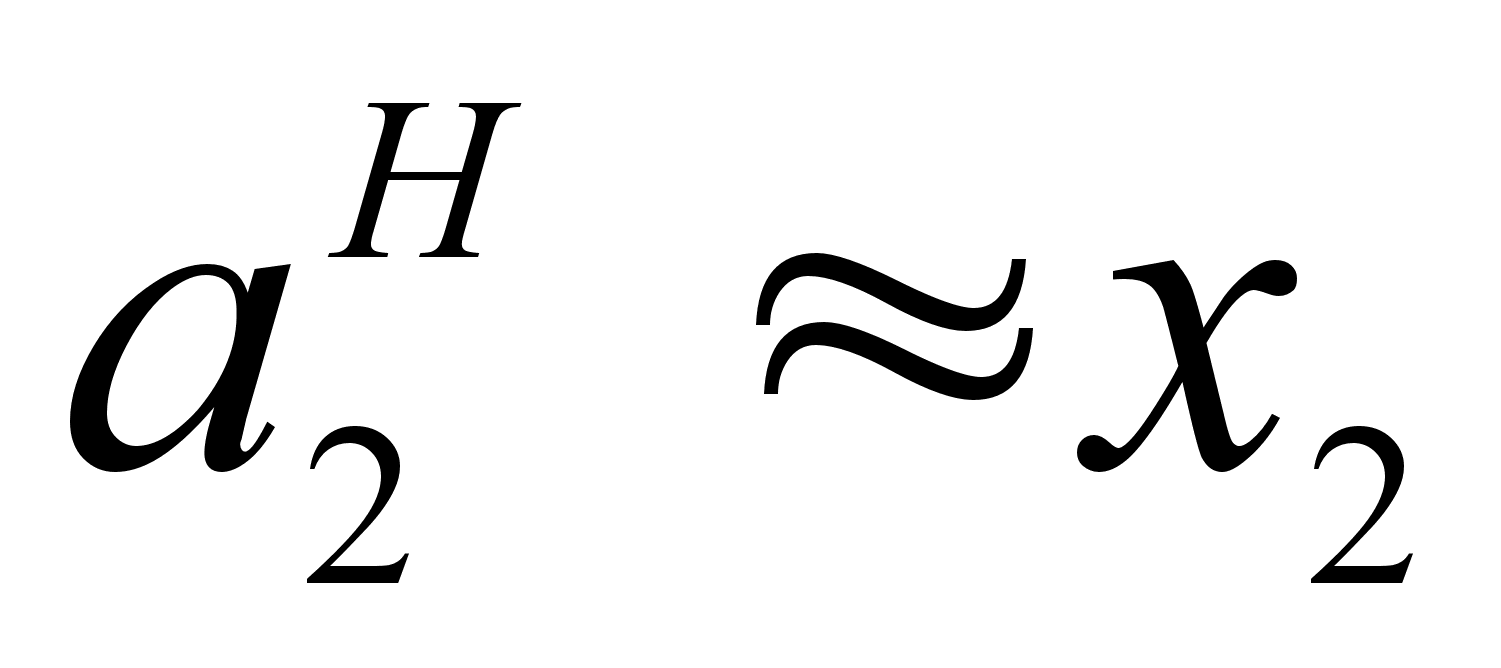 .
.
П
(42)
оскольку в разбавленном растворе молярная доля растворенного компонента пропорциональна его массовому проценту, очень удобным для практических расчетов является использование 1% стандартного состояния, поскольку это устраняет необходимость перевода процентов по массе, которыми обычно выражают состав раствора, в молярные доли. В разбавленных растворах активность растворенного компонента по отношению к этому стандартному состоянию становится равной концентрации, выраженной в процентах по массе. Активность растворенного компонента по отношению к 1%-му стандартному состоянию:
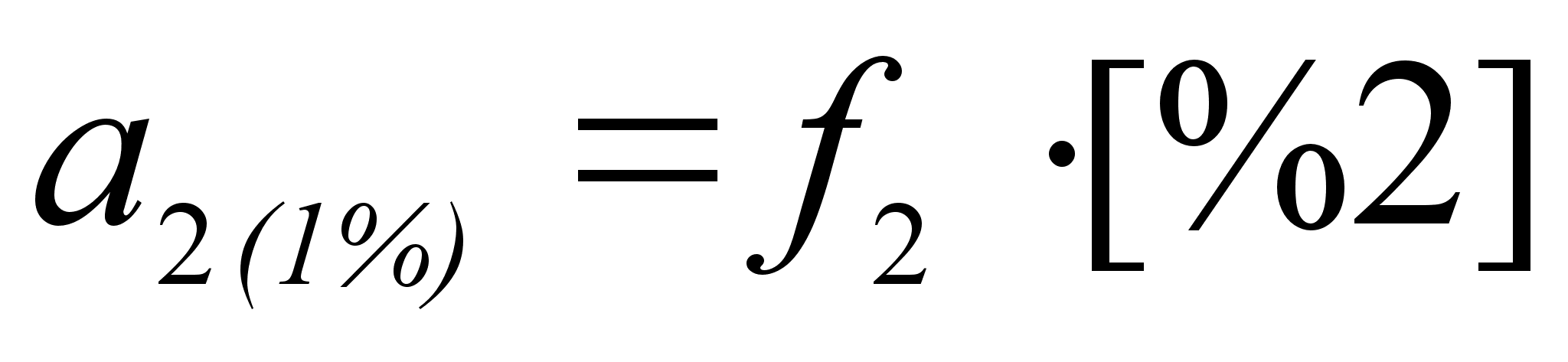
где f2 тАУ коэффициент активности для этого стандартного состояния.
[%2] тАУ концентрация компонента 2 в растворе. [5]
1.2.2 Реальные растворы
Как отмечалось, совершенные растворы характеризуются следующими свойствами: образование раствора не сопровождается тепловым эффектом (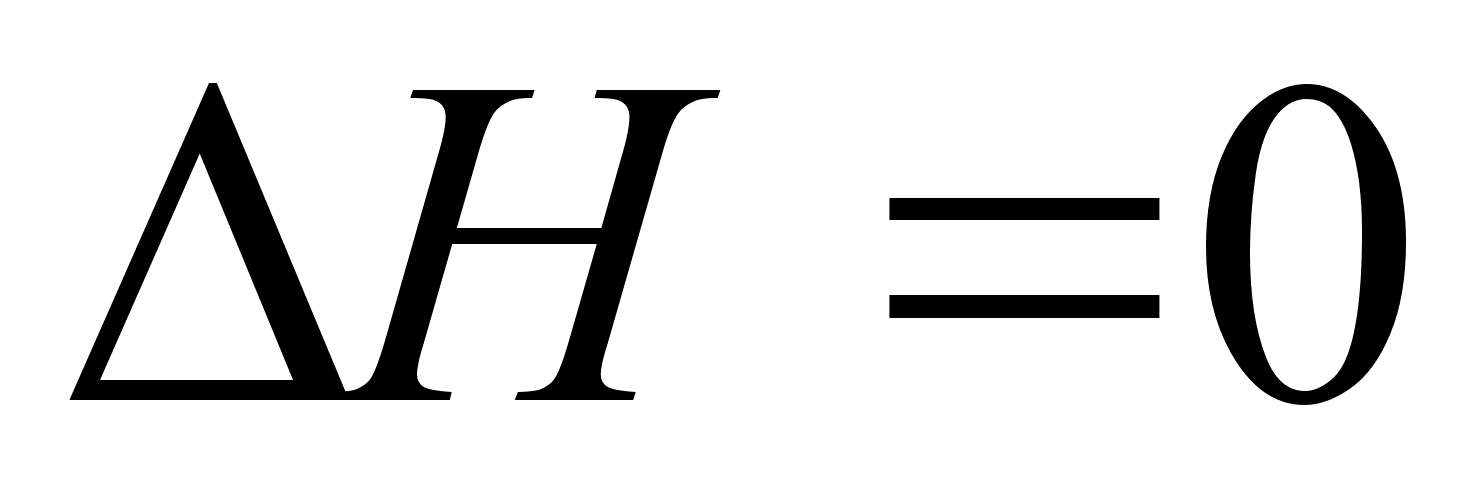 ), а изменение энтропии определяется уравнением:
), а изменение энтропии определяется уравнением:
(43)
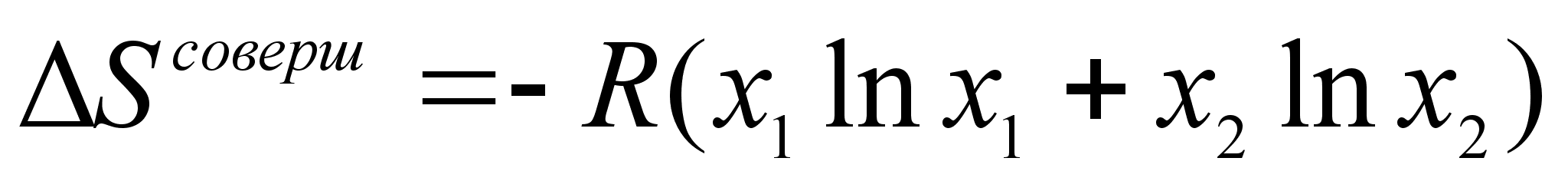
.
Р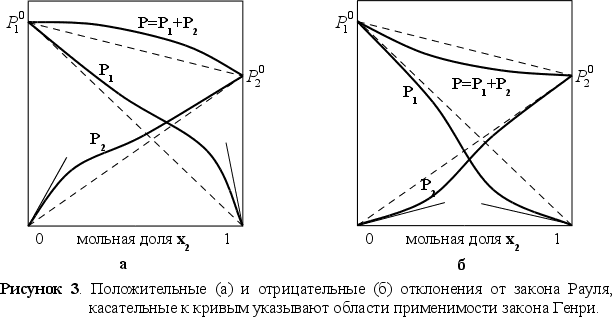
еальные растворы, вообще говоря, не обладают этими свойствами и для них не соблюдается законы Рауля и Генри. На рисунке 3 представлены зависимости давления пара от состава для двух реальных растворов.
Прямые штриховые линии соответствуют давлению пара, которое наблюдалось, если бы растворы были совершенными. На рисунке 3-а показаны положительные отклонения, при которых давление пара выше, чем для совершенного раствора такой же концентрации, а на рисунке 3-б тАУ отрицательные отклонения, где давление пара меньше, чем для совершенного раствора.
Наличие положительных отклонений показывает, что образование раствора затруднено (из-за стремления каждого типа атомов группироваться с одноименными атомами) по сравнению с совершенным. При больших отклонениях жидкости расслаиваются. Отрицательные отклонения указывают на более сильную тенденцию к образованию раствора (тенденцией атомов одного типа образовывать группы с атомами других типов), чем в случае совершенного раствора. Это означает, что есть дополнительные причины для образования раствора. [1]
И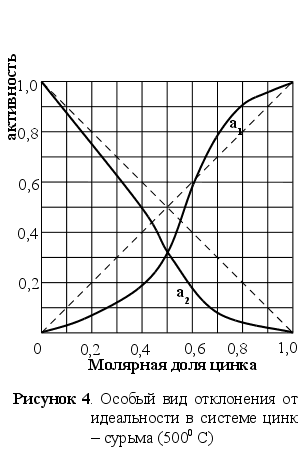 ногда в одной и той же системе встречаются и положительные и отрицательные отклонения от закона Рауля. В качестве характерного примера можно привести бинарную систему цинк тАУ сурьма, представленную на рисунке 4. Активность цинка меньше его атомной доли при малых концентрациях и больше при высоких содержаниях. Коэффициент активности вначале меньше единицы, непрерывно возрастает и становится больше единицы, а затем вблизи чистого цинка вновь понижается до единицы. Наличие обоих видов отклонений тАУ положительного и отрицательного не требует объяснений с точки зрения термодинамики, просто тенденция атомов обособляться в группы должна сильно изменяться с изменением состава раствора. [2]
ногда в одной и той же системе встречаются и положительные и отрицательные отклонения от закона Рауля. В качестве характерного примера можно привести бинарную систему цинк тАУ сурьма, представленную на рисунке 4. Активность цинка меньше его атомной доли при малых концентрациях и больше при высоких содержаниях. Коэффициент активности вначале меньше единицы, непрерывно возрастает и становится больше единицы, а затем вблизи чистого цинка вновь понижается до единицы. Наличие обоих видов отклонений тАУ положительного и отрицательного не требует объяснений с точки зрения термодинамики, просто тенденция атомов обособляться в группы должна сильно изменяться с изменением состава раствора. [2]
Так как изменение свободной энергии (энергии Гиббса) выражается уравнением (26), то отклонения в поведении реальных растворов от совершенных могут определяться как тем, что 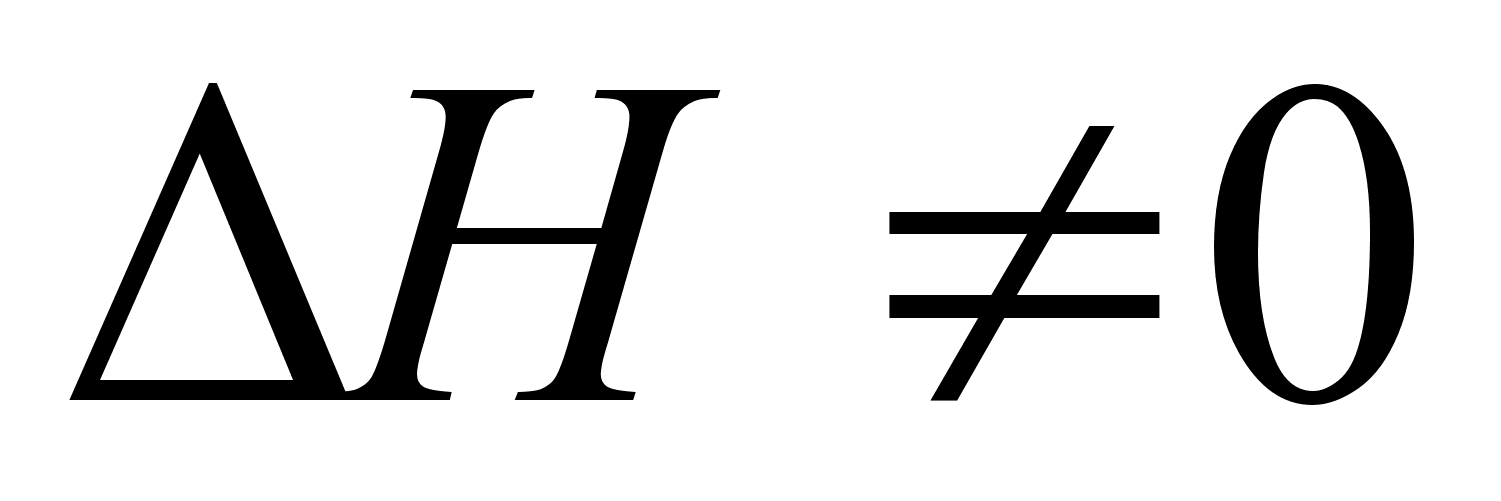 , так и тем, что изменение энтропии при смешении не подчиняется уравнению (43). [1]
, так и тем, что изменение энтропии при смешении не подчиняется уравнению (43). [1]
Д
(44)
ля характеристики отклонения реальных систем от идеальных целесообразно ввести понятие об избыточных термодинамических функциях смешения. Так, для энергии Гиббса можно записать:

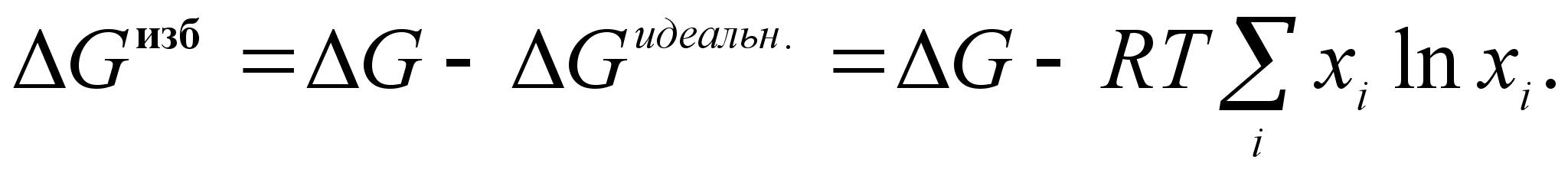
(45)
Для двухкомпонентной системы:
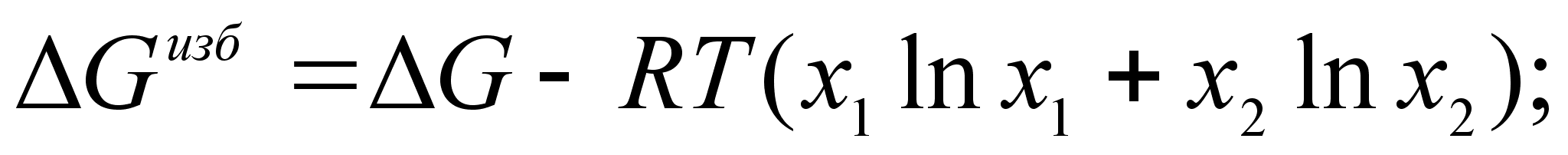
(46)
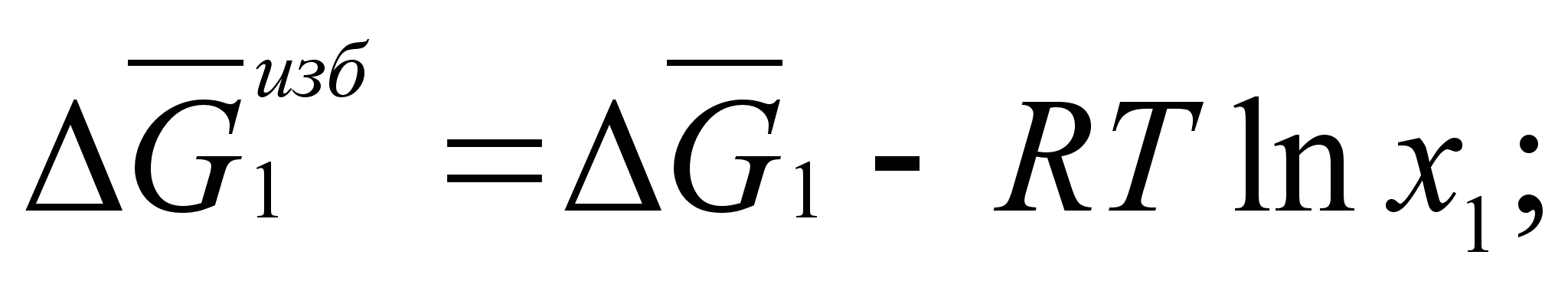
(47)
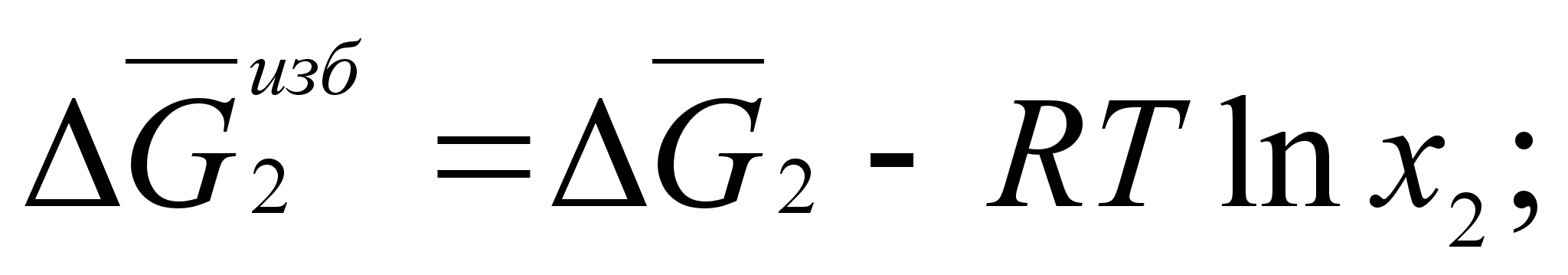
(48)
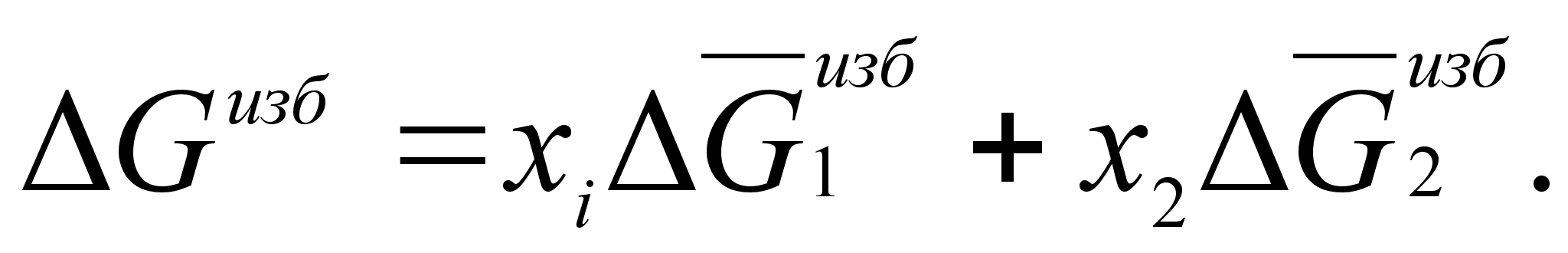
(49)
Энтропия:
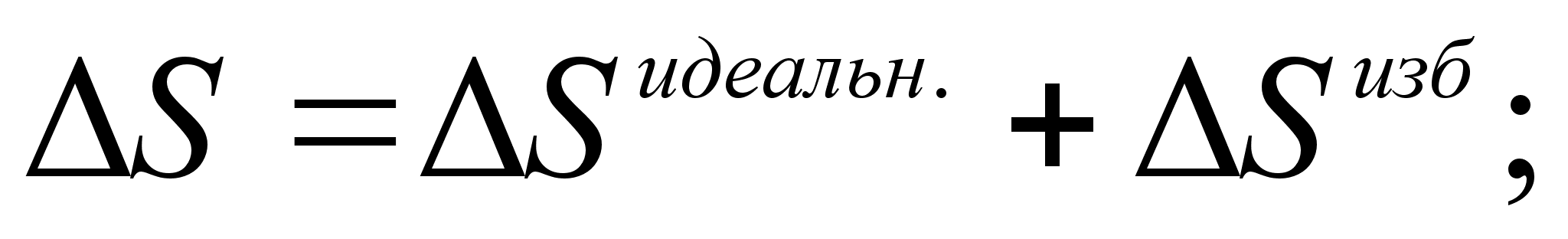
(50)
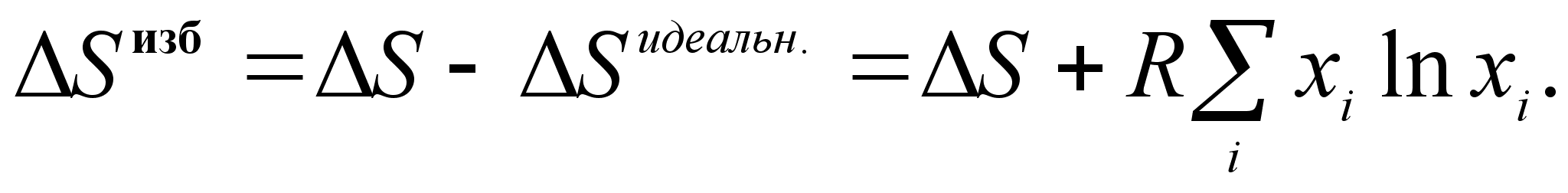
(51)
Для двухкомпонентной системы:
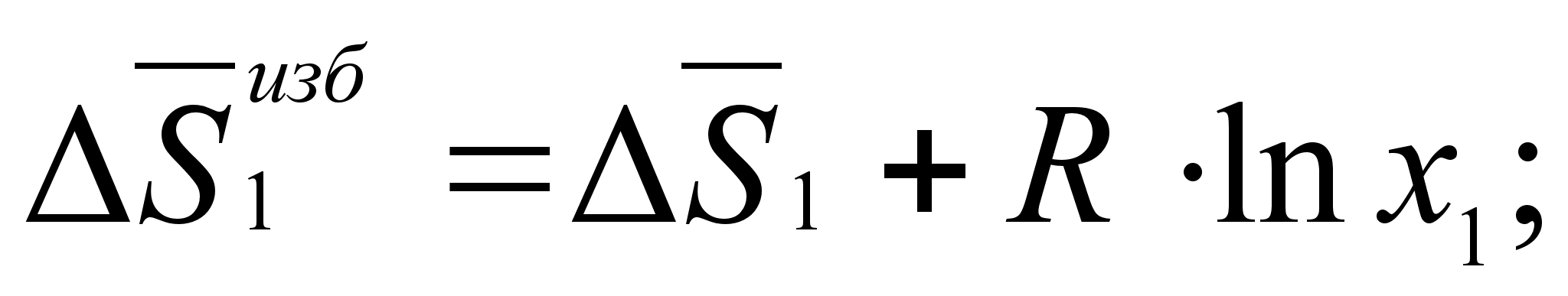
(52)
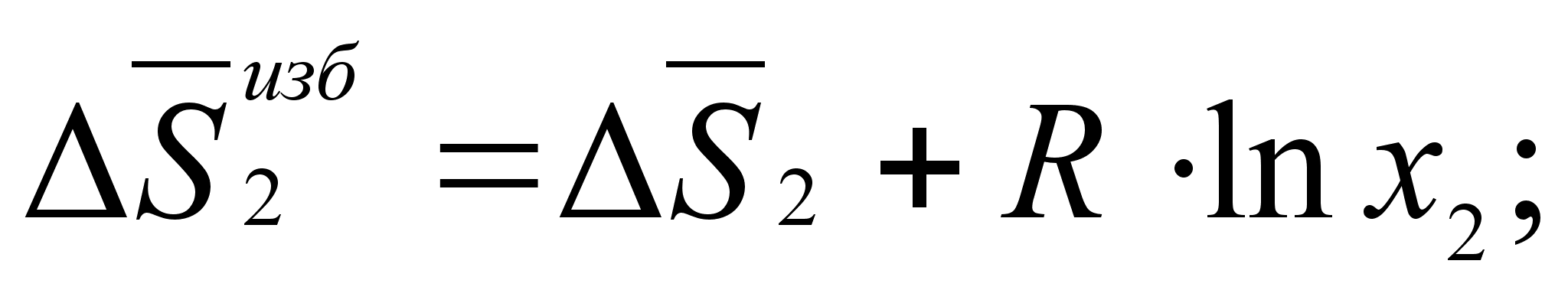
(53)
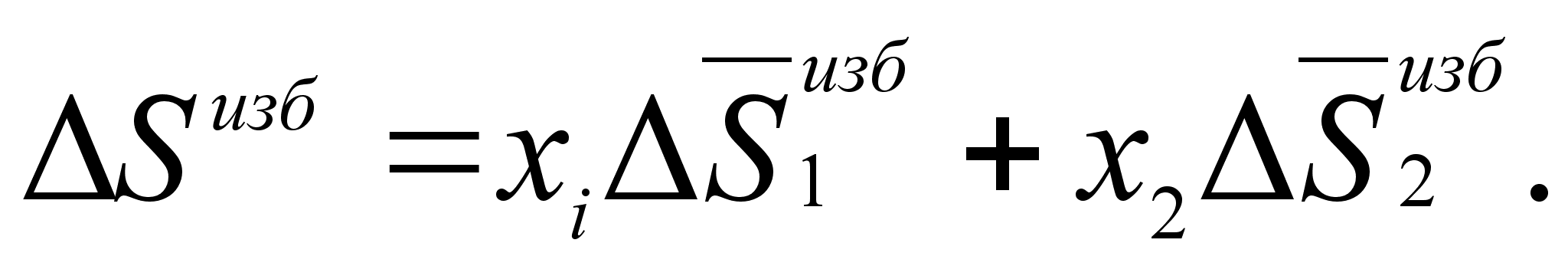
(54)
Поскольку 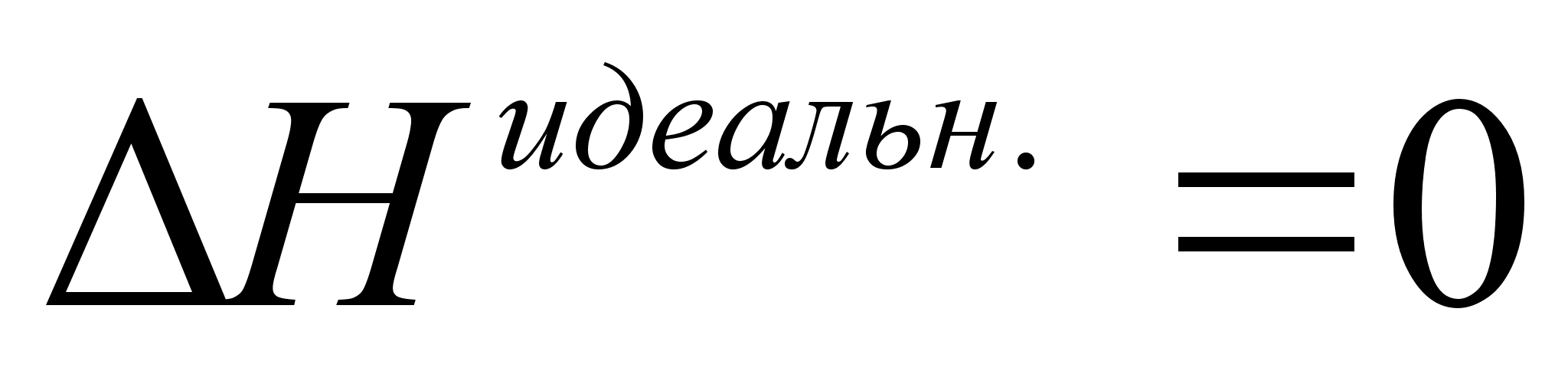 и
и 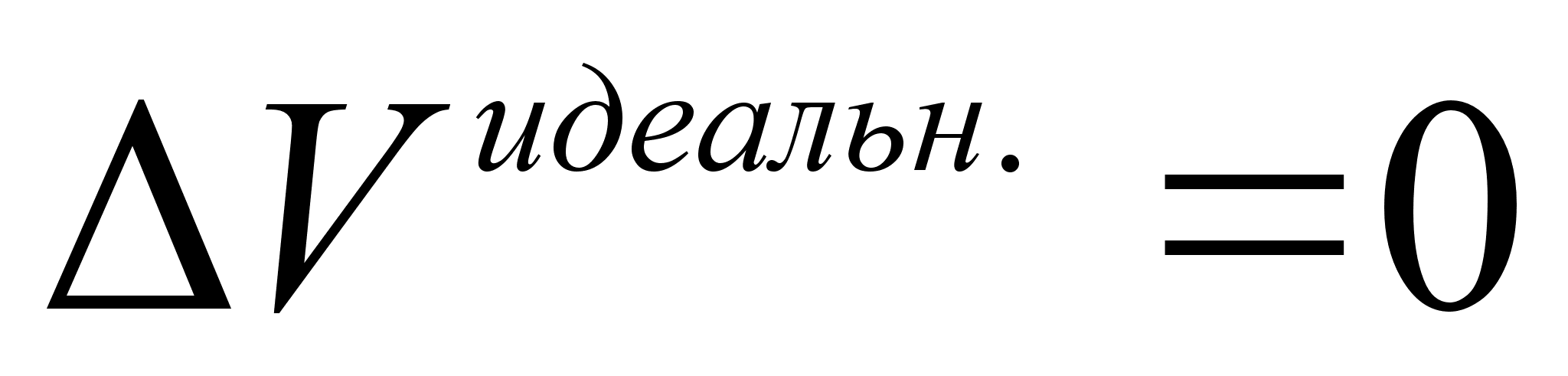 , применение термина Влизбыточные функцииВ» для энтальпии и объёма не имеют смысла.
, применение термина Влизбыточные функцииВ» для энтальпии и объёма не имеют смысла.
Для избыточных функций справедливы все общие соотношения между интегральными и парциальными величинами.
Величина 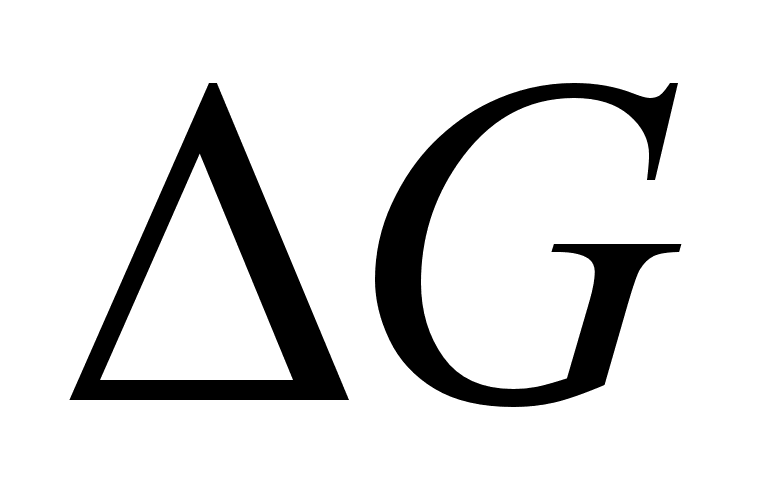 для равновесных систем всегда отрицательна. Это вытекает из общего положения, что при постоянных давлении и температуре все самопроизвольно протекающие сопровождаются убылью энергии Гиббса. Тогда:
для равновесных систем всегда отрицательна. Это вытекает из общего положения, что при постоянных давлении и температуре все самопроизвольно протекающие сопровождаются убылью энергии Гиббса. Тогда: 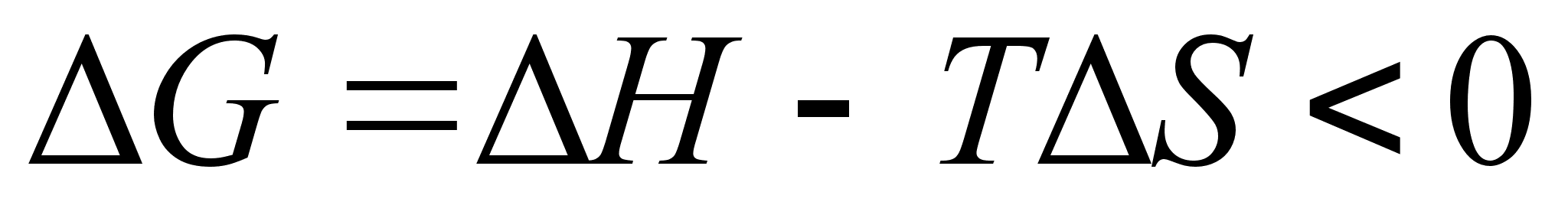 .
.
Каких-либо ограничений для знаков  и
и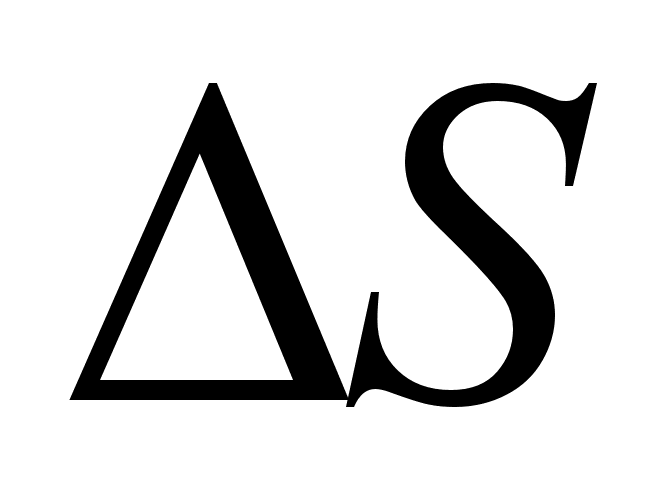 нет. Если
нет. Если 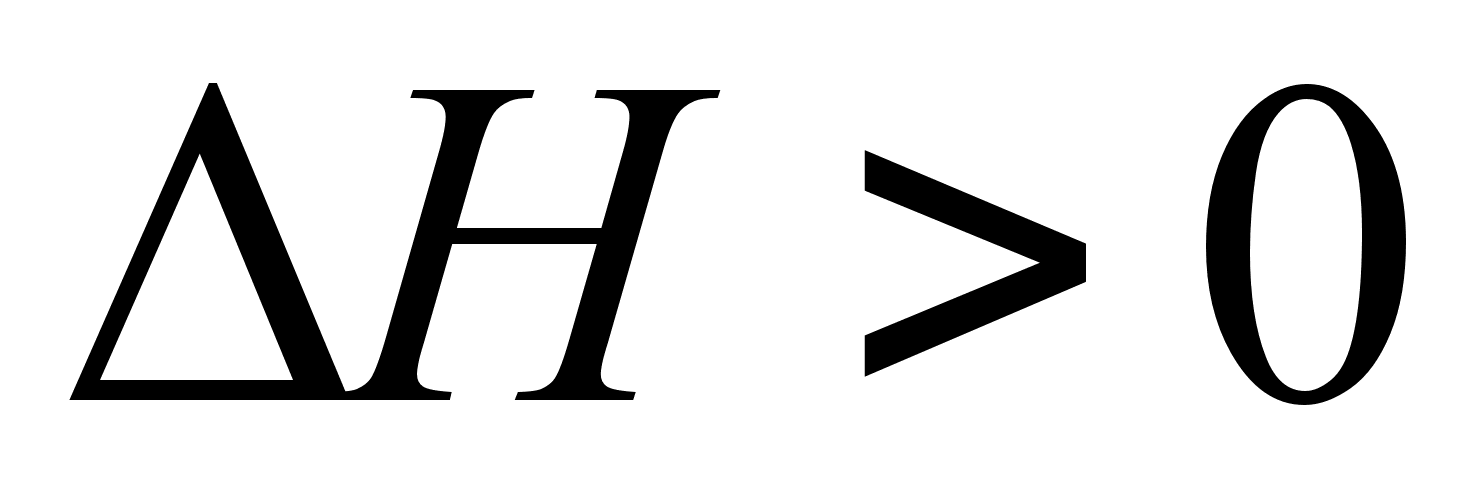 , то
, то 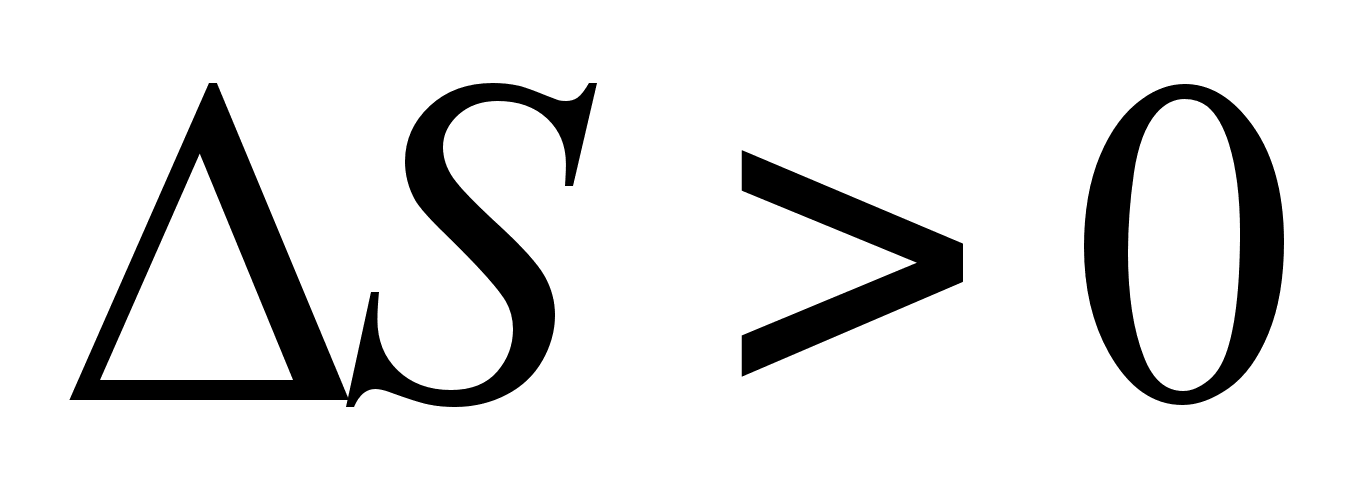 и
и 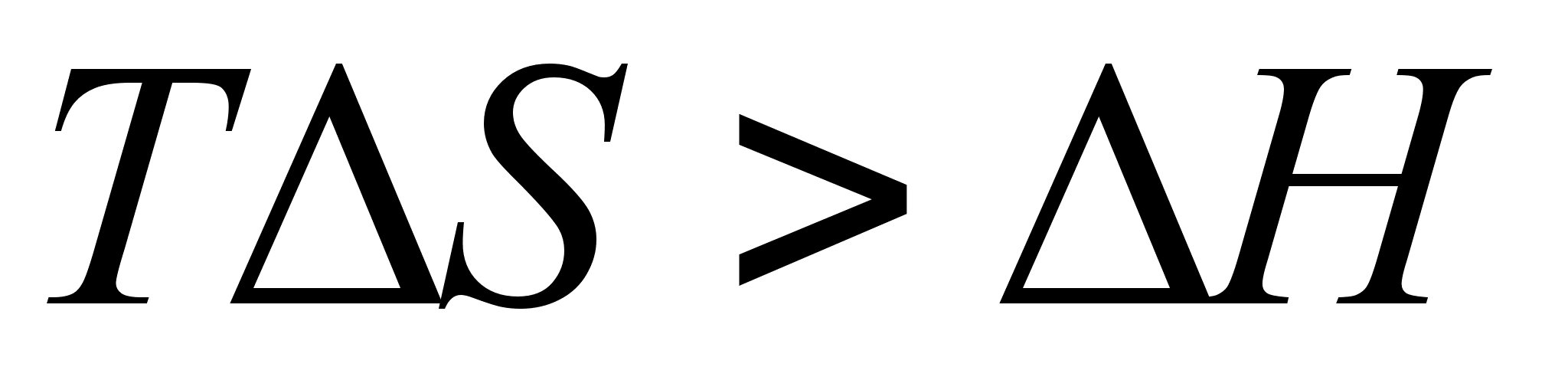 ; если
; если 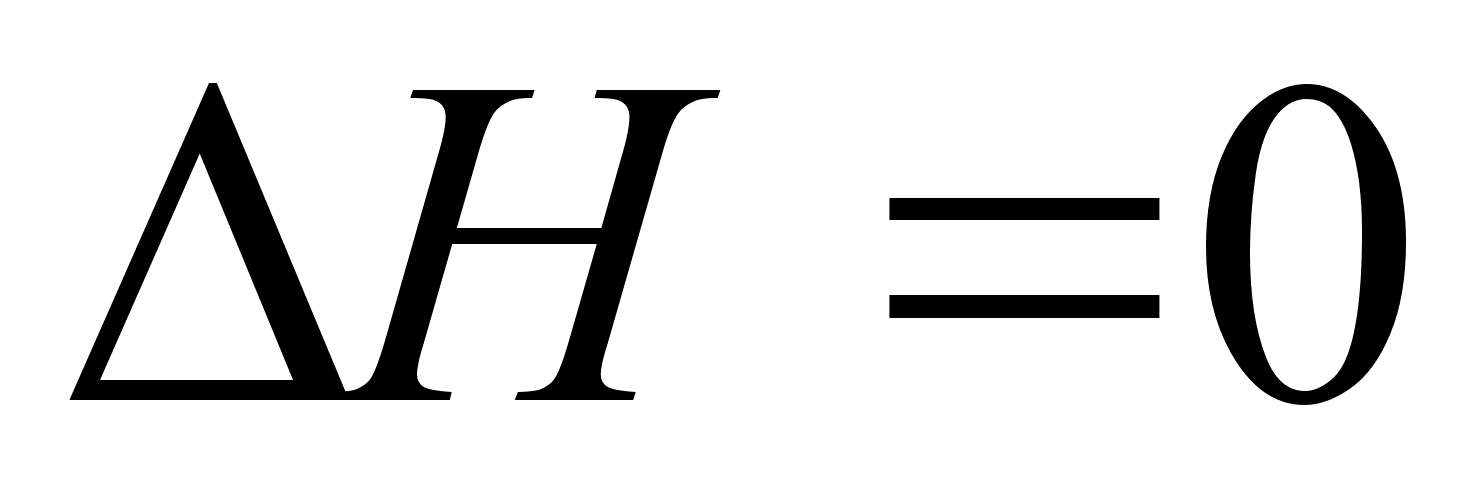 , то
, то 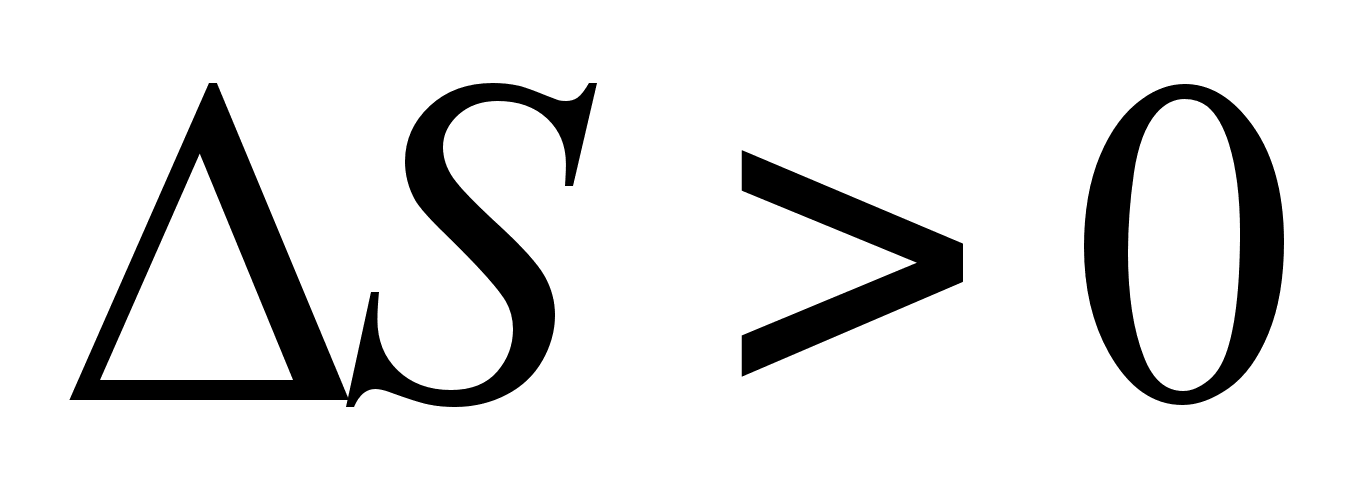 ; если
; если 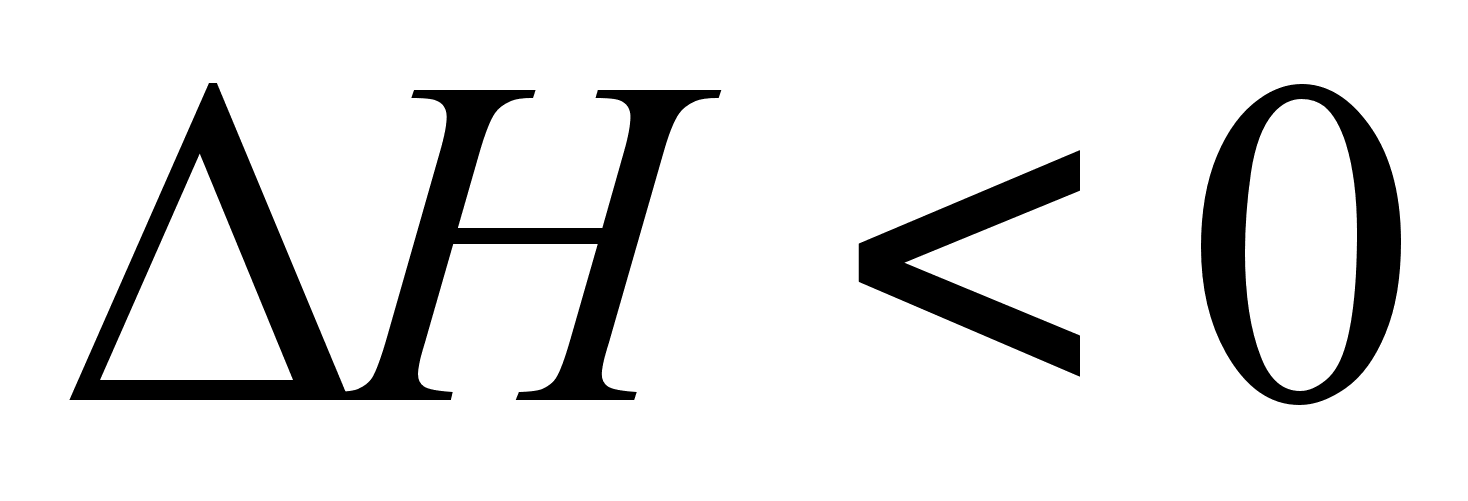 , то
, то 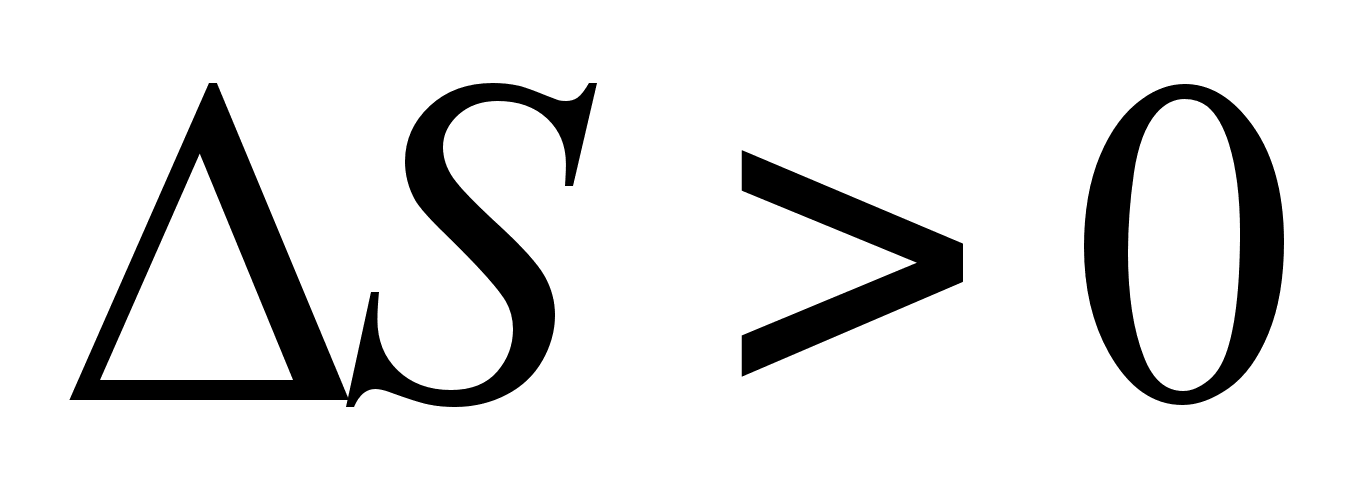 или
или  .
.
В последнем случае по абсолютной величине  должно превышать произведение
должно превышать произведение  . Аналогичные соотношения распространяются и на парциальные мольные энтальпию и энтропию. [3]
. Аналогичные соотношения распространяются и на парциальные мольные энтальпию и энтропию. [3]
1.2.2.1 Регулярные растворы
Р
(55)
егулярными называются растворы, образование которых сопровождается тепловым эффектом, а величина
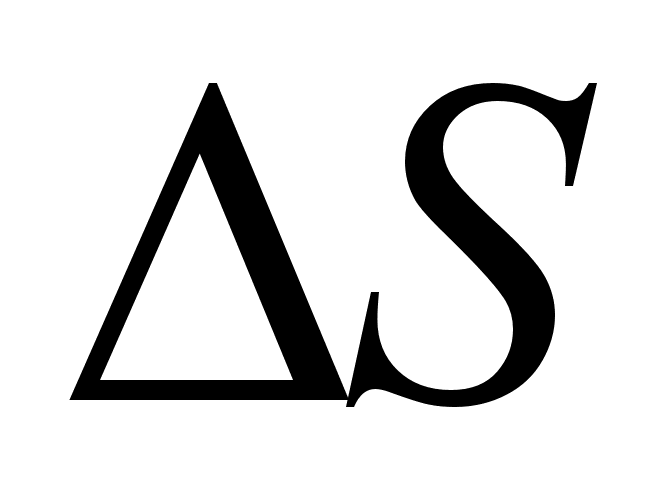
такая же, как для совершенных. [1] Таким образом, отклонение регулярного раствора от совершенного, т.е. появление избыточной энергии Гиббса обусловлено только энтальпийным членом:
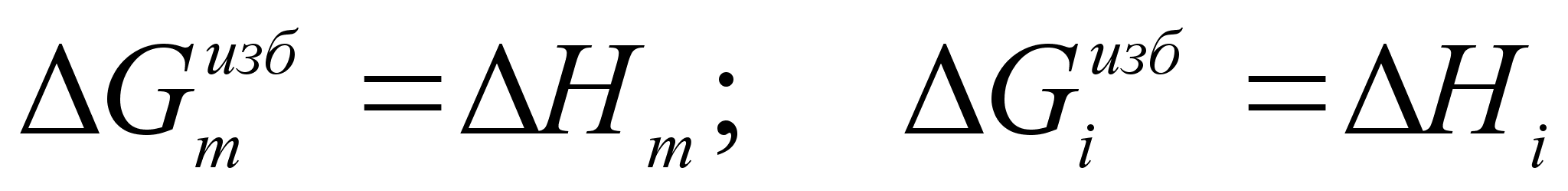
И
(56)
з этого выражения можно вывести важное для практических расчетов соотношение:
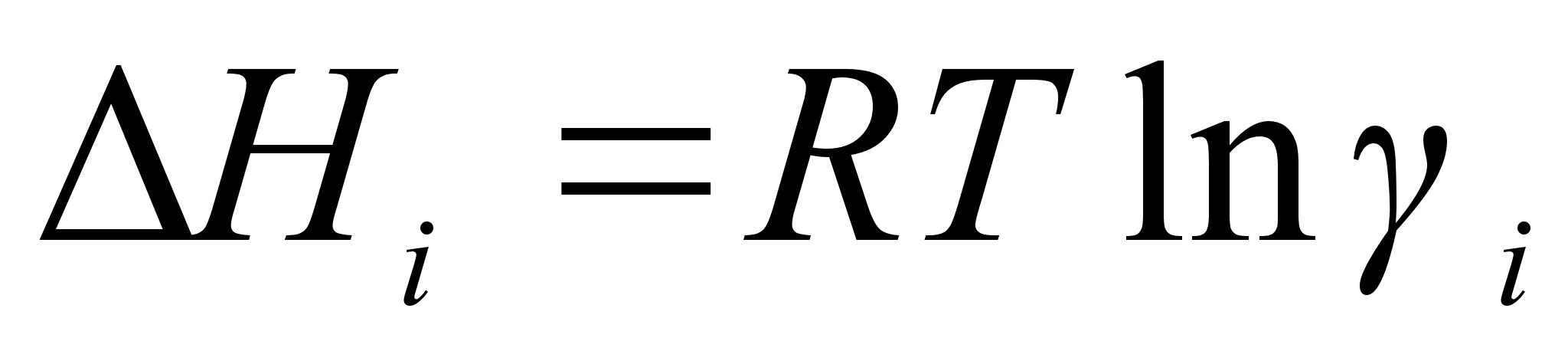 ,
,
которое позволяет оценить температурную зависимость коэффициента активности, если известно хотя бы одно его значение. Принимая, что  не зависит от температуры, данное выражение можно записать, например:
не зависит от температуры, данное выражение можно записать, например:
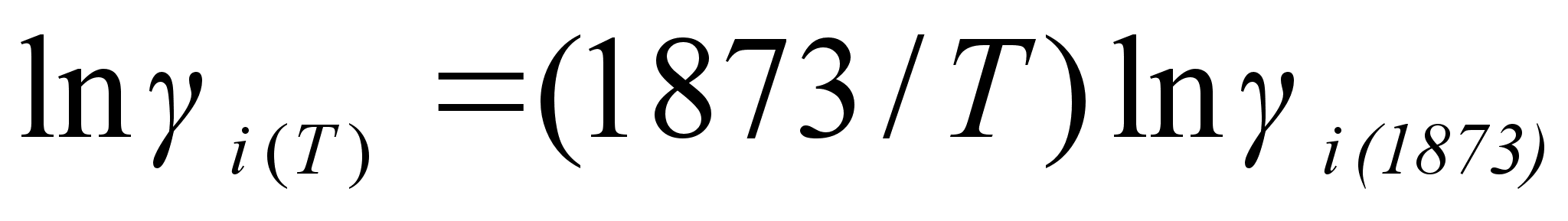
(57)
.
Предполагается, что энтропийная составляющая энергии Гиббса в регулярном растворе такая же, как в совершенном, и может быть рассчитана исходя из допущения о полной хаотичности в расположении атомов. Таким образом, энергия Гиббса в регулярном растворе определяется следующими выражениями:

(58)
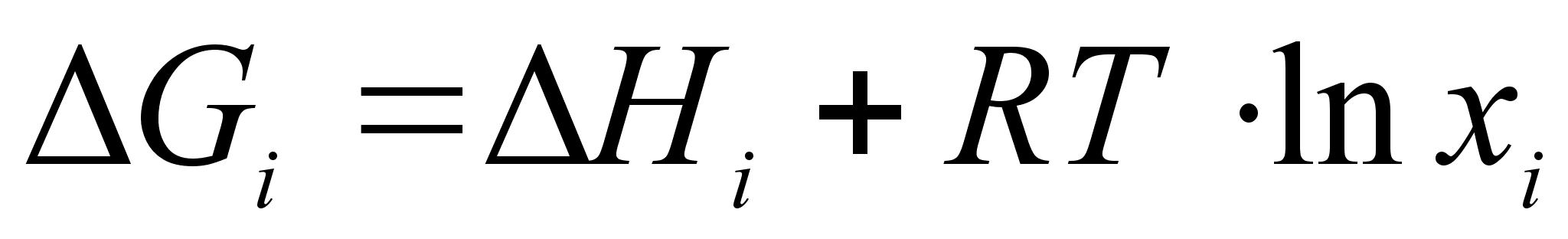
(59)
.
Допущение о хаотичности расположения атомов при определенном взаимодействии между ними является главным противоречием модели регулярного раствора, ограничивающим область её применения. Очевидно, что наилучшие результаты модель регулярных растворов может дать для систем с относительно слабым взаимодействием. В таких системах величина  , характеризующая тенденцию к упорядочению (к определенной группировке атомов), должна быть не больше (или не на много больше), чем энергия теплового движения атомов RT, определяющая тенденцию к разупорядочению. С повышением температуры область возможного применения теории регулярных растворов увеличивается.
, характеризующая тенденцию к упорядочению (к определенной группировке атомов), должна быть не больше (или не на много больше), чем энергия теплового движения атомов RT, определяющая тенденцию к разупорядочению. С повышением температуры область возможного применения теории регулярных растворов увеличивается.
Р
(60)
яд полезных соотношений теории регулярных растворов может быть получен из статистического анализа модели, предполагающей хаотическое расположение атомов по узлам некоторой решетки, существование которой допускается как в твердом теле, так и в жидкости. Одним из результатов такого анализа является следующее выражение для избыточной энергии Гиббса образования одного моля регулярного раствора из чистых компонентов
1 и
2:
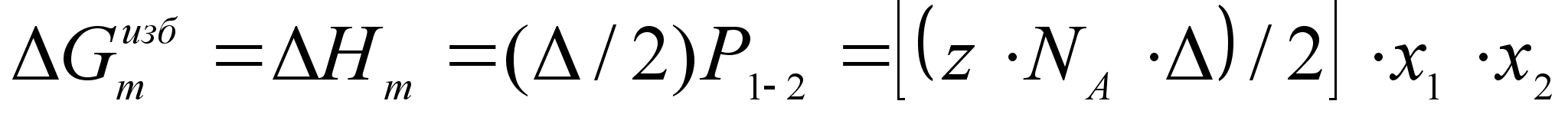 ,
,
где z тАУ число ближайших соседей атома;
NA тАУ число Авогадро;
 - энергия образования двух связей между разноименными атомами:
- энергия образования двух связей между разноименными атомами:
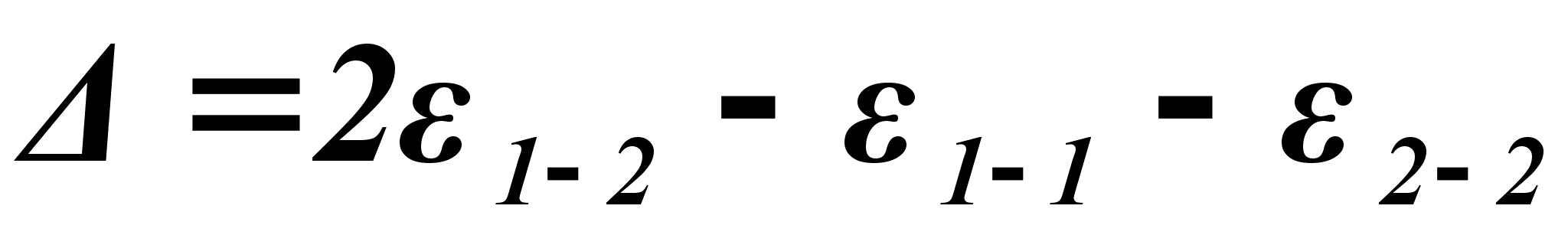
(61)
Р
(62)
1-2тАУ число связей 1-2; при хаотическом расположении атомов:
Р1-2=z NA x1x2 .
Р
(63)
ассмотрим концентрационную зависимость величины

, следующую из данного уравнения. Величину

, не зависящую от состава, обозначим

(энергия смешения). Подставляя, получим:
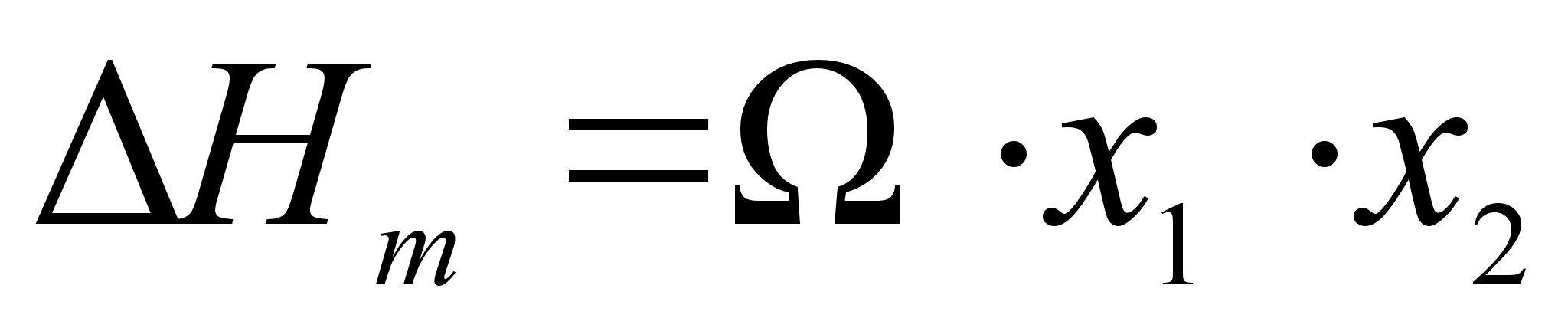 ,
,
что соответствует параболе с экстремумом в точке х1=х2=0,5. Экспериментальное значение  в этой точке равно
в этой точке равно 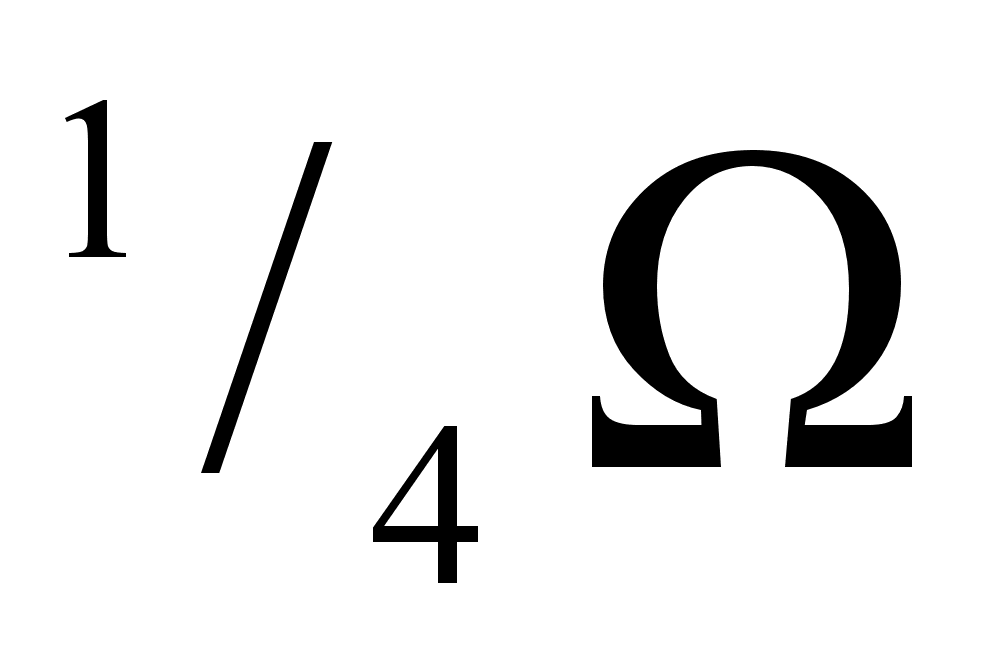 . Для определения парциальных энтальпий компонентов
. Для определения парциальных энтальпий компонентов  и
и  необходимо продифференцировать данное уравнение, переписав его для раствора, содержащего 1+ n2 молей компонентов, следующим образом:
необходимо продифференцировать данное уравнение, переписав его для раствора, содержащего 1+ n2 молей компонентов, следующим образом:
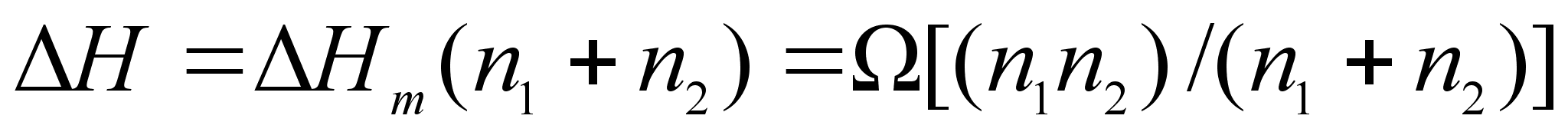
(64)
.
Отсюда получим:
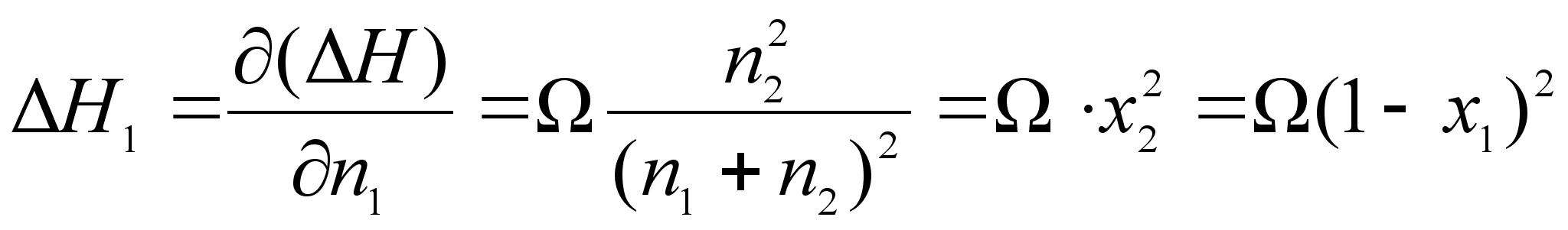
(65)
(66)
,
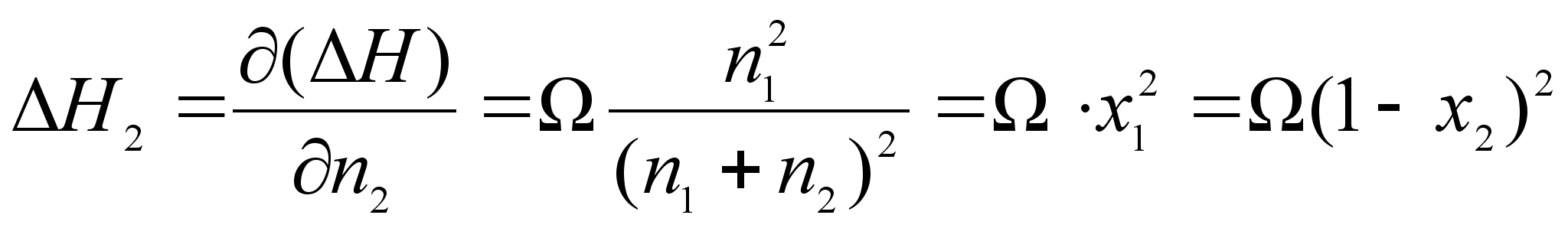
.
Как видно из уравнений, энергия смешения  равна предельному значению
равна предельному значению 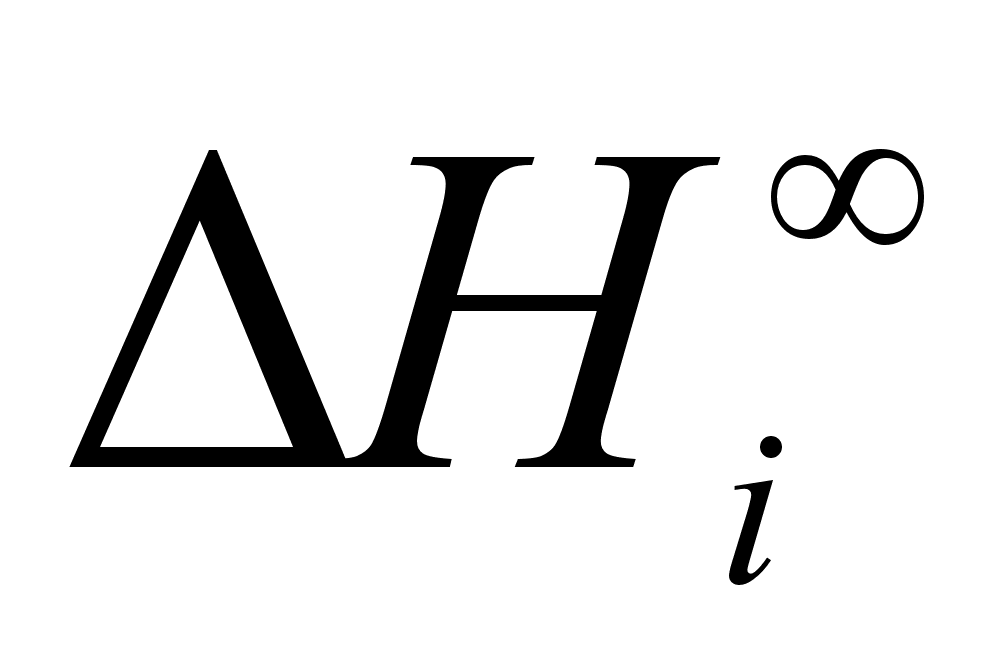 (при
(при  ). Учитывая связь между теплотой растворения и коэффициентом активности, можно получить следующее выражение для зависимости коэффициентов активности от концентрации:
). Учитывая связь между теплотой растворения и коэффициентом активности, можно получить следующее выражение для зависимости коэффициентов активности от концентрации:
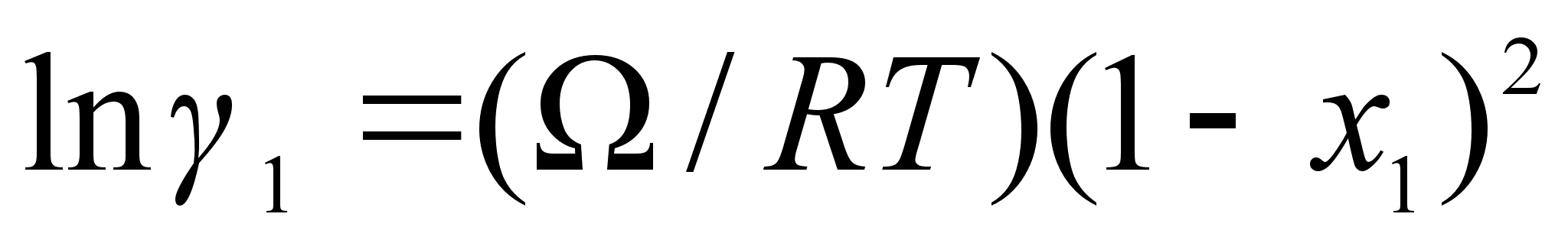
(67)
;
(68)
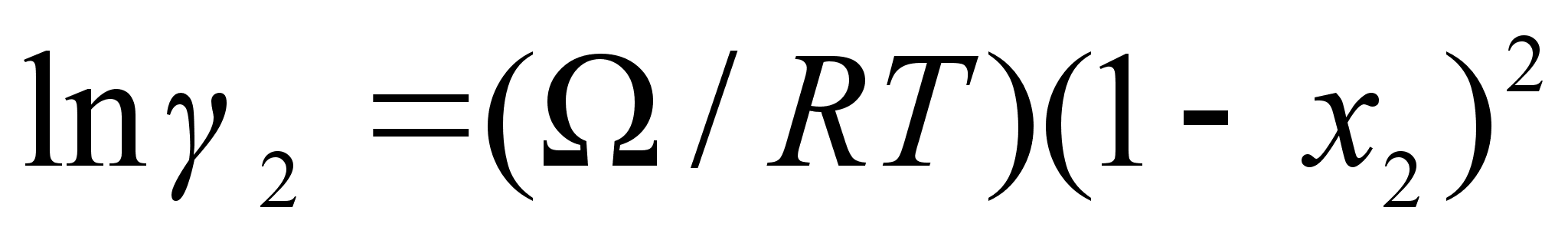
.
Из данных уравнений следует, что при  коэффициент
коэффициент  стремится к
стремится к 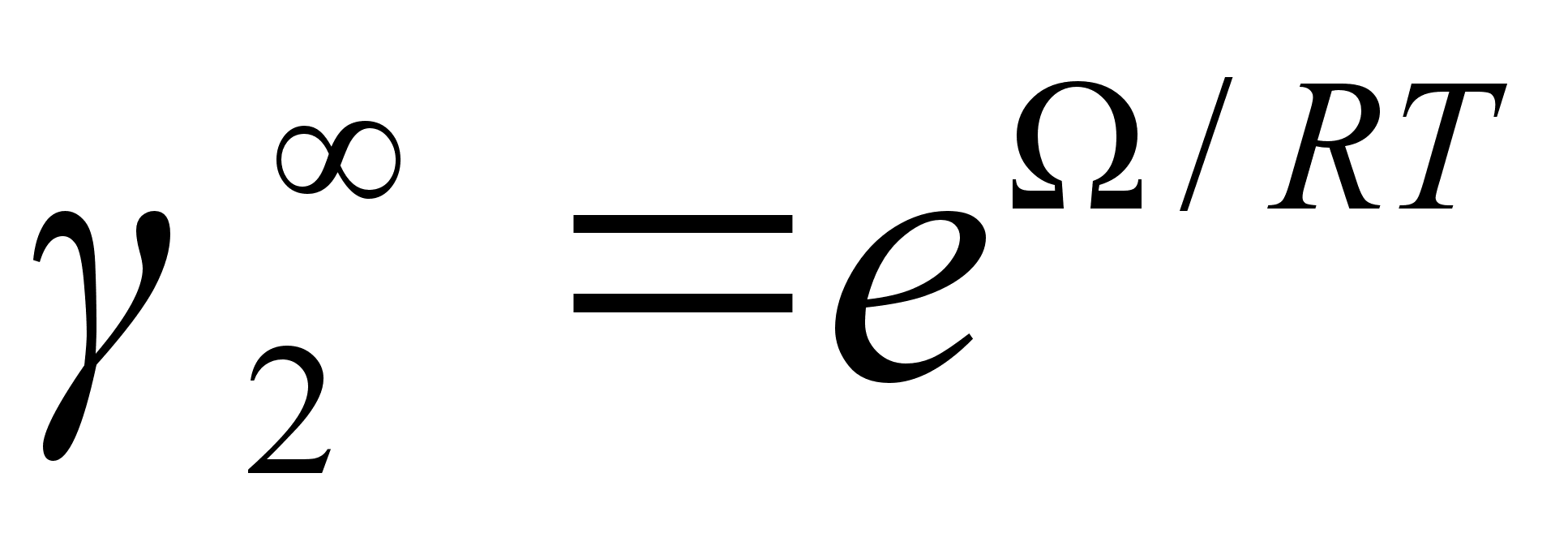 , а
, а  . Таким образом, в теории регулярных растворов возможно только приближенное выполнение законов Генри (
. Таким образом, в теории регулярных растворов возможно только приближенное выполнение законов Генри (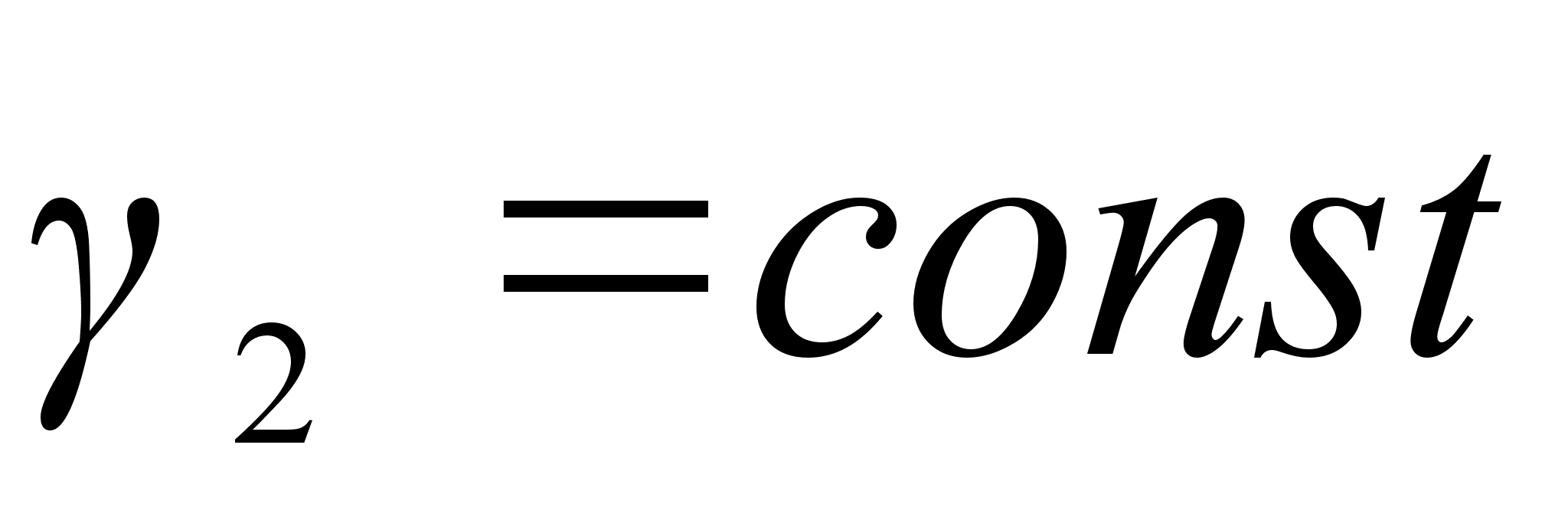 ) и Рауля(
) и Рауля(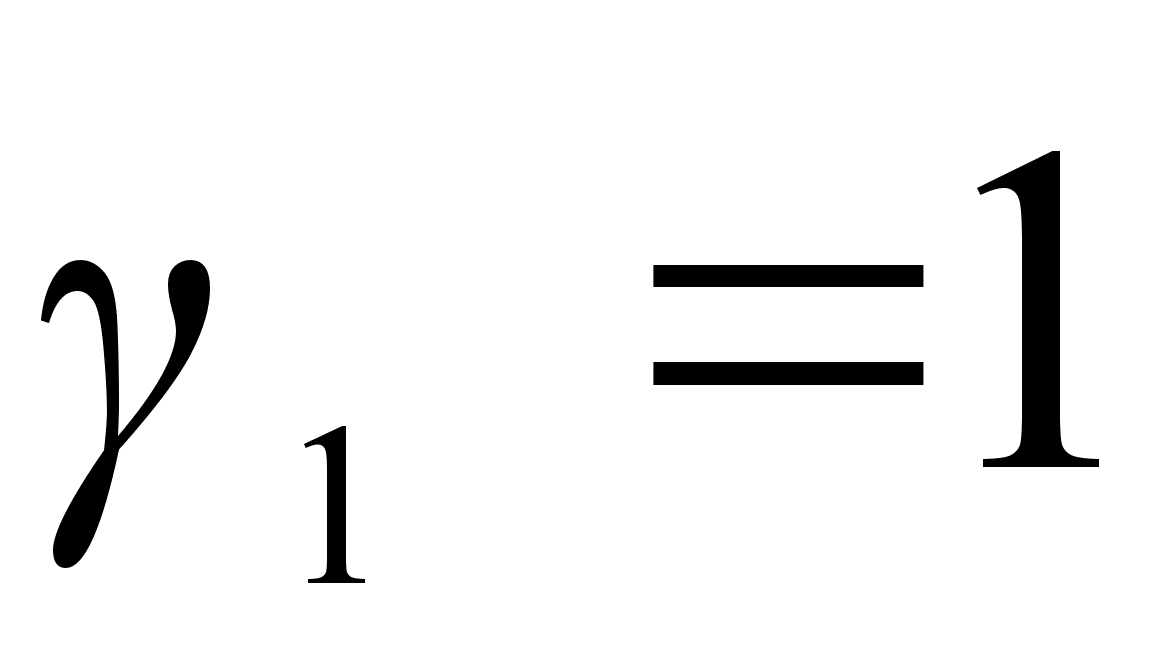 ) в области малых значений х2 отличных от нуля.
) в области малых значений х2 отличных от нуля.
Таким образом, энергия Гиббса (для бинарного раствора):
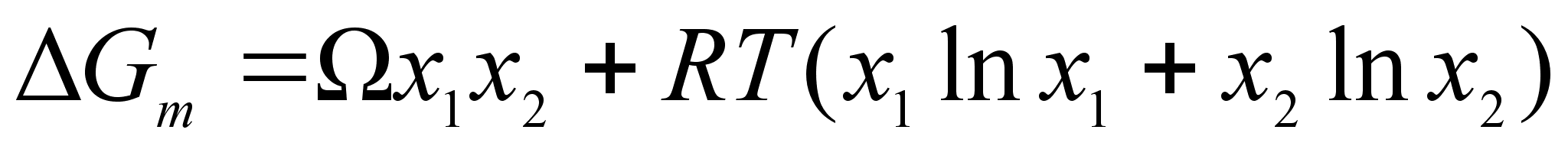
(68)
;
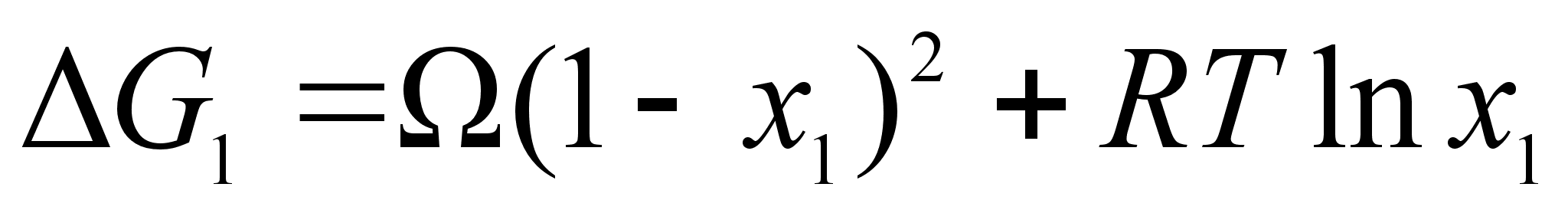
(68)
;
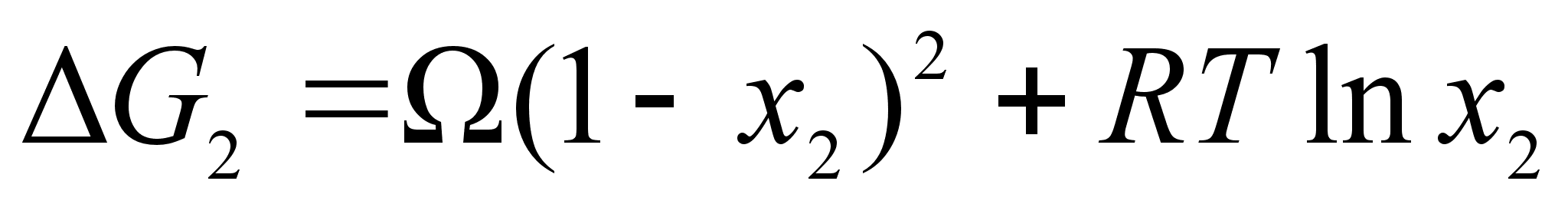
(68)
.
Как видно, все основные термодинамические характеристики регулярного раствора, включая температурную и концентрационную зависимость активности, могут быть рассчитаны, если известен один параметр тАУ энергия смешения  . Величину
. Величину  , принимаемую в простейшем случае не зависящей от температуры и концентрации, можно рассчитать по данным одного эксперимента. Такой расчет может быть выполнен при помощи уравнений (65), (66) по известной величине
, принимаемую в простейшем случае не зависящей от температуры и концентрации, можно рассчитать по данным одного эксперимента. Такой расчет может быть выполнен при помощи уравнений (65), (66) по известной величине  или по уравнениям (67), (68) если известно одно значение коэффициента активности
или по уравнениям (67), (68) если известно одно значение коэффициента активности  (при заданных концентрации и температуре). Отметим для сравнения, что в теории идеальных разбавленных растворов для вычисления
(при заданных концентрации и температуре). Отметим для сравнения, что в теории идеальных разбавленных растворов для вычисления  как функции температуры требуется не менее двух значений
как функции температуры требуется не менее двух значений 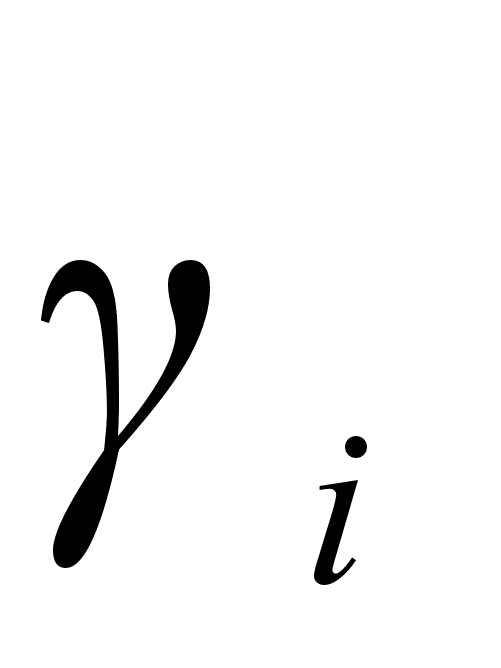 при разных Т (см. уравнение (36)).
при разных Т (см. уравнение (36)).
Таким образом, теория регулярных растворов предоставляет довольно широкие возможности для расчета термодинамических характеристик. Однако довольно ограничен круг расплавов, которые могут быть описаны этой теорией с удовлетворительной степенью точности и в широком диапазоне температур и концентраций. Проведенный анализ имеющихся экспериментальных данных о 175 бинарных металлических системах показал, что только восемь из них можно удовлетворительно описать теорией регулярных растворов в простейшем её варианте. На практике эти уравнения часто используют в качестве интерполяционных формул в ограниченном интервале температур или концентраций. При этом величину  подбирают таким образом (например, при помощи метода наименьших квадратов), чтобы уравнения соответствовали всей данной совокупности экспериментальных значений. Далекая экстраполяция найденных таким способом зависимостей в область неисследованных температур и концентраций, как правило, недопустима. Тем не менее, во многих случаях теория регулярных растворов может быть использована для обработки экспериментальных данных и практических расчетов. Наилучшие результаты эта теория дает
подбирают таким образом (например, при помощи метода наименьших квадратов), чтобы уравнения соответствовали всей данной совокупности экспериментальных значений. Далекая экстраполяция найденных таким способом зависимостей в область неисследованных температур и концентраций, как правило, недопустима. Тем не менее, во многих случаях теория регулярных растворов может быть использована для обработки экспериментальных данных и практических расчетов. Наилучшие результаты эта теория дает
Вместе с этим смотрят:
11-этажный жилой дом с мансардой
14-этажный 84-квартирный жилой дом
16-этажный жилой дом с монолитным каркасом в г. Краснодаре
180-квартирный жилой дом в г. Тихорецке
2-этажный 3-секционный 18-квартирный жилой дом в г. Мирном