Вода и ее применение в современных технологиях
ВВЕДЕНИЕ. 2
Глава 1 Физические свойства воды. 5
1.1 Чистая вода. 5
1.2 Плотность. 7
1.3 Точки кипения и замерзания (плавления). 9
1.4 Теплота плавления. 11
1.5 Поверхностное натяжение и прилипание. 12
1.6 Теплоемкость воды. 13
1.7 Испарение, транспирация, сублимация и конденсация. 15
1.8 Твердая вода. 16
1.9 Серебряная вода и ее применение. 18
Глава 2 Химические свойства воды. 19
2.1 Характеристика природной воды. 19
2.2 Растворимость газов в воде. 20
2.3 Растворимость твердых веществ в воде. 21
2.4 Взаимодействия воды с растворенным в ней веществом. 24
Глава 3 Использование воды в современной технике и технологиях. 27
3.1 Морская вода в промышленности. 27
3.2 Морская вода в сельском хозяйстве. 28
СПИСОК ЛИТЕРАТУРЫ.. 29
Хотя все в природе взаимосвязано и каждая деВнталь важна, все же отдельВнные явления и предметы боВнлее существенны, а другие менее при естественном равновесии как живой, так и неВнживой материи. Ведь нельзя же поставить в один ряд по значимости палец и сердце. Поэтому вполне заВнкономерен вопрос: какое веВнщество является самым главным, самым важным для нас в окружающем материальном мире? Ответ на этот вопрос можно дать уверенно и однозначно: это природная вода. Такой ответ, бесспорно, справедлив, во всяком случае для нашей планеты Земля.
Если человек спустится в подземные пещеры, то они поразят его сложнейшей системой многоэтажных помещений, коВнридоров, обширных залов со сводчатыми потолками, причудливой колоннадой, то свешивающейся сверху, то растущей снизу. В этих подземных пустотах подчас встретятся вам журчащий ручей или целое подземВнное озеро, по которому свободно можно кататься на лодке. Какой архитектор построил этот сказочный подземный дворец? Природная вода!
Обратив свой взор к небу, человек видит облака или тучи, тянущиеся на десятки, сотни, а иногда и на тысячи километров. Глядя, как легко они плывут в воздушном океане, окружающем нашу планету, некоторые люди думают, что они невесомые. Масса 1 км3 облаВнков около 2000 т, и состоят они опять-таки из природВнной воды.
Все люди хорошо знают текущие по суше водотоВнки тАФ ручейки, речушки, реки. Иногда они низверВнгаются с высоты десятков и сотен метров водопадаВнми, на многие сотни метров наполняя воздух мельчайВншей алмазной пылью, переливающейся в лучах солнца всеми цветами радуги. Иногда образуют мощные пенящиеся стремнины, вытачивающие в скаВнлах причудливые формы. Крупные водотоки на сотни километров пропиливают даже в плотных породах широкие, до десятка километров, и глубокие, до многих сотен метров, долины. Все это делает сила природной воды.
Но если обратиться к самым страшным из изВнвестных нам катастроф, которые переживали наша планета за геологическое время, а человечество за время своего, правда, короткого существования, таВнким, как тайфуны, смерчи, цунами, земле- и моретряВнсения, извержения вулканов, когда нередко за немноВнгие часы, а то и минуты уничтожались целые города и гибли сотни тысяч людей, и если мы попытаемся -вскрыть механизм природного аппарата, который выВнзвал эти ужасные катастрофы, то увидим, что и в этом случае принимала участие природная вода!
Большая часть поверхности нашей планеты, около 71%, покрыта Мировым океаном, составляющим 97% всех поверхностных вод Земли и около половины всех вод литосферы. Глубина Мирового океана доВнстигает 11 км. Если срезать сушу и заполнить ею дно океанической чаши, то вся планета покроется слоем воды глубиной около 3 км.
Почва и все породы, слагающие литосферу (земВнную кору), также всегда содержат воду. Это утверждение справедливо не только для увлажВнненных районов. Оно достоверно даже для таких мест, где годами не выпадает ни одной капли дожВндя. Это справедливо и для всех участков величайВншей ВлбезводнойВ» пустынитАФСахары. Да что СахаВнра! На нашей планете нет ни одного естественного предмета, тела, пылинки, которые были бы лишены воды. Все живое и неживое содержит ее. В огненной магме, изливающейся из жерл вулканов, также есть вода, причем в немалом количестве.
Да и человек, на 70% состоит из воды. Чего больше всего в нашей тверВндой и жидкой пище тАФ в овощах, мясе, рыбе, хлебе, крупе, молоке? Природной воды! С каким веществом впервые знакомится новорожденный? С водой, в котоВнрой его купают. Даже в первом вздохе новорожденный получает воду, которая всегда содержится в возВндухе. Где лучше всего во время отдыха чувствует себя здоровый человек? Конечно, во время купанья в тепВнлой морской, озерной или речной воде. Недаром неВнкоторые биологи предполагают, что колыбелью жизни на Земле были мелководные лагуны, даже и в том случае, если жизнь зародилась не на планете Земля, а была занесена на нее из межпланетного пространВнства в форме спор одноклеточных организмов.
Итак, кругом, всюду и везде, всегда и во всем,тАФ природная вода! Воду с полным правом можно назВнвать вездесущей. Это не поэтическая гипербола.
Действительно, человечество во все времена стреВнмилось к познанию этого удивительного вещества тАФ воды, прекрасно осознавая ее исключительность. Так, еще шесть тысячелетий назад у шумеров существоВнвали космогонические представления, в которых воде уделялась главная роль: ВлЕще не было вверху неба, а внизу Земли, но уже царствовали боги океана (Апсу) и моря (Тиамата)В».
В Месопотамии, в Вавилоне (в переводе с аккадВнскоготАФврата бога), расположенном на месте более древнего шумерского города Кадингирра, возникла поэма ВлО сотворении мираВ», в которой задолго до появления Библии описаны всемирный потоп и борьба божества, охраняющего мировые воды, с чудовищем преисподней.
Тысячелетием позже древние египтяне согласно господствовавшей в их стране космогонической теории утверждали, что вначале не было ни неба, ни земли; окруженную густым мраком Вселенную наполВнняла первичная вода.
Две тысячи шестьсот лет назад древнегреческий философ Фалес Милетский считал воду первоисточниВнком всего сущего.
В средние века алхимики приписывали воде соверВншенство, обозначая ее в виде опрокинутого равностоВнроннего треугольника Δ. ВлТела не действуют, если не раствореныВ» тАФ одно из основных положений алхимии, не утерявшее во многом справедливости и поныне.
Крупный немецкий профессор Ф. Ауэрбах писал:
ВлСамое удивительное и самое лучшее тАФ это водаВ». Американские физик Дж. Дэй и химик К. Девис наВнзывали воду зеркалом науки. Перефразируя это удачВнное утверждение, автор с неменьшим основанием может сказать, что отношение к воде тАФ зеркало учеВнного-естествоиспытателя. Чем серьезнее он к ней отВнносится, тем выше как ученый стоит в ряду своих коллег. Автор обращает также внимание на то, что без воздуха жизнь возможна (анаэробы), а без воды ее нет.
Известный французский писатель Антуан де Сент-Экзюпери сказал о природной воде следующее: ВлНельзя сказать, что ты необходима для Жизни, ты сама Жизнь.. Ты самое большое богатство в миреВ».
Один из крупнейших специалистов по физической химии воды Э. X. Фрицман в своей классической моВннографии о природе воды [1935] утверждал: ВлНи одно из природных веществ не играет такой выдаюВнщейся и существенной роли на поверхности земного шара и в прилегающих слоях, как вода.. наука и техВнника подтвердили старое основное положение человеВнчества: вода есть то, из чего происходит все, другими словами название aqua вполне себя оправдывает: aqua omnia sunt [1935, с. 5, 157].
Лучше всех из современных мыслителей значение воды определил крупнейший ученый, основоположник ряда новых научных дисциплин, биохимик и минера' лог, академик В. И. Вернадский: ВлВода стоит особняВнком в истории нашей планеты. Нет природного тела, которое могло бы сравниться с ней по влиянию на ход основных, самых грандиозных, геологических проВнцессов. Нет земного веществатАФминерала, горной породы, живого тела, которое ее бы не заключало. Все земное вещество.. ею проникнуто и охваченоВ» [1960,с. 16].
Глава 1 Физические свойства воды.Среди всех веществ, изучаемых физиками и
физико-химиками, вода во многих
отношеВнниях является самым трудным.
В. В. Шуленкин, 1968
Разумеется, под чистой водой мы подразумеваем не санитарно безупречную жидкость, а воду, отвечаюВнщую по составу привычной нам со школьной скамьи химической формуле Н2О. При этом относительная атомная масса водорода, входящего в состав соединеВнния, равна 1, а кислорода 16, никаких других веществ в форме растворенных или взвешенных примесей вода не содержит. Такой окиси водорода, состоящей из двух весовых частей водорода и шестнадцати весоВнвых частей кислорода, в природе в чистом виде не существует, да и искусственно получить такое вещеВнство даже в современных лабораториях крайне трудВнно, а если и возможно, то только на очень короткий отрезок времени, измеряемый секундами. [3]
Природная вода, где бы она ни находилась и в каВнком бы агрегатном состояВннии (газообразном, жидком или твердом) ни была, всегда представляет собой раствор других веществ, газообразных, жидких или твердых, а также содерВнжит подчас в незначительных количествах другие воды (с другими относительными атомными массами водорода и кислорода и другими свойствами). Стало быть, вода тАФ понятие собирательное.
Что же представляет соВнбой та идеальная ВлчистаяВ» вода Н
2О с физической точки зрения? Как и больВншинство веществ, вода состоит из молекул, а последВнние из атомов. Структура атома следующая: вокруг положительно заряженного протонного ядра на опреВнделенных уровнях по различным орбитам движутся отрицательно заряженные электроны, образующие электронное облако. Число электронов в каждой оболочке для атома каждого элемента строго опредеВнленное. Так, у атома водорода лишь одна оболочка с единственным электроном, а у атома кислорода тАФ две оболочки: внутренняя с двумя электронами и внешняя с шестью. Образование молекулы воды из двух атомов водорода и одного атома кислорода (рис. 1). Два атома водорода замещают вакансию двух недостающих (до восьми) электронов наружной оболочки для ее устойчивости.
Можно было бы предполагать, что атом кислороВнда и два атома водорода в молекуле воды образуют у центрального атома кислорода угол, близкий к 180В°. Однако в действительности он значительно меньше тАФ всего 104В° 27' (рис. 2), что приводит к неВнполной компенсации внутримолекулярных сил, избыВнток которых обусловливает асимметрию распределеВнния зарядов, создающую полярность молекулы воды. Эта полярность у воды, более значительная, чем других веществ, обусловливает ее дипольный момент и диэлектрическую проницаемость. Последняя у воды весьма велика и определяет интенсивность раствореВнния водой различных веществ. При 0В°С диэлектричеВнская проницаемость воды (в твердой фазе) составВнляет 74,6; с повышением температуры она падает. Так, при 20В° С диэлектрическая проницаемость воды равна 81.

Многочисленные схемы строения молекулы воды являются гипотетическими, построенными на косвенВнных наблюдениях приборами некоторых признаков поведения и свойств молекул и атомов. При этом следует помнить, что ни атомы, ни молекулы не имеют четких границ размеров орбит, по которым движутся электроны, образующие по сути дела электронное обВнлако, зависящее от энергетического состояния электВнрона (рис.2).
Плотность.
Несмотря на то что вода тАФ вещество, принятое в качестве эталона меры плотности, объема и т. д. для других веществ, сама вода, как это не странно, является самым аномальВнным среди них. Этих удивительных аномалий у воды много, рассмотрим лишь основные из них.
Общеизвестно, что все вещества при нагревании увеличивают свой объем и уменьВншают плотность. У воды наблюдается то же самое, за исключением интервала от 0 до 4В°С, когда с возВнрастанием температуры объем воды не увеличиваетВнся, а, наоборот, сокращается. Максимальная плотность отмечается при 4В°С (рис. 3). Таким образом, для воды зависимость между объемом и температурой не однозначна (как в нормальных условиях для других веществ), а двузначна. Например, при 3 и 5В°С масВнса воды занимает один и тот же объем, так же как и при 0, 2 и 8 В°С и т. д. Несмотря на указанную аноВнмалию, вода служит эталоном плотности при 4В°С, когда 1 см3 ее имеет массу 1 г.
Что же будет происходить с объемом воды при дальнейшем понижении температуры? Оказывается, что ниже 0В°С он продолжает увеличиваться, но тольВнко при условии переохлаждения. Однако переохлажВндение требует исключительных условий: полной непоВндвижности воды и отсутствия центров кристаллизации льда (пыли, кристалликов льда и т. п.) (рис. 4).
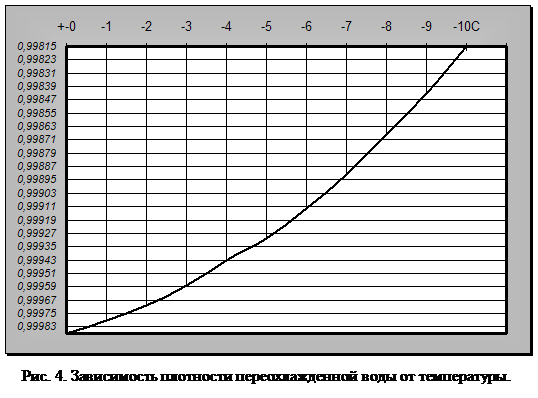
Вода, лишенная растворенных газов, может быть переохлаждена до минус 70 В°С без превращения в лед. При легком встряхивании либо при введении льдинки или другого центра кристаллизации она мгновенно превращается в лед и температура ее подВнскакивает (на 70 В°С) до 0В°С. Вода также может быть доведена до 150 В°С без закипания. При ввеВндении в такую перегретую воду пузырька воздуха она мгновенно вскипает, и температура ее падает до 100В°С.
При замерзании объем воды возрастает внезапно примерно на 11% и так же внезапно, скачком, уменьВншается в обратном направлении при таянии льда при
превращении ее в лед происходит расширение объема, что приводит к возникновению избыточного давлеВнния, достигающего, как показывают наблюдения, 2500 кгс/см2. Именно этим объясняются как разруВншительная сила замерзающей воды в замкнутых пусВнтотах, трещинах горных пород, откалывающая подчас многотонные глыбы и дробящая их в дальнейшем на мелкие осколки, так и страшные взрывы наледей, описание которых будет приведено ниже, а также разрывы водопроводных труб при замерзании в них воды.
Здесь следует сделать одну существенную оговорВнку. Все рассмотренные выше процессы происходят при указанных температурах лишь при условии абсолютВнного давления, равного 1 атм. С увеличеВннием давления температура замерзания воды пониВнжается примерно на 1 В°С через каждые 130 атм. Так, при давлении 500 атм замерзание наступает при температуре минус 4 В°С, а при давлении 2200 атм тАФ при минус 22 В°С. Эта зависимость для воды аномальВнна, так как у других веществ, наоборот, с ростом давления температура замерзания повышается. ПоВндобная аномалия воды очень важна в природе. Даже без учета растворенных в воде солей на больших глубинах в океане вода не замерзает, например при температуре минус 3В°С она не замерзнет даже на глубине около 4000 м, а на больших глубинах тем более.
С повышением температуры жидкой воды ее плотВнность понижается: на интервале от максимальной плотности при 4В°С, равной 1, до точки кипения воды 100 "СтАФна 4% (от 1 до 0,95838).
С повышением минерализации воды (т. е. колиВнчества содержащихся в ней минеральных веществ) повышается и температура, при которой вода имеет максимальную плотность. Так, на поверхности МироВнвого океана плотность воды 1,02813, а на глубине 10км 1,07104 (разница 0,04291, или 4%). Таким обраВнзом, установившееся мнение о практической несжиВнмаемости воды справедливо только для сравнительно малых давлений. Если бы вода была совершенно неВнсжимаема, уровень океана поднялся бы на 30 м.
В этом случае большая часть Ленинграда, например, была бы затоплена.
Важным обстоятельством в природе является то, что максимальная плотность воды, как отмечалось выше, наблюдается при 4 В°С, а лед оказывается легче жидкой воды и поэтому плавает на ее поверхВнности. Если бы этого не было, то водоемы и водоВнтоки промерзали бы зимой до самого дна, что было бы настоящей катастрофой для всего живого в них. Впрочем, эта особенность воды при некоторых услоВнвиях имеет исключения. Речь идет о возможности образования донного или внутриводного льда, о чем подробнее будет сказано в разделе о поверхностных водах.
Что касается температуры кипения, то она находится в прямой зависимости от давления: с увеличением давления она возрастает (рис. 5). Это свойство воды раньше использовалось для определеВнния высоты местности в горах. Температура кипения повышается также с увеличением содержания в воде растворенных веществ.
Иная зависимость наблюдается между давлением и точкой замерзания (плавления) воды, с повышеВннием давления она падает (но только до давления 2200 атм). При дальнейшем увеличении давления точка замерзания воды начинает расти: при давлении 3530 атм вода замерзает при минус 17; при 6380 атмтАФпри 0В°С, при 16500 атмтАФпри 60, а при 20 670 атм тАФ при 76 В°С. В последних двух случаях мы уже имеем горячие льды. Возможно ли существоваВнние в земных недрах сочетания таких температур и давлений? В свободно циркулирующих в породах Земли водах, безусловно, нет, так как даже на граВннице нижней литосферы и верхней мантии, называеВнмой границей Мохоровичича (как мы увидим из дальВннейших глав), где давление приблизительно 10000 атм, температура никак не может быть равна 30 "С,
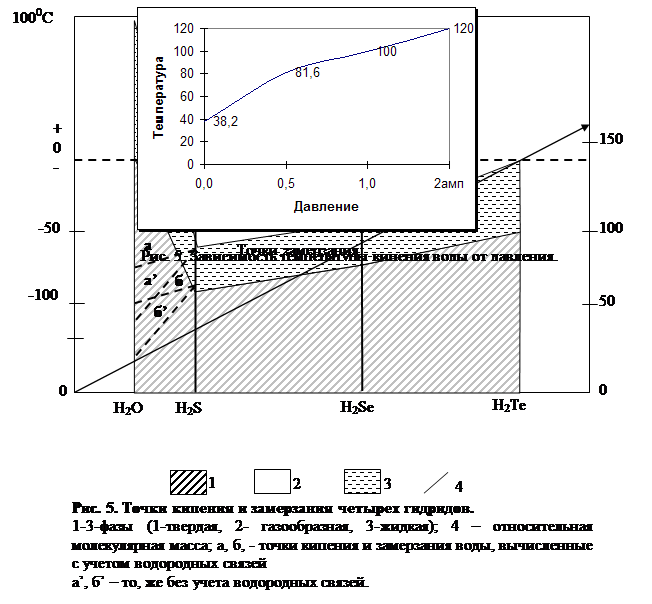
а всегда и везде будет значительно выше. Таким Образом, встреча горячего льда здесь исключается. Выше же границы Мохоровичича совершенно исклюВнчаются давления выше 6000 атм, которые необходиВнмы для образования горячего льда.
При давлении 1 атм аномальны точки замерзания (плавления) и кипения воды (соответственно 0 и 100В°С). Если взять ряд соединений водорода с элеВнментами группы Via периодической системы МенВнделеева тАФ Н2Те, H2Se H2S и H2O тАФ с учетомих относительной молекулярной массы, то окажется, что точки замерзания и кипения воды не укладываются в закономерность, общую для трех других соединений, у которых чем больше относительная молекулярная масса, тем выше точки кипения и замерзания. ТочВнка замерзания воды должна была бы находиться между минус 90 и минус 120 В°С, а в действительности она приходится на В±0 В°С. То же самое можно скаВнзать о точке кипения воды, которая должна была бы быть между 75 и 100 В°С (рис. 5).
При нормальном давлении вода может Влзамер-ратьВ» и при положительной температуре. Это наблюдается, например, в газопроводе, когда проходящий по нему газ (в основном метан) плохо осушен, т.е. в нем присутствует вода. Объем молекулы газа по сравнению с объемом молекулы воды значительно больше, что приводит к понижению внутреннего давления и к повышению температуры замерзания от нескольких градусов до 20 В°С. Выпадающий ВлледВ» содержит много газа (газогидрат).
Сам факт существования воды в обычных для земной поверхности термодинамических условиях во всех трех фазах (твердой, жидкой и газообразной) делает это вещество крайне удивительным и необыкВнновенным.
Познакомимся с еще одной аномалией воды, называемой, может быть, не очень удачно Влскрытой теплотой плавления водыВ». У воды она очень высока тАФ около 80 кал/г (для сравнения ВлскрытаяВ» теплота плавления чистого железа тАФ 6, серытАФ9,5 и свинцатАФ5,5 кал/г). Как же проявляВнется эта аномалия? Лед при давлении 1 атм может иметь температуру от минус 1 до минус 7В°С. КазаВнлось бы, чем ниже температура льда, тем больше потребуется тепла, для того чтобы растопить его. Этот вывод как будто настолько естествен, что неВнпосвященный в физику тепла вряд ли станет его оспаривать. Но, оказывается, этот вывод не бесспорен. Например, при температуре льда 7В°С ниже нуля скрытая теплота плавления составит не 80, а только 76 кал/г! Вот это уже бесспорная и довольно неожиВнданная аномалия. С каждым градусом понижения температуры льда теплота плавления уменьшается чуть ли не на полкалории. Объясняется это тем, что удельная теплоемкость у льда меньше, чем у воды.
Скрытая теплота парообразования (539 кал/г) почти в 7 раз выше, чем скрытая теплота плавления. Чтобы превратить жидкую воду с температурой 100 В°С в пар с такой же температурой, нужно затраВнтить поистине гигантскую энергию, в то время как '/з этой энергии вполне достаточно, чтобы превратить в пар спирт, и '/в, чтобы жидкую ртуть сделать парообразной. Можете теперь себе представить, какой громадной внутренней энергией в скрытой форме обВнладает водяной пар, и это только при 100 В°С! А если его нагреть до 500 В°С, то 1 г его потенциально будет содержать порядка 1000 кал тепла. К сожалению, реализовать эту скрытую энергию практически очень трудно.
Как известно, пар используется в паровых машинах, которых становится все меньше и меньше из-за исключительно низкого (ниже) к. п. д. и не только в силу невозместимых естественных потерь на треВнние, излучение, теплопроводность и других, но и по причинам малой разности температур между границаВнми существования воды, а также малого контраста между температурой окружающего воздуха и точкой парообразования. Эти обстоятельства в настоящее вреВнмя заставляют заменить паровые двигатели двигатеВнлями внутреннего сгорания, электрическими и другими.
Что же касается скрытой теплоты парообразоваВнния, то тут аномальности не наблюдается. Чем хоВнлоднее жидкая вода, тем больший приток тепла нужен ей, чтобы обратить ее в пар. Так, при 0В°С теплота парообразования 587 кал, при 50 В°С тАФ 568, а при 100 В°С тАФ 536, при 150 В°С тАФ 446 кал.
Поверхностное натяжение тАФ это способность пограничных молекул воды, а также твердых тел сцепляться, ВлстягиватьсяВ», самоуплотняться (когезия). На поверхности воды образуются сцепления молекул, создающие пленку натяжения, для разрыва которой потребуется немалая сила. На этой пленке могут лежать, не погружаясь в воду, предметы, котоВнрые в 8 раз и более тяжелее воды, например лезВнвие безопасной бритвы, иголка и др. Поверхностное натяжение воды при 18В°С составляет 72 дин/смтАФ это очень высокое значение (сравните: для спирта оно составляет 22, для ацетона 24, для бензина 29 дин/см). Только ртуть имеет еще более высокое поВнверхностное натяжение тАФ 500 дин/см.
Теоретически установлено, что для разрыва столВнбика чистой воды диаметром 2,5 см потребуется приВнложить усилие 95 те. Поскольку, как уже упоминалось выше, совершенно чистой воды в природе нет, да и в лабораторных условиях получить ее почти невозВнможно, то в условиях эксперимента с не совсем чистой водой для разрыва столбика воды сечением 6,5 см2 потребуется усилие в пределах ВлтолькоВ» 1 те, что близко к прочности стали.
У воды есть и еще одно удивительное свойство тАФ ВлприлипаниеВ» (адгезия), которое можно наблюдать в узких стеклянных трубках (капиллярах), где вода
Поднимается вверх вопреки силам притяжения (гравитации). В таких трубках сочетаются силы сцепления молекул воды в пограничном с воздухом слое со способностью воды смачивать стекло, ВлприлипатьВ» к нему. В результате в капилляре образуется вогнутая поверхность выше естественного уровня воды. У ртуВнти, обладающей более высоким поверхностным натяВнжением, адгезия отсутствует, поэтому ртуть в капилВнлярной трубке имеет не вогнутую, а выпуклую поверхность. Необходимо заметить, что к поверхноВнстям, покрытым жировым слоем, например парафиВнном, вода не прилипает и мениск ее в капилляре, подобно мениску ртути, будет не вогнутый, а выпукВнлый.
Существует понятие капиллярной постоянной, коВнторая равна произведению высоты подъема жидкости на радиус капилляра. Капиллярная постоянная для чистой воды линейно уменьшается с увеличением температуры, а при достижении критической (см. ниВнже) становится равной нулю. Предельная высота капиллярного подъема воды при 15 В°С составит в крупном песке около 2, в мелком 1,2 м, а в чистой глине 12 м, причем продолжительность подъема для крупных капилляровтАФ5тАФ10 суток, а для мелких до 16 месяцев.
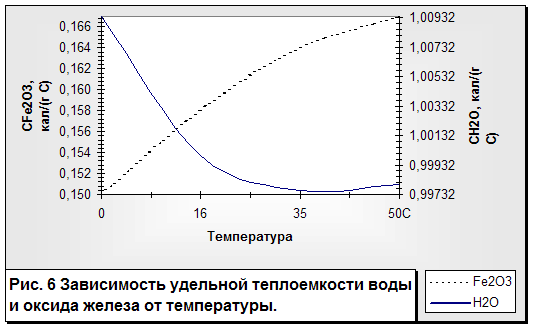
Остановимся на следуВнющей аномалии воды, которая связана с ее теплоемВнкостью. Теплоемкость воды сама по себе не аномальВнна, но она в 5тАФ30 раз выше, чем у других веществ. У всех тел, кроме ртути и жидкой воды, удельная теплоемкость с повышением температуры возрастает. У воды же удельная теплоемкость в инВнтервале температур от 0 до 35 В°С. падает, а затем начинает возрастать (рис. 6).
Удельная теплоемкость воды при 16 В°С условно принята за 1 и служит, таким образом, эталоном меры для других веществ. Как и плотность, удельная теплоемкость воды в зависимости от температуры не однозначна, а двузначна. Например, при 25 и при 50 В°С она одинакова тАФ 0,99800 кал/(г-В°С). ТеплоемВнкость льда на интервале от 0 до минус 20 В°С в средВннем 0,5 кал/(г-В°С), т. е. в два раза меньше, чем у
Только водород и аммиак обладают большей, чем вода, теплоемкостью. жидкой воды. Удельная теплоемкость спирта и глиВнцеринатАФ0,3 (в три раза меньше, чем у воды), железатАФ0,1, платинытАФ0,03, дереватАФ0,6, а каВнменной соли и пескатАФ0,2 кал/(г-В°С). В связи со сказанным выше становится попятным, почему при одинаковом получении солнечного тепла вода в водоВнеме нагреется в b раз меньше, чем сухая песчаная почва на берегу, но при этом вода во столько же раз дольше будет сохранять тепло, нежели песок. Любопытно, что теплоемкость воды в переохлажденВнном состоянии (например, при - 7,5 В°С) на 2% выше, чем при той же температуре, но уже в криВнсталлическом состоянии.
Мы ежедВнневно слышим по радио сообщения об атмосферном давлении воздуха (наряду с сообщением о темпераВнтуре, влажности, силе ветра и т. д.), нормальное значение которого для высоты Ленинграда над уровВннем моря 760 мм рт. ст., а для Москвы, лежаВнщей выше уровня моря на 124 м, 758 мм рт. ст. Мы все привыкли к тому, что при падении давления ниВнже нормы можно ожидать дождя, а при подъеме выше нормы тАУ сухой погоды. Хотя с метеорологической точки зрения сухая и влажная погода определяются комплексом условий, а не одним только давлением. Многие люди, вероятно, помнят, что на старых анероидах помимо шкалы с делениями на миллиметры ртутного столба, были надписи: Влвеликая сушьВ», ВлсушьВ», что отвечало давВнлению, превышающему норму, для данной местности, ВлпеременноВ» тАФ для нормального давления, ВлдождьВ», ВлбуряВ» тАФ для давления ниже нормы.
Вдумайтесь в сказанное. Ведь конденсация водяВнных паров в жидкость по законам физики должна происходить при увеличении давления, а при его паВндении процесс должен протекать в обратном напраВнвлении, т. е. жидкость должна превращаться в пар. В чем же здесь дело? Для ответа нам придется расВнсмотреть особенности удельной теплоемкости паров воды. При давлении 1 атм и температуре 100 В°С из 1 л воды образуется 1600 л пара. Для определеВнния удельной теплоемкости пара ограничим его соВнстояние двумя случаями: пар находится либо в замВнкнутом объеме, либо в сосуде, позволяющем пару расширяться при передаче ему тепла при сохранении постоянного давления. В последнем случае темпераВнтура и объем меняются.
Теплоемкость пара для принятых условий разная, и эта разница весьма существенна, причем не только для воды, но и для многих других веществ, например у ртути до 20%. Но при этом у воды обнаруживается аномалия: при 4В°С теплоемкость в обоих случаях одинакова и лишь с повышением температуры она становится разной. При этом минимальная теплоемВнкость наблюдается при постоянном давлении и при температуре 27 В°С, а при постоянном объеме такого минимума не наблюдается и с повышением темпераВнтуры теплоемкость постепенно снижается. Заметим, что одна и та же масса воды, находящейся в пароВнобразном состоянии, может быть нагрета в два-три раза легче, чем та же масса жидкой водой. Еще раз напомним, что объемы этих двух фаз воды отноВнсятся друг к другу, как 1600 : 1.
А теперь рассмотрим эти же два случая (определеВнние теплоемкости при постоянном объеме и при поВнстоянном давлении) для насыщенного пара. В приняВнтых нами условиях возможно изменение температуры и превращается в мельчайшие капельки тумана.
Проведем с насыщенным паром, следующий опыт. Сосуд с насыщенным паром защитим от случайного поступления или потери тепла (теплоизолируем). При изменении давления в сосуде, казалось, можно ожиВндать один из двух случаев: либо при повышении давВнления (и уменьшении объема пара) он станет перенаВнсыщенным с образованием тумана, либо в результате увеличения температуры он перегреется. Что же надо сделать, чтобы привести пар в первичное состояние? При перенасыщении его следует дополнительно наВнгреть (т. е. сообщить положительное количество тепла), при недонасыщении нужно от него отнять тепло, охладить (т. е. сообщить ему отрицательное количество тепла). В первом случае теплоемкость будет положительной, а во втором отрицательной. И вот в действительности оказывается, что теплоемВнкость насыщенного водяного пара при всех темпераВнтурах и давлениях всегда отрицательная!
Этот поразительный и малопонятный результат эксперимента имеет место не только в лабораторных условиях, но и в природе. При повышении давления водяной газ (пар) не образует тумана и остается прозрачным, а при разрежении туман образуется. Правда, последнее происходит при наличии центров конденсации (пылинок), но их в атмосфере всегда достаточно.
Помимо описанных аномалий у этого удивительВнного вещества, каким является вода, существуют и другие аномалии (например, аномальная дисперсия, рассеяние, в области электрических и световых луВнчей и др.), но на них, чтобы не утруждать читателя, мы останавливаться не будем.
Общеизвестно, что исВнпарениетАФпереход вещества из жидкого или тверВндого состояния в газообразное (в пар). Обычно под испарением жидкости понимают превращение ее в пар, а испарение твердых тел называется сублимаВнцией (или возгонкой). Обратный процесс, т. е. переВнход вещества из газообразного состояния в жидкое, именуется конденсацией. Испарение воды с поверхВнности растений носит название транспирации.
При испарении молекулы переходят из жидкости в пар, преодолевая силы молекулярного сцепления в жидкости. Процесс испарения протекает изотермиВнчески, т. е. при постоянной температуре. Скорость испарения определяется массой жидкости, испаряВнющейся за единицу времени с единицы поверхности. Одной из количественных характеристик процесса испарения воды в атмосферу является дефицит влажности, определяемый разностью между предельной упругостью водяного пара для данной темпераВнтуры и фактической упругостью.
Если воздух в помещении полностью насыщен парами воды или если из наполненного до краев стакана вода не убывает, но и не прибывает, это значит, что испарение отсутствует, т. е. мы имеем состояние динамического равновесия.
До последнего времени считалось, что лед может переходить в пар, минуя жидкую фазу, т. е. Происходит процесс сублимации. Однако последние более детальные исследования показали, что это далеко не так. В действительности поверхность льда покрыта даже при отрицательных температурах переохлаВнжденной квазижидкой пленкой связанной воды. ТаВнким образом, испаряется не лед, а непрерывно поВнполняющаяся пленочная жидкая вода за счет подплавления льда. Это обстоятельство имеет очень большое народнохозяйственное значение при строиВнтельстве самых разнообразных подземных хранилищ в условиях многолетнемерзлых грунтов.
Когда произносят слово ВлводаВ», то подразумевают обычно, что речь идет о жидкости. Но вода часто находится в твердом сосВнтоянии тАФ в виде льда.
В первой четверти нашего века немецкий химик Г. Тамман и американский физик П. Бриджмен выВнявили шесть разновидностей льда, различающихся давлениями и температурами (рис. 7):
Лед I - обыкновенный лед, существующий при давлении до 2200 аты, устойчивый в нормальных условиях, при дальнейшем повышении давления (выше 2200 атм) пеВнреходит в разновидностьII.
Лед II-с уменьшением объема на 18тАФ20% тонет в воде, его плотность 1,2 г/см3 (при 0В°С), очень неустойчив, легВнко переходит в модификацию III.
Лед III - также тяжелее воды (его плотность больше плотности льда I, из которого непосредственно может быть полуВнчена описываемая модификация, на 5%).
Лед IV -легче воды, существует при небольшом давлении и температуре немного ниже О "С, неустойчив и легко переходит в разновидность I.
Лед V тАФ может существовать при давлении от 3,6 до 6,3 кбар, его плотность выше плотности льда III на 5,5 и воды на 6%.
Лед VI -может быть получен непосредственно из воды при темВнпературе 60 В°С и давлении 16,5 кбар (при давлении 21 кбар температура этой модификации льда 76 "С), его плотность выше плотности льда V на 4 и воды на 6%.
Эти шесть модификаций льда образуют резко разВнличные полимерные группы. В одну группу могут быть включены льды, которые легче вод (лед I, IV), в другуютАФболее тяжелые (лед III, V и VI). При плавлении льды первой группы сокращаются в объеме, а второй, наоборот, увеличиваются. РазлиВнчия между модификациями льда обусловлены не хиВнмическими свойствами, а молекулярным строением льда.
По-видимому, здесь отчасти кроется причина образования в некоторых случаях так называемого донного льда, о котором подробнее будет идти речь в дальнейшем.
Как правило, различные модификации льда даже при высоких давлениях по плотности близки к плотВнности обычного льда (различия в плотности обычно не превышают 6%). Однако в астрофизическом центВнре университета в Толедо (США, штат Огайо) америВнканскими учеными А. Дальсом и А. Венджером была открыта сверхплотная модификация льда при темпеВнратуре ниже минус 173 В°С и давлении (6тАФ 8) -Ю-3 мм рт. ст. Плотность этой модификации 2,3 г/см3 (по плотности он близок к гнейсу тАФ 2,4 г/см3). Этот лед аморфен и может играть большую роль в физике планет и комет.
Замерзание природной воды зависит от темпераВнтуры, давления, минерализации (количества растворенных веществ) и изотопного состава. Так, при конВнцентрации раствора поваренной соли NaCI 5 г/л он замерзнет при минус 0,38; 50 г/л тАФ при минус 3,78 и, наконец, 100 г/лтАФпри минус 7,44 В°С. Дальнейшее увеличение минерализации не предохраняет раствор от замерзания, происходит процесс вымораживания, которым пользуются, например, при добыче соли. В результате образуется чистый лед, а концентрация оставшегося жидкого раствора повышается.
Каждой, температуре соответствует вполне определенная концентрация раствора. Так будет продолжаться до тех пор, пока температура не упадет до минус 21,9В°С, а концентрация раствора при этом достигнет 224 г/л, после чего раствор затвердеет, образуется эвтектическая смесь кристаллов льда и соли, называемая криогидратом. По данным Н. Н. ЗуВнбова [1945], лед образуется из морской воды при минерализации 10 г/л при температуре 0,5; при 100 г/л тАФ при 6,4, а при 260 г/л при минус 23 В°С.
Лед очень прозрачен для солнечной энергии, осоВнбенно для ультрафиолетового излучения. Снег, хотя и меньше, но тоже довольно хорошо пропускает солВннечное излучение. Но даже самые тонкие (1тАФ2мм)слои льда совершенно не прозрачны для тепловой длинноволновой радиации и земного излучения. Эта особенность имеет большое значение для нагреВнвания воды подо льдом. Теплопроводность льда довольно высокаятАФ53В·10-4 кал/ (см В· сек В· В°С); для сравВннения: теплопроводность водытАФ14, а воздухатАФ 0,57 кал/(см В· сек В· В°С).
излучений и т. д.
Еще 2500 лет назад перВнсидский царь Кир во время походов пользовался водой, сохраняемой в серебряных сосудах. В древней Индии для обезвреживания воды от патогенной микрофлоры в нее погружали раскаВнленное серебро. Многовековой опыт показал, что ионы серебра подавляют размножение многих бакВнтерий.
Впервые научные наблюдения над серебряной воВндой в конце XIX в. провел швейцарский ботаник К. В. Негели. С тех пор во многих странах было выполнено значительное число работ по изучению эффективных способов ее получения и применения, выпущена обильная литература о серебряной воде. В нашей стране разработаны и выпущены в продажу специальные приборы для получения в домашних условиях электролитического раствора серебра, Серебряная вода использовалась при полетах космоВннавтов. В Японии и в США серебро применяется для обеззараживания воды в плавательных бассейВннах, а в Китае тАФ для производства минеральных и фруктовых вод. Серебряная вода может применяться для консервирования сливочного масла, маргарина, меланжа, молока, микстур и даже для ускорения
Вместе с этим смотрят:
11-этажный жилой дом с мансардой
14-этажный 84-квартирный жилой дом
16-этажный жилой дом с монолитным каркасом в г. Краснодаре
180-квартирный жилой дом в г. Тихорецке
2-этажный 3-секционный 18-квартирный жилой дом в г. Мирном