Металлургия цветных металлов
Курсовая работа на тему:
Металлургия цветных металлов
Содержание
1. Введение
2. Описание технологии получения катодной меди
3. Выбор технологии плавки на штейне
4. Теоретические основы процесса Ванюкова
5. Расчет материального и теплового баланса
6. Заключение
Введение
Металлургия меди, а также других тяжелых цветных меВнталлов является ведущим звеном отечественной цветной металлурВнгии. На долю тяжелых цветных металлов в РФ прихоВндится значительная часть валовой продукции отрасли.
Значение меди из года в год возрастает, особенно в связи с бурным развитием энергетики, электроники, машиностроеВнния, авиационной, космической и атомной техники. Дальнейшее развитие и технический уровень медного и никелевого производств во многом определяют технический прогресс многих отраслей наВнродного хозяйства нашей страны, в том числе микропроцессорной техники. Для получения меди используются всевозможные способы плавок, например, плавка медных концентратов в электрических, отражательных, шахтных печах, при использовании процесса конвертирования медных штейнов, благодаря автогенным плавкам во взвешенном состоянии, на штейне и др. На сегодняшний день существует несколько основных процессов автогенных плавок : процесс ВлНорандаВ», ВлУоркраВ», ВлМицубисиВ» и Ванюкова. К сожалению, разработка новый конструкций печей и различных процессов требует значительных капиталовложений, а свободный средств у Российских предприятий недостаточно. В данной курсовой работе будет рассмотрена технология А.В. Ванюкова или ПЖВ.
Технология получения катодной меди
Электролитическое рафинирование меди преследует две цели:
1) получение меди высокой чистоты (99,90тАФ99,99% Си), удовлетворяющей требованиям большинства потребителей;
2) извлечение попутно с рафинированием благородных и других ценных компонентов (Se, Те, Ni, Bi и др.).
Следует отметить, что чем выше в исходной меди содержание благородных металлов, тем ниже будет себестоимость электролитВнной меди. Именно поэтому при конвертировании медных штейнов стремятся использовать в качестве флюса золотосодержащие кварциты.
Для осуществления электролитического рафинирования меди аноды, отлитые после огневого рафинирования, помещают в электВнролизные ванны, заполненные сернокислым электролитом. Между анодами в ваннах располагаются тонкие медные листы тАФ катодВнные основы.
При включении ванн в сеть постоянного тока происходит элекВнтрохимическое растворение меди на аноде, перенос катионов через электролит и осаждение ее на катоде. Примеси меди при этом в основном распределяются между шламом (твердым осадком на дне ванн) и электролитом.
В результате электролитического рафинирования получают катодную медь; шлам, содержащий благородные металлы; селен;
теллур и загрязненный электролит, часть которого иногда испольВнзуют для получения медного и никелевого купоросов. Кроме того, вследствие неполного электрохимического растворения анодов получают анодные остатки (анодный скрап).
Электролитическое рафинирование меди основано на различии ее электрохимических свойств и содержащихся в ней примесей. В таблице приведены нормальные электродные потенциалы меди и наиболее часто встречающихся в ней примесей.
Медь относится к группе электроположительных металлов, ее нормальный потенциал +0,34 В, что позволяет осуществлять процесс электролиза в водных растворах (обычно в сернокислых).
На катоде протекают те же электрохимические реакции, но в обратном направлении. Соотношение между одновалентной и двухВнвалентной медью в растворе определяется равновесием реакции диспропорционирования.
Следовательно, в состоянии равновесия концентрация в растворе ионов Сu+ примерно в тысячу раз меньше, чем конВнцентрация ионов Си2+. Тем не менее реакция имеет сущестВнвенное значение для электролиза. Она в частности определяет переход меди в шлам. В начальный момент вблизи анода в растВнворе соотношение двух- и одновалентной меди соответствует конВнстанте равновесия. Однако вследствие большего заряда и меньшего ионного радиуса скорость перемещения двухвалентных ионов к катоду превышает скорость переноса ионов одновалентных. В реВнзультате этого в прианодном слое концентрация ионов Си2+ стаВнновится выше равновесной и реакция начинает идти в стоВнрону образования тонкого порошка меди, выпадающего в шлам.
Как указывалось выше, электролитическое рафинирование осуВнществляют в сернокислых растворах. Электроположительный потенциал меди позволяет выделить медь на катоде из кислых растворов без опасения выделения водорода. Введение в электроВнлит наряду с медным купоросом свободной серной кислоты суВнщественно повышает электропроводность раствора. Объясняется это большей подвижностью ионов водорода по сравнению с подВнвижностью крупных катионов и сложных анионных комплексов.
Для улучшения качества катодной поверхности в электролиты для рафинирования меди на всех заводах обязательно вводят разнообразные поверхностно-активные (коллоидные) добавки:
клей (чаще столярный), желатин, сульфитный щелок. В процессе электролиза на поверхности катода могут образоВнвываться дендриты, что уменьшает в данном месте расстояние между катодом и анодом. Уменьшение межэлектродного расстояВнния ведет к уменьшению электрического сопротивления, а следоВнвательно, к местному увеличению плотности тока. Последнее в свою очередь обусловливает ускоренное осаждение меди на дендриВнте и ускоренный его рост. Начавшийся рост дендрита в конечном итоге может привести к короткому замыканию между катодом и анодом. При наличии дендритов сильно развитая поверхность каВнтода удерживает большое количество электролита и плохо промыВнвается, что не только ухудшает качество товарных катодов, но и может вызвать брак катодной меди по составу. Одно из объяснеВнний механизма действия поверхностно-активных веществ заклюВнчается в том, что они адсорбируются на наиболее активных частях поверхности и при этом вызывают местное повышение элекВнтрического сопротивления, что и препятствует росту дендрита. В результате поверхность катодов получается более ровной, а катодВнный осадок более плотным. После выравнивания катодной поверхВнности коллоидная добавка десорбирует в электролит.
Растворы коллоидных добавок непрерывно вводят в циркулиВнрующий электролит. Вид и расход поверхностно-активных веществ различны для каждого предприятия. Обычно применяют одновреВнменно две добавки. На 1 т получаемой катодной меди расходуют 15тАФ40 г клея, 15тАФ20 г желатина, 20тАФ60 г сульфитных щелоков или 60тАФ100 г тиомочевины.
Основными требованиями, предъявляемыми к электролиту, являВнются его высокая электропроводность (низкое электрическое сопротивление) и чистота. Однако реальные электролиты, помимо сульфата меди, серной кислоты, воды и необходимых добавок, обязательно содержат растворенные примеси, содержащиеся до этого в анодной- меди. Поведение примесей анодной меди при электролитическом рафинировании определяется их положением в ряду напряжений. По электрохимическим свойствам примеси можно разделить на четыре группы:
I группа тАФ металлы более электроотрицательные, чем медь (Ni, Fe, Zn и др.);
II группа тАФ металлы, близко стоящие в ряду напряжений к-меди (As, Sb, Bi);
III группа тАФ металлы более электроположительные, чем медь (Au, Ag и платиноиды);
IV группа тАФ электрохимически нейтральные в условиях рафиВннирования меди химические соединения (Cu2S, Cu2Se, Cu2Te, AuTe2, Ag2Te).
Примеси первой группы, обладающие наиболее электроотрицаВнтельным потенциалом, практически полностью переходят в электроВнлит. Исключение составляет лишь никель, около 5% которого из анода осаждается в шлам в виде твердого раствора никеля в меди. Твердые растворы по закону Нернста становятся даже более электроположительными, чем медь, что и является причиной их перехода в шлам.
Особо по сравнению с перечисленными группами примесей-ведут себя свинец и олово, которые по электрохимическим свойВнствам относятся к примесям I группы, но по своему поведению в процессе электролиза могут быть отнесены к примеВнсям III и IV групп. Свинец и олово образуют нерастворимые в сернокислом растворе сульфат свинца PbS04 и метаоловянную кислоту H2SnO3. Электроотрицательные примеси на катоде в условиях электроВнлиза меди практически не осаждаются и постепенно накапливаВнются в электролите. При большой концентрации в электролите металлов первой группы электролиз может существенно расВнстроиться.
Накопление в электролите сульфатов железа, никеля и цинка снижает концентрацию в электролите сульфата меди. Кроме того, участие электроотрицательных металлов в переносе тока через электролит усиливает концентрационную поляризацию у катода.
Электроотрицательные металлы могут попадать в катодную медь в основном в виде межкристаллических включений . раствоВнра или основных солей, особенно при их значительной концентраВнции в электролите. В практике электролитического рафинирования меди не рекомендуется допускать их концентрацию в растворе свыше следующих значений, г/л: 20 Ni; 25 Zn; 5 Fe.
Примеси II группы (As, Sb, Bi), имеющие близкие к меди электродные потенциалы, являются наиболее вредными с точки зреВнния возможности загрязнения катода. Будучи несколько более электроотрицательными по сравнению с медью, они полностью растворяются на аноде с образованием соответствующих сульВнфатов, которые накапливаются в электролите. Однако сульфаты этих примесей неустойчивы и в значительной степени подвергаВнются гидролизу, образуя основные соли (Sb и Bi) или мышьякоВнвистую кислоту (As). Основные соли сурьмы образуют плавающие в электролите хлопья студенистых осадков (ВлплавучийВ» шлам), которые захватывают частично и мышьяк.
В катодные осадки примеси мышьяка, сурьмы и висмута могут попадать как электрохимическим, так и механическим путем в результате адсорбции тонкодисперсных частичек ВлплавучегоВ» шлама. Таким образом, примеси II группы распределяются между электролитом, катодной медью и шламом. Предельно допустимые концентрации примесей II группы в электролите составляют, г/л:
9 As; 5 Sb и 1,5 Bi.
Более электроположительные по сравнению с медью примеси (III группа), к которым относятся благородные металлы (главным образом, Au и Ag), в соответствии с положением в ряду напряжеВнний должны переходить в шлам в виде тонкодисперсного остатка. Это подтверждается практикой электролитического рафинирования меди.
Переход золота в шлам составляет более 99,5% от его содерВнжания в анодах, а серебра тАФ более 98%. Несколько меньший переход серебра в шлам по сравнению с золотом связан с тем, что серебро способно в небольшом количестве растворяться в электролите и затем из раствора выделяться на катоде. Для уменьВншения растворимости серебра и перевода его в шлам в состав электролита вводят небольшое количество иона хлора.
Несмотря на практически полный переход золота и серебра в шлам, они все же в небольшом количестве попадают в катодные осадки. Объясняется это механическим захватом взмученного шлама и отчасти явлением катофореза. На механический перенос шлама на катод влияют применяемая плотность тока и взаимосвяВнзанная с ней скорость циркуляции электролита. С увеличением скорости циркуляции вследствие взмучивания шлама переход золоВнта и серебра на катод возрастает. При выборе плотности тока и способа циркуляции электролита необходимо учитывать содержание благородных металлов в анодах. В случае их повышенного содерВнжания плотность тока должна быть меньше. Снижению переноса шлама на катод способствует также наличие в ванне зоны отстаиВнвания (область от нижнего конца катода до дна ванны). На многих заводах электролит перед его возвращением в ванну в цикле циркуВнляции подвергают фильтрованию, что уменьшает потери шлама и обеспечивает получение более чистой меди.
Аналогично электроположительным примесям ведут себя при электролизе меди химические соединения (примеси IV группы). Хотя в принципе химические соединения и могут окисляться на аноде и восстанавливаться на катоде, что используют в специальВнных процессах, в условиях электролитического рафинирования меди анодного потенциала недостаточно для их окисления. Поэтому при электролизе меди в электродных процессах они не участвуют и по мере растворения анода осыпаются на дно ванны. В виде селенидов и теллуридов переходят в шлам более чем 99% селена и теллура.
Таким образом, в результате электролитического рафинирования анодной меди все содержащиеся в ней примеси распределяются между катодной медью, электролитом и шламом'.
Основными характеристиками, определяющими параметры и покаВнзатели электролитического рафинирования меди, являются плотВнность тока, выход металла по току, напряжение на ванне, удельный расход электроэнергии.
Плотность тока является важнейшим параметром процесса элекВнтролиза. Она выражается в амперах на единицу поверхности элекВнтрода (D=I/S). В металлургии меди ее принято выражать в ампеВнрах на квадратный метр площади катодов. По закону Фарадея на каждый 1 А тАв ч электричества осаждается 1 электрохимический эквивалент металла. Для меди он равен 1,1857 г/А тАв ч. СледоваВнтельно, с увеличением плотности тока интенсивность (производиВнтельность) процесса электролиза возрастает. Величина плотности тока, при которой проводят процесс элекВнтролитического рафинирования, определяет все его основные техниВнко-экономические показатели: напряжение на ванне, выход по току, расход электроэнергии, а также капитальные и эксплуатационные затраты. С увеличением плотности тока при прочих равных условиВнях увеличивается производительность цеха, уменьшаются число потребных ванн, затраты на капитальное строительство и рабочую силу, но возрастают затраты на электроэнергию. Следует отметить, однако, что с увеличением плотности тока увеличиваются потери благородных металлов за счет большего взмучивания шлама и захвата его растущим катодВнным осадком. В настоящее время применение особых режимов элекВнтролиза (реверсивного тока, измененной системы циркуляции элекВнтролита и др.) позволяет довести плотность тока до 500 А/м2 и более.
Электрохимический эквивалент меди составляет 1,1857 г/А тАв ч. Однако практически при электролизе для выделения 1 г-экв металВнла расходуется электричества больше. Это кажущееся противоречие объясняется тем, что часть электрического тока расходуется на побочные электрохимические процессы и утечку тока. Степень использования тока на основной электрохимический процесс назыВнвается выходом металла по току.
В практике электрометаллургии цветных металлов в большинВнстве случаев приходится иметь дело с катодным выходом по току, так как масса катодного осадка определяет конечный выход товарВнной продукции. Преднамеренный повышенный перевод меди в электролит за счет химического растворения часто обусловливают конъюнктурными соображениями. Избыточная медь может быть выделена из электролиВнта в виде медного купороса при его регенерации. В тех случаях, когда потребность в медном купоросе, используемом в основном для борьбы с болезнями и вредителями сельскохозяйственных растений, очень велика (например, в НРБ), допускается работа электролизВнных цехов с повышенной температурой электролита.
Выбор технологии плавки на штейне
Почти столетие в металлургии меди и около полувека в металлурВнгии никеля (в Канаде) ВлгосподствуетВ» отражательная плавка. Свое широкое распространение она получила благодаря освоенности плавки применительно к переработке различных видов мелких рудВнных материалов, главным образом флотационных концентратов, простоте организации процесса почти в любых условиях металлургического производства. Основными причинами острой необходиВнмости замены отражательной плавки стали высокие требования к предотвращению загрязнения окружающей среды выбросами оксиВндов серы. В условиях отражательной плавки, характеризующейся образованием огромных количеств очень бедных по SO2 газов, их обезвреживание требует больших капитальных затрат и обходится дорого в эксплуатации. В связи с этим, а также в связи с необхоВндимостью активного использования теплотворной способности сульВнфидов и ряда других рассмотренных выше факторов были разрабоВнтаны и освоены новые способы плавки медного сырья. Главным образом это тАФ автогенные процессы, совмещающие в себе обжиг, плавку и конвертирование. В этих процессах большая часть серы переходит в отходящие газы с достаточно высоким и постоянным содержанием SO2.
Ниже приведены сравнительные основные технико-эконоВнмические показатели применяемых в настоящее время в медной промышленности пирометаллургических процессов.
Уже в начальной стадии освоения процесса плавки в жидкой ванне достигнута удельная производительность, превышающая более чем в 15 раз производительность отражательной печи при плавке сырой шихты, и в 6тАФ8 раз производительность КВП и финВнской технологии. Возможно широкое управление составом штейна и получение на богатых штейнах относительно бедных отвальных шлаков.
Процесс характеризуется низким пылеуносом и получением возгонов, богатых по содержанию ценных компонентов. Для осущестВнвления процесса создана надежная и долговечная аппаратура. ПроВнцесс не требует сложной подготовки сырья и пригоден для переработки как кусковой руды, так и концентратов различного состава. По своим показателям он превосходит все известные в мировой практике процессы. Процесс следует считать в основном освоенным и заслуживающим широкого и быстрого внедрения в отечественной медной и никелевой промышленности.
Помимо основного использования для плавки сульфидных конВнцентратов на штейн, плавка в жидкой ванне пригодна для более широкого применения. При внедрении процесса в жидкой ванне необходимо учитывать его возможности, пути и направления разВнвития, которые будут осуществляться уже в недалеком будущем.
К перспективным направлениям относятся прежде всего прямое получение черновой меди и глубокое обеднение шлаков, прямое получение медно-никелевого файнштейна, плавка коллективных медно-цинковых концентратов, комплексная переработка отвальных шлаков. Заслуживает внимания также использование принципов плавки в жидкой ванне для переработки окисленных никелевых и железных руд.
Сравнительные технико-экономические показатели некоторых видов плавки сульфидных медных концентратов
| Показатель | ПЖВ | КФП | Финская | КИ ВЦЭТ | Норанда | Мицубиси | ОтражаВнтельная плавка сырой шихты |
Удельный проплав, т/(м2 тАв сут) | 60тАФ80 | 10тАФ13 | 9тАФ12 | 3тАФ5 | 10тАФ11 | До 20 | 4тАФ5 |
Содержание меди, %: в штейне | 45тАФ55 | 37тАФ40 | 60 | 40тАФ50 | 70-75 | 65 | 20тАФ30 |
в шлаке (без обедВн нения) | 0,5тАФ0,6 | До 1,2 | 1тАФ1,5 | 0,3тАФ0,6 | 5 | 0,5 | 0,4тАФ0,5 |
Содержание Si02 в шлаке, % | 30тАФ32 | 28тАФ34 | 29тАФ30 | 30тАФ34 | 22 | 30тАФ35 | 34тАФ42 |
| Влажность шихты, % | 6тАФ8 | <1 | <1 | <1 | 10тАФ13 | <1 | 6тАФ8 |
Максимальная крупВн ность шихты, мм | До 50 | 0,1 | 0,1 | 0,1 | 10 | 1 | 5 |
| Пылевынос, % | 1 | 9тАФ12 | 7тАФ10 | тАФ | 5 | 3тАФ5 | 1тАФ2 |
Содержание Оа в дутье, % | 60тАФ65 | 95 | 35тАФ40 | 95 | 26тАФ28 | 45 | До 25 |
Содержание SOz в газах, % | 20тАФ40 | 70тАФ75 | 18тАФ20 | 35тАФ50 | 6тАФ7 | 35 | 1тАФ2 |
Расход условного топВн лива, % | До 2 | До 2 | До 5 | 10тАФ12 | 9тАФ10 | 3тАФ5 | 18тАФ22 |
Процесс ПЖВ обеспечивает лучшую производительность среди всех типов процессов, превосходя их на десятки процентов. Содержание меди в штейне составляет порядка 45-55%, что является средним уровнем; в шлаке меди, фактически, минимальное количество, допустимое сегодняшними технологиями. Благодаря этому процессу достигается уверенное распределение 30% SiO2 в шлак. Процесс может перерабатывать достаточно крупную шихту, что снижает затраты на ее измельчение и обработку. Низкий расход топлива также вносит свою лепту в то, что технологический процесс А.В.Ванюкова один из лучших по своим технико-экономическим показателям.
Процесс плавки в жидкой ванне (ПЖВ)
Оригинальный процесс автогенной плавки сульфидных медВнных и медно-цинковых концентратов, названный авторами данной книги Влплавкой в жидкой ваннеВ», начал разрабатываться в СоветВнском Союзе в 1951 г Дальнейшие разработка и внедрение до 1986 г. велись под общим научным руководством проф. А. В. Ванюкова.
Первые испытания этого метода плавки были проведены в лабоВнраторных и заводских условиях в 1954тАФ1956 гг. В настоящее время по методу плавки в жидкой ванне работают промышленные установки на медном заводе Норильского ГМК и Балхашском горнометаллургическом комбинате.
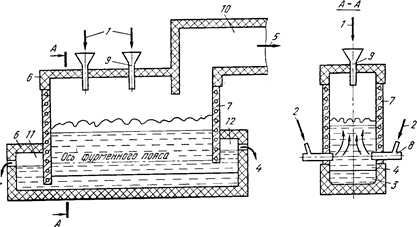
Схема печи для плавки в жидкой ванне:
1 тАФ шихта; 2 тАФ дутье; 3 тАФ штейн; 4 тАФ шлак; 5 тАФ газы; 6 тАФ кладка печи; 7 тАФ медные литые кесВнсоны; 8 тАФ фурмы; 9 загрузочная воронка; 10 тАФ аптейк; 11 тАФ штейновый сифон; 12 шлаковый сифон
Процесс ПЖВ запатентован в ряде зарубежных стран. При разработке процесса плавки в жидкой ванне ставилась задача создания максимально благоприятных условий для протеВнкания всех физико-химических процессов. Предложено несколько вариантов технологического и аппараВнтурного оформления процесса в зависимости от состава исходного сырья и конечных результатов его переработки. Рассмотрим работу плавильной печи для автогенной и полуавтогенной плавки сульфидВнных медных концентратов с получением богатого штейна. Для осуществления процесса плавки предложено использовать частично кессонированную печь шахтного типа. Оптимальная длина промышленных печей определяется потребВнной единичной мощностью агрегата, т. е. его абсолютной суточной производительностью, и может изменяться от 10 до 30 м и более. Ширина печей при этом с учетом возможностей дутьевого хозяйства и свойств расплавов составляет 2,5тАФ3, высота шахты 6тАФ6,5 м. Отличительной особенностью конструкции печи является высокое расположение дутьевых фурм над подом (1,5тАФ2 м).
Содержание кислорода в дутье для обеспечения автогенного режима при плавке сухой шихты с влажностью менее 1тАФ2% соВнставляет 40тАФ45%, влажной (6тАФ8% влаги) 55тАФ65%. В печи можно плавить как мелкие материалы, так и кусковую шихту. Крупную и влажную шихту загружают непосредственно на поверхность расВнплава. При необходимости сухие мелкие и пылевидные материалы могут вдуваться через фурмы. Таким образом, плавление шихты и окисление сульфидов в процессе ПЖВ осуществляются непосредВнственно в слое расплава.
Шлак и штейн выпускаются раздельно из нижней части ванны с помощью сифонов.
Характерной особенностью плавки в жидкой ванне, отличающей ее от всех рассмотренных ранее процессов, является то, что плавВнление и окисление сульфидов осуществляются в ванне шлака, а не штейна, и шлак движется в печи не в горизонтальном направлении, как это имеет место во всех известных процессах плавки, а в вертиВнкальном тАФ сверху вниз.
Горизонтальной плоскостью по осям фурм расплав в печи делитВнся на две зоны: верхнюю надфурменную (барботируемую) и нижВннюю подфурменную, где расплав находится в относительно спокойВнном состоянии.
В надфурменной зоне осуществляются плавление, растворение тугоплавких составляющих шихты, окисление сульфидов и укрупнеВнние мелких сульфидных частиц. Крупные капли сульфидов быстро оседают в слое шлака, многократно промывая шлак за время его движения сверху вниз в подфурменной зоне. При непрерывном осуВнществлении процесса устанавливается динамическое равновесие между количеством поступающих с загрузкой мелких сульфидных частиц, скоростью их укрупнения и отделения от шлака. В резульВнтате одновременного протекания этих процессов устанавливается постоянное содержание сульфидов (капель) в шлаке, лежащее на уровне 5тАФ10% от массы расплава. Таким образом, все процессы в надфурменной области протекают в шлако-штейновой эмульсии, в которой преобладает шлак.
Окисление сульфидов, как известно, является очень быстрым процессом и обычно не ограничивает конечную производительность агрегатов. В производственных процессах желательно не только не повышать, но даже замедлять скорость окисления сульфидов. ДейВнствительно, большие скорости окисления сульфидов, например при продувке жидких сульфидов кислородом, приводят к чрезмерному повышению температуры в области фурм.
Окисление сульфидов в шлако-штейновой эмульсии протекает менее интенсивно, чем в сульфидном расплаве, фокус горения расВнтягивается, что позволяет избежать локального повышения темпеВнратуры в области фурм даже при использовании чистого кислорода. Это в свою очередь облегчает задачу создания надежной и долВнговечной аппаратуры. При этом скорость окисления остается достаВнточно высокой и степень использования кислорода на окисление сульфидов практически равна 100% при любом необходимом его количестве, подаваемом в расплав. Таким образом, и при окислении сульфидов в шлако-штейновой эмульсии скорость их окисления не лимитирует производительности агрегата. Возможность интенсивВнного окисления сульфидов в шлако-штейновой эмульсии без больВншого локального повышения температуры в области фурм является важным достоинством плавки в жидкой ванне.
Окисление сульфидов в шлако-штейновой эмульсии представляВнет собой сложный многостадийный процесс, состоящий из окислеВнния капелек штейна, окисления растворенных в шлаке сульфидов, окисления FeO шлака до магнетита и окисления сульфидов магнеВнтитом. Таким образом, шлак также является передатчиком кислоВнрода. По последним данным, наибольшее значение имеет стадия окисления сульфидов, растворенных в шлаке.
Характерная особенность окисления сульфидов в шлако-штейноВнвой эмульсии состоит в том, что оно не сопровождается образоваВннием первичных железистых шлаков и выпадением мелких сульВнфидных частиц. Оксиды, образующиеся на поверхности сульфидных капель, немедленно растворяются в шлаке конечного состава.
Отсутствие условий для образования значительных количеств мелкой сульфидной взвеси является важным достоинством плавки в жидкой ванне, создающим предпосылки для получения бедных отвальных шлаков.
Высокая степень использования кислорода обеспечивает проВнстое управление составом штейна и соотношением количеств подаВнваемого через фурму кислорода и загружаемых за то же время концентратов. Состав штейна можно регулировать в широком диаВнпазоне вплоть до получения белого матта или даже черновой меди. Напомним, что потери меди со шлаком начинают резко возВнрастать, когда ее содержание в штейне превысит 60%. Поэтому при плавке на штейн, если в технологической схеме не предусматриваВнется специальное обеднение шлака, увеличивать содержание меди в штейне свыше 50тАФ55% нецелесообразно. При получении белого матта или черновой меди в технологическую схему должна обязаВнтельно включаться операция обеднения шлаков.
Растворение тугоплавких составляющих шихты является одним из относительно медленных процессов. Энергичный барботаж ванны резко ускоряет процесс растворения кварца и компонентов пустой породы, что позволяет использовать даже сравнительно крупные флюсы. Промышленные испытания показали, что при крупности кварца около 50 мм скорость его растворения не влияет на произВнводительность печи, по крайней мере, вплоть до удельного проплаВнва, равного 80 т/(м2 тАв сут). Высокая скорость растворения тугоВнплавких составляющих является важной особенностью плавки в жидкой ванне.
Минимальное содержание магнетита в шлаках тАФ обязательное условие совершенного плавильного процесса. Как уже говорилось, с увеличением содержания магнетита резко возрастает содержание растворенной меди в шлаках. Кроме того, повышение содержания магнетита (степени окисленности системы) приводит к снижению межфазного натяжения на границе раздела штейна и шлака.
ИСХОДНЫЕ ДАННЫЕ РАiЕТОВ
| 1. Производство по влажному концентрату | | т/час | 80 |
| 2. Состав концентрата | | % | |
| Cu | | 17 |
| Fe | | 28 |
| S | | 36 |
| SiO2 | | 5 |
| CaO | | 3 |
| MgO | | 0 |
| Al2O3 | | 0 |
| Zn | | 6 |
| Pb | | 2 |
| 3. Влажность | | | 5 |
| 4. Обогащение дутья | | | 85 |
| 5. Содержание меди в штейне | | | 45 |
| 6. Извлечение меди в штейн | | | 97 |
| 7. Выход в штейн | | | |
| Pb | | 20 |
| Zn | | 35 |
| 8. Выход в газ | | | |
| Pb | | 22 |
| Zn | | 12 |
| 9. Состав кварцевого флюса | | | |
| Si02 | | 70 |
| Влажн. | | 6 |
| 10. Состав шлака | | | |
| Si02 | | 33 |
| Ca0 | | 6 |
| 11. Подача конверторного шлака | | Т/час | 10 |
| 12. Температура конверторного шлака | | C | 1200 |
| 13. Температура продуктов | | C | 1250 |
| 14. Состав топлива | | % | |
| CH4 | | 0 |
| C | | 95 |
| Влажн. | | 6 |
| 15. Тепло сгорания природного газа | | Ккал/м3 | 0 |
85% концентрата меди в виде халькопирита. Извлечение Cu из конверторного шлака тАУ 80%. Состав конверторного шлака : Cu тАУ 3%, Fe тАУ 52%, SiO2 тАУ 24%/
Содержание прочих в штейне тАУ 1%.
Содержание O2 в техническом кислороде 96% (остальное N2)
Концентрация магнетита в конверторном шлаке тАУ 30%.

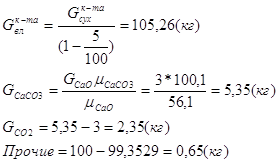

Расчет основных сульфидных минералов

Дополним систему еще одним уравнением:
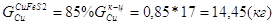

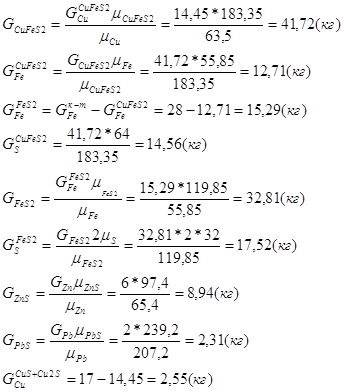
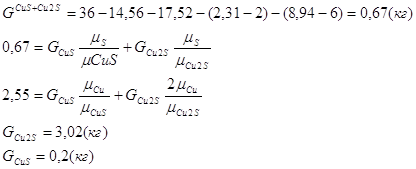
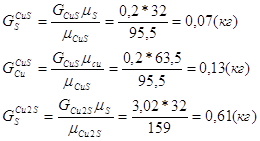

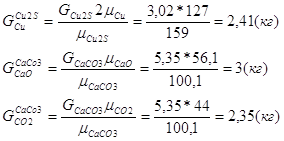
Таблица рационального состава концентрата
| CuFeS2 | CuS | Cu2S | FeS2 | ZnS | PbS | CaCO3 | MgCO3 | SiO2 | Al2O3 | Проч. | Всего |
| Cu | 14,45 | 0,13 | 2,41 | - | - | - | - | - | - | - | - | 17 |
| Fe | 12,71 | - | - | 15,29 | - | - | - | - | - | - | - | 28 |
| S | 14,56 | 0,07 | 0,61 | 17,52 | 2,94 | 0,31 | - | - | - | - | - | 36 |
| Zn | - | - | - | - | 6 | - | - | - | - | - | - | 6 |
| Pb | - | - | - | - | - | 2 | - | - | - | - | - | 2 |
| SiO2 | - | - | - | - | - | - | - | - | 5 | - | - | 5 |
| CaO | - | - | - | - | - | - | 3 | - | - | - | - | 3 |
| CO2 | - | - | - | - | - | - | 2,35 | - | - | - | - | 2,35 |
| Проч. | - | - | - | - | - | - | - | - | - | - | 0,65 | 0,65 |
| Всего | 41,72 | 0,2 | 3,02 | 32,81 | 8,94 | 2,31 | 5,35 | - | 5 | - | 0,65 | 100 |
Расчет состава конверторного шлака
Исходные данные:
Cu тАУ 3%
Fe тАУ 52%
SiO2 тАУ 24%
Fe3O4 тАУ 30%
Вместе с этим смотрят:
11-этажный жилой дом с мансардой
14-этажный 84-квартирный жилой дом
16-этажный жилой дом с монолитным каркасом в г. Краснодаре
180-квартирный жилой дом в г. Тихорецке
2-этажный 3-секционный 18-квартирный жилой дом в г. Мирном