Влияние производных адамантана с различными характерами заместителей на индуцированную агрегацию тромбоцитов человека
В медицине всё ещё стоит вопрос об эффективности лечения патологий системы свёртывания крови, в частности таких нарушений, как тромбоцитоз (патологическое увеличение числа тромбоцитов) и тромбоцитопения (уменьшение числа тромбоцитов в крови). Повышенная способность тромбоцитов к агрегации наблюдается при ряде заболеваний: ишемической болезни сердца, атеросклерозе, диабетических ангиопатиях и др., что значительно осложняет течение болезни [6, 43]. Путём направленного фармакологического воздействия можно снижать патологически возникшую гиперагрегацию тромбоцитов, или наоборот, повышать их способность к агрегации.
В данной работе исследовано влияние производных адамантана с различными характерами заместителей на индуцированную агрегацию тромбоцитов человека. Ранее было показано, что амиды N-[(адамантоил-1)-фенил]-антраниловой кислоты проявляли выраженное ингибирование серотонинового отёка, предполагалось, что это явление вызвано блокированием серотониновых рецепторов сосудистой стенки этими амидами [11].
Научная новизна работы: впервые исследованы вновь синтезированные производные адамантана, способные усиливать или снижать эффект известных индукторов агрегации тромбоцитов посредством модуляции функционирования соответствующих тромбоцитарных рецепторов.
Результаты работы имеют практическое значение тАУ исследованные соединения после более детального изучения механизма их действия могут быть использованы в качестве медицинских препаратов.
По теме дипломной работы опубликовано три статьи (две из них приняты в печать). Результаты представлялись на 56 и 57 научных студенческих конференциях.
Цель работы: изучить механизмы влияния вновь синтезированных производных адамантана на индуцированную агрегацию тромбоцитов человека.
Задачи исследования:
1. Выявить среди исследуемых соединений синергистов (или агонистов) и антагонистов серотонина;
2. Выяснить механизмы влияния этих соединений на индуцируемую агрегацию тромбоцитов человека;
3. Проверить наличие свойств агонистов агрегирующих тромбоциты веществ у всех исследуемых соединений;
4. Выявить синергистов и антагонистов серотонина;
5. Выявить синергистов и антагонистов АДФ;
6. Выявить синергистов и антагонистов адреналина.
Глава 1. Обзор литературы
1.1. Механизмы агрегации тромбоцитов человека
Тромбоциты тАУ плоские безъядерные клетки крови неправильной округлой формы, образующиеся из мегакариоцитов костного мозга путём отщепления от них участков цитоплазмы. Образование тромбоцитов регулируется гликопротеиновым гормоном тромбопоэтином. Нормальные тромбоциты тАУ клетки диаметром 1-5 мкм, толщиной 0,5-0,75 мкм. Содержание тромбоцитов в крови здорового человека составляет 180-320 тыс. в 1 мл. Молодые тромбоциты проходят период созревания тАУ восемь суток, зрелые циркулируют в кровотоке от пяти до 11 суток, с последующим разрушением в печени и селезёнке. Число тромбоцитов в крови относительно постоянно, но ночью оно снижается, аВа возрастает при пищеварении, тяжёлой мышечной работе, беременности [31].
На мембране тромбоцитов адсорбируются факторы свёртывающей системы крови. Тромбоциты способны выделять из фосфолипидов своих клеточных мембран арахидоновую кислоту и превращать её в тромбоксаны (при участии тромбоксансинтетазы), которые повышают агрегационную активность тромбоцитов. Примыкающая к оболочке тромбоцита область неструктурированной цитоплазмы тАУ гиаломер. В гиаломере после активации тромбоцита при электронной микроскопии становятся видны микрофиламенты из актина, миозина и тропомиозина, составляющие вместе с микротрубочками цитоскелет клетки, который определяет её форму и способность перемещать органеллы, прикрепляться к поверхностям и образовывать псевдоподии [42, 48]. Актиновые филаменты имеют диаметр 3-5 нм, а миозиновые 6-10 нм. Микрофиламенты контактируют между собой, плазматической мембраной и мембранами гранул [85]. Микротрубочки в основном состоят из тубулина, их диаметр 25-30 нм. Концентрическая система из 5-30 микротрубочек тромбоцитов образует периферический пучок под плазматической мембраной вдоль экватора клетки. Также присутствуют и другие немембранные структуры тАУ гранулы гликогена.
В тромбоцитах различают две системы мембран: плотную тубулярную систему (ПТС) и систему открытых каналов. ПТС тАУ система узких трубочек диаметром 50 нм, подобная ЭПР скелетной мышцы. Эти трубочки не контактируют с системой открытых каналов, органеллами и плазматической мембраной, расположены и по экватору клетки и среди органелл [36, 86]. Система открытых каналов сообщается с гранулами тромбоцитов и с плазматической мембраной, за счёт чего и осуществляется секреция тромбоцитами специфических соединений в процессе реакции высвобождения. Поверхность тромбоцитов может увеличиваться за счёт системы открытых каналов [36, 82, 86]. Центральная часть тромбоцитов (грануломер) содержит органеллы и множество гранул различной структуры, формы и величины (ВлэлектроноплотныеВ» гранулы, α-гранулы, лизосомы). В электроноплотных гранулах содержатся АДФ, АТФ, ГТФ, ГДФ, неорганический фосфат, серотонин, Са2+; в α-гранулах тАУ трансформирующий ростовой фактор, β-тромбоглобулин, антигепарин (фактор пластинок 4), фибронектин, альбумин, фибриноген, проакцелерин (фактор V), антиген фактора Виллебранда (фактор VIII), калликреин, α2-антиплазмин, тромбоспондин, гистамин; в лизосомах тАУ кислые гидролазы (β-гексозаминидаза, β-галактозидаза, β-глюкуронидаза, β-арабинозидаза, β-глицерофосфатаза, арилсульфотаза) [22, 42].Ва В тромбоцитах имеются гликолитические ферменты и ферменты пентозофосфатного цикла, цикла лимонной кислоты и дыхательной цепи, АТФаза [42].Ва
Важнейшим свойством тромбоцитов является способность к агрегации, в процессе которой в них синтезируется, а затем секретируется ряд белков и биологически активных веществ, стимулирующих свёртывание крови (гемостаз). Тромбоциты принимают участие и в защите организма от чужеродных агентов. Они обладают фагоцитарной активностью, содержат IgG, являются источником лизоцима и β-лизинов, способных разрушать мембрану некоторых бактерий.
Гемостаз осуществляется в 4 фазы: сокращение сосуда, образование тромбоцитарной пробки, формирование красного тромба и его ретракция, полное или частичное растворение тромба [29]. Различают внешний путь свёртывания (в месте повреждения сосудов, индуцируется коллагеном) и внутренний путь свёртывания (в области замедленного кровотока на патологически изменённой поверхности сосудистой стенки, индуцируется факторами плазмы), они различаются начальными этапами, объединяясь на стадии активации фактора Х. В настоящее время известно много факторов свёртывания крови, отсутствие любого из которых может привести к нарушению процесса коагуляции. В основном они представляют собой протеолитические ферменты (факторы XII, XI, X, IX, VII, II и калликреин тАУ сериновые протеазы), присутствующие в крови в неактивной форме в виде проферментов. В процессе свёртывания они активируют друг друга в каскадной последовательности реакций. Активированные факторы обозначаются прибавлением буквы ВлаВ», например, Xа. (рис. 1)

Рис. 1. Схема свёртывания крови и фибринолиза. ФП 3 тАУ тромбоцитарный фактор 3 (по Циммерману, 1996)
Сразу после травмы наблюдается первичный спазм кровеносных сосудов, благодаря чему кровотечение в первые секунды может не возникнуть или носит ограниченный характер. Первичный спазм сосудов обусловлен выбросом в кровь в ответ на болевое раздражение адреналина и норадреналина и длится 10-15 с. Повреждение сосудов сопровождается немедленной активацией тромбоцитов вследствие появления высоких концентраций АДФ (из травмированных клеток сосудов), а так же обнажением субэндотелия, коллагеновых и фибриллярных структур [57]. В дальнейшем наступает вторичный спазм, обусловленный активацией тромбоцитов и выбросом в кровь сосудосуживающих агентов тАУ серотонина, тромбоксана А2, адреналина и др. (реакция высвобождения).
Просвет повреждённых сосудов уменьшается и перекрывается массой тромбоцитов, прилипших к коллагеновым волокнам. Тромбоксан А2 и АДФ, выделяющиеся при разрушении внутриклеточной структуры активированных тромбоцитов, вызывают присоединение новых тромбоцитов. АДФ также может высвобождаться из разрушенных эритроцитов [32], иВа способствует превращению кровяных пластинок в диски, а также вызывает секрецию тромбоцитарных белков из электроноплотных и α-гранул [68]. Тромбоциты распластываются, у них появляется до 10 ВлотростковВ», которые могут в 5-10 раз превышать диаметр самой клетки [2, 34]. Организованное кольцо микротрубочек распадается, изменяется распределение микрофиламентов и микротрубочек, микротрубочки могут образовывать клубочки [36, 54].
На нескольких из этапов гемокоагуляции существуют перекрёстные взаимодействия между внешней и внутренней системами свёртывания, благодаря чему обеспечиваются ВлальтернативныеВ» пути для процессов коагуляции [42, 65].
Агрегация тромбоцитов наступает одновременно с их адгезией, это активный процесс, протекающий с затратой энергии. Адгезия тромбоцитов к волокнам соединительной ткани по краям раны обусловлена олигомерным гликопротеином, содержащимся в субэндотелии и кровяных пластинках, тАУ фактором Виллебранда. Он образует мостики между субэндотелиальными структурами и специфическими рецепторами (гликопротеин Ib) на мембране тромбоцитов [8].Ва Фибриноген тАУ белок, содержащийся в плазме и тромбоцитах, тоже способный образовывать между тромбоцитами связующие мостики, что приводит к появлению сети фибрина и тромбоцитарной пробки. Частичный протеолиз молекулы фибриногена наступает под действием тромбина. Для образования ковалентных связей необходим фибринстабилизирующий фактор XIII (трансглутаминаза), активируемая тромбином в присутствии ионов кальция. Трёхмерная сеть волокон фибрина удерживает клетки крови, формируется красный тромб (рис. 1). Благодаря контрактильному белку тромбостенину тромбоциты подтягиваются друг к другу, тромбоцитарная пробка сокращается и уплотняется, т. е. наступает её ретракция [49]. Сгусток становится более плотным и стягивает края раны, что облегчает её зарастание клетками соединительной ткани. В норме остановка кровотечения из мелких сосудов занимает от двух до четырёх минут [34].
Таким образом, при повреждении кровеносного сосуда в крови появляются вещества, инициирующие процесс агрегации тромбоцитов. Характер действия этих веществ разный, так, слабыми агрегирующими агентами являются АДФ, серотонин, адреналин, вазопрессин, тАУ они действуют первыми, лишь запуская каскад последующих реакций. Более быстро агрегация происходит под действием коллагена, тромбина, ионофора А23187. Агрегация тромбоцитов может носить обратимый характер (вслед за агрегацией наступает дезагрегация, распад агрегатов), что зависит от недостаточной дозы агрегирующего агента или от наличия в крови простациклина PGI2, синтезирующегося в эндотелии сосудов, который ингибирует агрегацию тромбоцитов [5]. Травма сосуда всегда сопровождается образованием сразу нескольких индукторов агрегации, способных инициировать агрегацию тромбоцитов разными путями, и их концентрация достаточно высока, поэтому дезагрегация, как правило, не случается.
Биохимические механизмы активации тромбоцитов с их последующей агрегацией различны, что обусловлено различным характером инициаторов агрегации. Однако, все известные агреганты так или иначе способствуют увеличению концентрации Са2+ в цитоплазме тромбоцита.
Общее содержание Са2+ в тромбоцитах составляет около 60 нмоль/109 клеток. Четверть этого кальция связана с мембранами тромбоцитов, но значительное его количество содержится в тубулярной системе и плотных гранулах. Концентрация свободных ионов Са2+ в цитоплазме тромбоцитов (10-7 моль/л)почти в 1000 раз ниже, чем в плазме (10-3 моль/л). Такая разница в концентрации этих ионов по обе стороны плазматической мембраны поддерживается мембранными Са2+-АТФазами, которые используют энергию гидролиза АТФ для откачивания Са2+ из цитоплазмы в окружённые мембранами клеточные органеллы, а так же аденилатциклазами и фосфодиэстеразами, контролирующими уровень цАМФ. Активированная аденилатциклаза катализирует образование цАМФ из АТФ, фосфодиэстераза осуществляет гидролиз цАМФ до 5-АМФ. Аденилатциклаза тромбоцитов локализована на внутренней стороне плазматической мембраны, на мембранах плотной тубулярной системы и системы открытых каналов. Фосфодиэстераза находится в цитоплазме. Активация аденилатциклазы происходит посредством взаимодействия простагландинов Е1, I2 и D2 со специфическими рецепторами мембран, сопряжёнными с ГТФ-связывающими белками (G-белки). Для этих рецепторов цАМФ служит внутриклеточным медиатором. Активированные рецепторы действуют на G-белки, которые стимулируют аденилатциклазу, образуется цАМФ, активируются цАМФ-зависимые ферменты (протеинкиназы), катализирующие фосфорилирование небольшой группы тромбоцитарных белков [36].
Адреналин, связываясь со специфическими рецепторами мембраны тромбоцитов, посредством G-белков стимулирует образование тромбоксана А2 [36]. Предполагается, что ускоряющий агрегацию тромбоцитов эффект адреналина связан с модуляцией мембран при его взаимодействии с α-адренорецепторами и изменением её проницаемости к ионам Са2+ [73, 79]. Показано, что антагонисты α2-адренорецепторов способны блокировать агрегацию, а агонисты усиливают её, поскольку активированные Gi-белки ингибируют аденилатциклазу [10, 59]. Через β-адренорецепторы происходит замедление агрегации тромбоцитов. Стимуляция β-адренорецепторов посредством Gs-белков приводит к активации аденилатциклазы, т. е. катехоламины способны регулировать активность тромбоцитов, влияя на уровень цАМФ в клетке. Адреналин вызывает агрегацию тромбоцитов без изменения их формы [53]. Адреналин-индуцированное изменение оптической плотности проб наблюдается через 30 с после его добавления [36].
Активация тромбоцитов тромбином, коллагеном, фактором активации тромбоцитов (ФАТ) и некоторыми другими агрегантами происходит через образование из фосфолипидов плазматической мембраны (фосфатидилхолина и фосфатидилинозитола) арахидоновой кислоты [50]. Активированная через сопряжённые с Gs-белками рецепторы для ФАТ фосфолипаза С катализирует этот процесс. Арахидоновая кислота способна метаболизировать, вновь включаться в фосфолипиды или диффундировать из тромбоцитов. Высвобождение арахидоновой кислоты из фосфолипидов тромбоцитов могут катализировать также фосфолипаза А2 и глицеролипаза. Образовавшаяся арахидоновая кислота может окисляться двумя ферментами: цитоплазматической циклооксигеназой (ЦОГ) и мембранносвязанной липоксигеназой (ЛОГ). При действии ЦОГ образуются нестабильные циклические эндопероксиды, которые превращаются в простагландины G2 и Н2, тромбоксан А2, простациклин с дальнейшим образованием из них 6-кето-простагландина Е1, 12-гидрокси-5,8,10-гептадекатриеновой кислоты, тромбоксана В2 и малондиальдегида. Конечными продуктами липоксигеназного пути окисления арахидоновой кислоты являются 12-гидрокси-5,8,10,14-эйкозатетраеновая кислота (12-НЕТЕ) и лейкотриены [36]. Образующиеся из арахидоновой кислоты простагландины и тромбоксан А2 (ионофор кальция) являются агрегантами. Простациклин, синтезируемый клетками эндотелия кровеносных сосудов, напротив, мощный ингибитор агрегации тромбоцитов.
Связывание АДФ со специфическими рецепторами плазматической мембраны тромбоцита приводит к увеличению концентрации ионов кальция в цитоплазме клеток (увеличивается его поступление из внешней среды и из внутриклеточных запасов) [33]. Кроме того, происходит активация фосфолипазы А2, которая стимулирует высвобождение арахидоновой кислоты из фосфолипидов мембраны и образование из неё тромбоксана А2 тАУ активного проагреганта и вазоконстриктора. Форма тромбоцитов изменяется без сопутствующей активации фосфолипазы С, что сопровождается ингибированием аденилатциклазы [61, 77]. Реализация метаболических эффектов активации АДФ-рецепторов тромбоцитов осуществляется через сопряжение с мембранным G-белком. Сегодня известно, что при активации на поверхности каждого тромбоцита появляется до 50тАУ100 тысяч гликопротеиновых рецепторов [76]. Экспериментальные данные многих клинических исследований свидетельствуют, что удаление из среды АДФ или связывание АДФ-рецепторов с конкурентным антагонистом существенно угнетает агрегацию тромбоцитов [72, 76, 78, 81].
Для серотонина на поверхности тромбоцитов существует два типа рецепторов тАУ ионные каналы и рецепторы, сопряжённые с G-белком [40, 45]. Согласно [47], механизм действия серотонина состоит в регуляции цАМФ-зависимых путей,Ва и поэтому реакция на серотонин способна блокироваться стимуляторами аденилатциклазы и ингибиторами фосфодиэстеразы. Серотонин стимулирует поступление ионов кальция из плазмы в тромбоциты через рецепторуправляемые каналы для двухвалентных катионов, запуская фосфатидилинозитоловый цикл с образованием фосфатидной кислоты, являющейся кальциевым ионофором. Активация G-белков, сопряжённых с другим типом серотониновых рецепторов приводит к активации фосфолипазы С, которая гидролизует трифосфатидилинозитол (или фосфатидил-4,5-бифосфат) в дифосфатидилинозитол (фосфатидилинозитол-4-фосфат) с образованием 1,2-диацилглицерола (ДАГ), который фосфорилируется в фосфатидную кислоту (ФК). Это самые ранние этапы активации тромбоцитов. Диацилглицерол стимулирует Са2+-активируемые фосфолипидзависимые протеинкиназы (в частности, ПК С), которые фосфорилируют белки. Фосфатидная кислота тАУ кальциевый ионофор, высвобождает кальций из внутриклеточных депо, присоединяя к своим фосфатным группам. Ионы кальция стимулируют работу актина и миозина микрофиламентов, в результате чего гранулы тромбоцитов перемещаются к системе открытых каналов, осуществляется реакция высвобождения собственных агрегантов, что усиливает собственный ответ клетки и активирует другие тромбоциты.
Таким образом, активация тромбоцитов начинается при взаимодействии агрегантов с рецепторами плазматической мембраны. Важную роль в передаче сигнала внутрь тромбоцита играют G-белки плазматической мембраны, а также изменение проницаемости мембраны для ионов (если рецептор является ионофором) [38].
1.2. Роль рецепторов плазматической мембраны в процессах агрегации тромбоцитов человека
В настоящее время установлено, что важным моментом трансмембранной передачи сигналов является изменение интенсивности транспорта и внутриклеточной концентрации различных ионов. Одной из основных систем, приводящих к изменению внутриклеточной концентрации ионов, являются селективные ионные каналы биомембран, представляющие собой интегральные мембранные белки, способные при определённых внешних воздействиях (изменение потенциала на мембране, действие медиатора или гормона) избирательно менять проницаемость мембраны для конкретного вида ионов [26]. Агрегацию тромбоцитов и вазоконстрикцию индуцирует 5-гидрокситриптамин (серотонин), который также синергически усиливает эффекты тромбоксана А2, ангиотензина II, АДФ и коллагена [55]. Эта активность проявляется через взаимодействие со специфическими рецепторами на поверхности тромбоцитов тАУ 5-НТ-рецепторами (рецепторы 5-гидрокситриптамина) [46]. Серотонин (5-гидрокситриптамин) является производным триптофана и синтезируется в клетках пищеварительного тракта, нервных (серотонинэргических) и тучных клетках; способен накапливаться в специальных гранулах тромбоцитов. Физиологическое действие серотонина в организме человека разнообразно, он является лигандом для рецепторов клеток практически всех внутренних органов и тканей [67, 87]. Фармакологические эффекты серотонина коррелируют главным образом с возбуждением 5-НТ2 рецепторов [51, 52, 63]. Исследователями [48, 62, 66, 69, 70] синтезировано множество соединений, способных связываться с этими рецепторами и модулировать их функционирование. Установлено, что рецепторы для 5-гидрокситриптамина (серотонина) находятся на клетках практически всех внутренних органов человека, регулируя многие процессы жизнедеятельности. Классификация 5-НТ рецепторов на семь семейств (от 5-НТ1 до 5-НТ7) основана на структурных, функциональных и фармакологических критериях [58]. Семейства в свою очередьВа делятся на подсемейства [67, 80]. Выяснено, что некоторые 5-НТ рецепторы связаны с G-белками [40]. Рецепторы серотонина, расположенные на тромбоцитах и клетках гладкой мускулатуры сосудов относятся к подтипу 5-НТ2А рецепторов, остальные представители этого подтипа тАУ 5-НТ2ВВа и 5-НТ2С локализованы только на нейронах [71, 80, 84].
Есть данные о примерном расположении в мембране и структуре активного центра 5-НТ4 рецептора.
Представители некоторых семейств 5-НТ рецепторов синтезируются с использованием методов генной инженерии in vitro, выделяются методом микродиализа [82] или экстракцией из клеточных мембран [74]. На плазматической мембране тромбоцитов локализованы два типа рецепторов для серотонина [75].
Исследованиями [11, 55] показана зависимость снижения агрегационной способности тромбоцитов от геометрии молекулы изучаемого вещества. Есть данные о том, что сродство к 5-НТ2 рецепторам увеличивается при наличии объёмного адамантил-заместителя [44]. Так же доказано антагонистическое действиеВа SB-699551-A (3-циклопентил-N-[2-(диметиламино)этил]-N-[(4¢-{[(2-фенилэтил)амино]метил}-4-бифенилил)метил]пропанамид дигидрохлорид), имеющего объёмное, сложное молекулярное строение на 5-НТ5А рецепторы мозга свиньи [82].
Ионотропные рецепторы для серотонина являются членами суперсемейства мембранных белков, которое включает также рецепторы для никотина, глицина, γ-аминомасляной кислоты (ГАМК). Все они обладают одинаковыми свойствами тАУ один и тот же белок является и рецептором и ионным каналом, сформированным различными комбинациями 2α, β, γ, δ и ε субъединиц. Лиганд рецептора этого суперсемейства связывается с α-субъединицей и стимулирует открытие неспецифического ионного канала [17].
Большинство рецепторов относятся к семейству мономерных гликопротеинов, семикратно пересекающих мембрану. Они выполняют разнообразные биологические сигнальные функции. К таким рецепторам относятся адренорецепторы и рецепторы для АДФ тромбоцитов, а так же часть 5-НТ рецепторов тромбоцитов. АДФ активирует тромбоциты через их три аденозинфосфат-зависимых рецептора: Р2Х, П2И и Р2Т [64]. Гликопротеиновые рецепторы имеют очень древнее происхождение. Их используют, например, клетки дрожжей, которые выделяют необходимые для спаривания полипептидные факторы и распознают их с помощью поверхностных рецепторов, представляющих собой все те же семикратно пересекающие мембрану рецепторы.
Уникальная структура лиганд-связывающих участков семикратно пересекающих мембрану рецепторов позволяет связывать лиганды различной природы и молекулярной массы в широком диапазоне от 32 для Ca2+ до более чем 102 кДа для гликопротеинов.
Большинство обычных низкомолекулярных гормонов (типа адреналина и ацетилхолина) связывается с участками внутри гидрофобного ядра (a). Пептидные и белковые лиганды присоединяются к внешней поверхности рецептора (b, c). Некоторые лиганды низкого молекулярного веса, Ca2+ и аминокислоты (глутамат, ГАМК) связываются с длинными участками на N-конце, индуцируя их переход в новую конформацию, в которой длинный участок взаимодействует с рецептором (d). В случае рецепторов, активируемых отрезающей протеазой (e), новый N-конец действует как автолиганд. Отрезанный пептид может также взаимодействовать с другим рецептором.
1.3. Биологическая активность производных адамантана
Производные адамантана как физиологически активные вещества находят широкое применение с 70-х годов XX века [20]. Сам адамантан (трицикло[3.3.1.1.]декан, С10Н16) принадлежит к числу трициклических нафтенов мостикового типа (рис. 6).
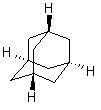
Рис. 6. Структура молекулы адамантана.
Молекула его состоит из трёх конденсированных циклогексановых колец в конформации кресла. Пространственная модель молекулы адамантана тАУ высокосимметричная конструкция с малой поверхностью и незначительными силами межмолекулярного взаимодействия в кристаллической решётке [23]. Из всех трициклических углеводородов адамантан наиболее устойчив, что объясняется тетраэдрической направленностью связей всех атомов углерода и их фиксированным положением.
Биологическая активность производных адамантана обусловлена симметрией и объёмностью пространственного строения, значительной
липофильностью жёсткого углеводородного каркаса адамантана, что позволяет им легко проникать через биологические мембраны [3]. Поэтому модификация органических соединений с помощью адамантильного радикала значительно изменяет их биологическую активность, нередко усиливая её. С помощью метода спиновых меток было показано, что адамантан, попадая в липидный бислой, способен разрушать гексагональную упаковку метиленовых группировок, характерную для двойного слоя фосфолипидов, и нарушать осевое расположение алкильных цепей фосфолипидов, модифицируя тем самым функциональные свойства клеточных мембран [18]. Принимая во внимание важность порядка расположения метиленовых групп липидов биологических мембран как фактора функционирования связанных с мембранами ферментов, можно отметить косвенное влияние адамантана на их активность.
На данный момент синтезировано более 1000 новых производных адамантана. Фармакологическое изучение показало наличие среди них веществ, обладающих выраженной психотропной, иммунотропной, противовирусной, курареподобной, антикаталептической, противоаллергической активностями, а также соединений, влияющих на ферментативную систему печени [37]. Амиды адамантанкарбоновых кислот проявляют антибактериальную активность [30].
Есть данные о результатах модификации молекулы энкефалина аминокислотами ряда адамантана. Введённый в положение 5 молекулы энкефалина (S)-адамантилаланин придаёт опиоидному пептиду резистентность по отношению к ферментам, легко разрушающим немодифицированный энкефалин (химотрипсин, проназа, нейтральная протеаза, термолизин) [24].
Показано, что физиологической активностью обладают азотсодержащие производные. Первым в медицинскую практику в 1966 г.Ва вошёл гидрохлорид 1-аминоадамантана, обладающий противовирусной активностью в отношении штаммов вирусов типа А2, его фирменные названия: мидантан, симметрел, амантадин. Эти препараты используются для профилактики респираторных заболеваний, т. к. обладают способностью блокировать проникновение вируса в клетку. Предполагают, что данные препараты способны работать на начальных этапах репродукции вируса, блокируя синтез вирусоспецифичных РНК [3]. Противовирусная активность некоторых аминопроизводных адамантана связана с их способностью ингибировать ПК С [39]. Ремантадин (полирем, флумадин), как липофильное слабое основание способен повышать рН эндосомального содержимого и препятствовать депротеинизации вируса [1].
ВаВ клинической практике для лечения вирусных заболеваний применяются также такие препараты, как ацикловир (виролекс, герпесин, зовиракс, лизавир, суправиран), диданозин, фоскарнет (триаптен), ганцикловир (цимевен), ламивудин, рибавирин (виразол, рибамидил), ставудин, трифлуридин, видарабин, зальцитабин (хивид), зидовудин (азидотимидин, ретровир) [9]. Однако, у большинства этих препаратов относительно узкий спектр противовирусного действия, их недостатком является наличиеВа разнообразных побочных реакций, появление резистентных штаммов вирусов и др. [25, 35].
Противовирусной активностью в отношении штаммов вирусов типа А2 обладают и производные алкиладамантанов: 1-гидрокси-3,5диметил-7-этиладамантан, 1-метокси-3,5диметиладамантан, которые, в отличие от мидантана, показали высокую противовирусную активность и в отношении штаммов strains of rhino viruses и herpes simplex [3]. Ряд гидрокси-, галоген- и меркаптопроизводных амидов адамантана тоже обладают противовирусной активностью [7, 19].
Показано, что амантадин способен препятствовать развитию очагов саркомы на зародышевой культуре, другие производные адамантана могут служить снотворными средствами, антималярийными препаратами,Ва инсектицидами [37]. В экспериментах с использованием ВИЧ-инфицированных человеческих лимфобластоидных клеток показано, что некоторые производные адамантана обладают анти-ВИЧ-активностью [21]. Мидантан используется в неврологической клинике для лечения болезни Паркинсона и паркинсонического синдрома. Подобную активность проявляют хлорангидриды 3,5,7-алкилзамещённых 1-аминоадамантанов, некоторые из которых обладают антагонистическими дофамину свойствами. Некоторые четвертичные аммониевые основания с 2-адамантильным радикалом способны действовать как миорелаксанты периферического действия (курареподобная активность). Производные 1-аминоадамантана и 3,3-диамино-1,1-диадамантила противокаталептически активны, бактериостатическое влияние оказывают адамантанкарбоновые кислоты и фосфаты адамантантиолов и их производных. Диалкиламиновые эфиры адамантантиокарбоновой кислоты проявляют бактерицидную, фунгицидную, гербицидную активность [12]. Натриевая соль β-(1-адамантан)-пропионовой кислоты обладает желчегонным действием. 1-адамантиламмоний-β-хлорэтилоксаминоат и некоторые другие производные адамантана типа 1-AdCH2OCH2CH(OH)CH2NRR΄ обладают анестезирующим действием [3].
Антибактериальное действие, сравнимое с антибактериальным препаратом 5-нитро-8-гидроксихинолином, оказывают N-(нитрофенил)-адамантил-карбоксамиды и адамантилзамещённые N-(1-метилпиридиний)йодиды [13].
Перфторированный адамантан применяется в качестве компонента искусственной крови [28]. Есть данные об антиагрегационной способности производных адамантана по отношению к различным путям агрегации тромбоцитов [55].
1.4. Производные адамантана, влияющие на агрегацию тромбоцитов
Ярко выраженная липофильная природа каркасного углеродного фрагмента адамантана обуславливает высокую биологическую активность его производных. Введение в молекулу производного высоколипофильного радикала усиливаетВа его взаимодействие с гидрофобными областями рецепторных молекул [27].
Показано влияние модифицированных адамантильных и амидных фрагментов амидов N-[(адамантоил-1)-фенил]-антраниловой кислоты на 5-НТ2 рецепторы тромбоцитов человека: снижение их АДФ- и серотонин-индуцированной агрегации [11]. Кроме того, известно, что сродство к данным рецепторам обусловлено наличием объёмного адамантильного заместителя [55, 56, 60, 83]. Была предположена биологическая активность ряда 1-адамантанкарбоксамидов в качестве антагонистов 5-НТ2 рецепторов тромбоцитов. Высокоспецифическое сродство к изучаемым рецепторам и мощный антиагрегационный эффект был подтверждён и in vitro и in vivo для (S)-N-{1-[2-(4-флуорофенил)этил]пирролидин-3-ил}-1-адамантанкарбоксамид гидрохлорид гидрата (10-(S), Y-39241) [55].
Ряд синтезированных адамантильных производных гетерофункциональных соединений проявил свойства антагонистов и синергистов серотонина при исследовании их влияния на серотонин-индуцированную агрегацию тромбоцитов человека [13].
Глава 2. Материал и методы исследования
Проведено исследование влияния на индуцированную агрегацию тромбоцитов человека 19-ти производных адамантана с различающимися по структуре и свойствам заместителями (табл. 1).
Таблица 1.
Исследуемые соединения
| № | Химическая формула вещества | Название вещества |
| 1 | 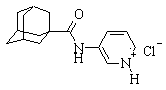
| N-(1-адамантил)-3-аминопиридина гидрохлорид |
| 2 | 
| 2-[N-(1-адамантоил)амино]-1-метилпиридиний иодид |
| 3 | 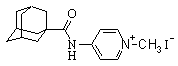
| 4-[N-(1-адамантоил)амино]-1-метилпиридиний иодид |
| 4 | 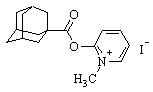
| N-(1-метилпиридиний-3-ил)-адамантил-1-карбоксамид иодид |
| 5 | 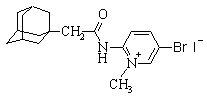
| 2-[N-(1-адамантоил)амино]-4-бром-1-метилпиридиний иодид |
| 6 | 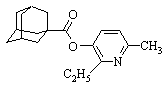
| 3‑(адамантил-1-карбонилокси)-2‑этил‑6-метилпиридин |
| 7 | 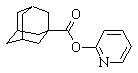
| 2‑(адамантил‑1‑карбонилокси)-пиридин |
Продолжение таблицы 1.