Динамическое поведение мембранных систем и липидно-белковые взаимодействия
Все биологические структуры по своей природе динамичны, и при рассмотрении их функций необходимо учитывать подвижность компонентов, из которых эти структуры состоят. Это относится к ферментам, полинуклеотидам и, конечно, к мембранам. В жидкостно-мозаичной модели, в центре которой находится представление о подвижности мембранных компонентов, мембрана рассматривается как некое липидное море, в котором свободно плавают глобулярные белки. За последние два десятилетия было опубликовано множество работ, посвященных количественным и качественным аспектам динамики мембранных компонентов. Во многих из них использовались спектральные методы и спектроскопия магнитного резонанса. В результате была создана весьма полезная физическая картина мембран, иллюстрирующая способы перемещения мембранных белков и липидов и их взаимодействия. Кроме того, были разработаны специальные методики, направленные на изучение динамических свойств мембран. Многое в этой области остается неясным, но уже определены основные направления будущих исследований.
Главным побудительным мотивом в изучении мембранной динамики служит ее связь с биологическими функциями мембран. Необходимым условием протекания одних ферментативных процессов является свободная диффузия мембраносвязанных компонентов в плоскости бислоя, другие же процессы могут осуществляться лишь при ограниченной подвижности мембранных компонентов. Между шероховатым и гладким эндоплазматическими ретикулумами, комплексом Гольджи и плазматической мембраной происходит быстрый обмен различными веществами, и тем не менее их состав и функции различаются. Чтобы понять суть этих и многих других биологических феноменов, необходимо прежде всего выяснить фундаментальные аспекты динамических свойств мембран. Поперечная асимметрия в распределении липидов, а возможно, и пассивная проницаемость бислоев очевидным образом связаны со скоростью трансмембранного флип-флоп-переноса липидов. Биогенез мембран зависит от скорости обмена липидов между различными мембранами. Скорость ферментативных реакций, протекающих с участием мембраносвязанных компонентов, зависит от скорости латеральной диффузии компонентов мембран. Наконец, липидно-белковые взаимодействия зависят от скорости, с которой происходит обмен липидами между ближайшим окружением белков и остальным объемом мембраны.
Диапазон движений, происходящих в мембране, весьма широк: от молекулярных колебаний с частотой порядка 1014 с до трансмембранного флип-флоп-переноса липидов, характерное время которого может достигать несколько суток. На рис. 1 в общем виде представлены некоторые из этих процессов, а также указаны временные пределы чувствительности различных биофизических методов. Величины, приведенные на рисунке, различаются на 20 порядков, поэтому термины ВлбыстрыйВ» и ВлмедленныйВ» не могут адекватно характеризовать различные типы движений. Из рисунка видно также, что одни методы позволяют получить статичную картину мембраны, поскольку характерное время соответствующих движений больше, чем время измерений, в то время как другие методы дают усредненную по времени картину, поскольку время перемещения молекул гораздо меньше, чем время измерения.

Мы рассмотрим два основных типа экспериментов. Первые основаны на использовании внутримембранных зондов для изучения текучести мембраны. Индикаторами физического состояния мембраны, а также характера липидно-белковых взаимодействий могут служить низкомолекулярные ЭПР-метки и флуоресцентные зонды.
Второй тип экспериментов направлен на прямое измерение латеральной диффузии мембранных белков или липидов и вращательной способности белков внутри бислоя. Исследовались также молекулярные взаимодействия в бислое, поскольку они влияют на динамику изучаемых молекул.
1. Некоторые простые модели движения мембранных компонентов
На рис. 2 представлены некоторые модели, использующиеся для анализа поступательного движения молекул внутри мембранного бислоя. Такие модели необходимы для интерпретации экспериментальных данных с точки зрения молекулярного движения.
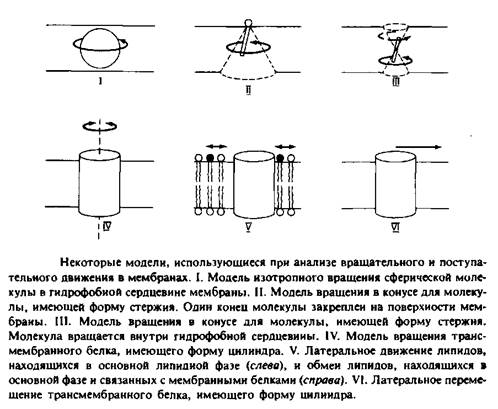
Модель изотропного вращения предполагает, что молекула вращается с одинаковой вероятностью во всех направлениях и выделенная ось вращения отсутствует. Подобное вращение будет совершать сферическая частица в непрерывной жидкой среде. Эта концепция применялась при анализе движения малых растворимых в мембране гидрофобных меток, таких, как TEMPO. Изотропная трехмерная диффузия сферической частицы рассматривается как случайное блуждание и характеризуется коэффициентом вращательной диффузии DBp. Этот параметр определяется как среднеквадратичное угловое отклонение или время релаксации.
2.Модель вращения в конусе описывает движение амфифильных меток, например производных жирных кислот. Эти молекулы можно представить в виде жестких стержней, один конец которых закреплен на поверхности мембраны. Их движение ограничивается конусом, который они описывают относительно некой оси, перпендикулярной плоскости мембраны.
3.Модель вращения в конусе используется в некоторых работах для описания движения ДФГ тАФ гидрофобного флуоресцентного зонда, представляемого в виде жесткого стержня. В данном случае эта модель, постулирующая существование предпочтительной ориентации для ДФГ, является, безусловно, слишком упрощенной, поэтому были предложены альтернативные модели.
4. В простейшей модели вращения белков белковая молекула представляется в виде цилиндра, закрепленного в мембране и способного вращаться только вокруг оси, перпендикулярной плоскости мембраны. Такое вращение анизотропно. Время релаксации, характеризующее это движение, обычно представляется в виде 4>ц = \/. Знак ВлIIВ» указывает на то, что вращение происходит
параллельно оси цилиндра.
5 и 6. Поступательное движение липидных и белковых молекул описывается как двумерная диффузия. Особый интерес представляет скорость обмена липидов, связанных с мембранными белками и находящихся в основном объеме мембраны. Изотропная двумерная диффузия характеризуется среднеквадратичным перемещением 2>, происходящим за время 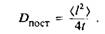
Таблица 1. Некоторые метки, использующиеся для изучения динамики мембран
Для обычной жидкости, какой является, например, вода, текучесть определяется как величина, обратная вязкости тАФ понятному и легко измеряемому физическому параметру. Вязкость характеризует трение, возникающее между соседними слоями жидкости, которые движутся с разными скоростями. Вязкость жидкости можно оценить, измерив скорость, с которой падает мраморный шарик в жидкости. В случае мембран термин ВлтекучестьВ» обычно носит скорее качественный характер: имеется в виду сопротивление, которое оказывает мембрана различным типам перемещений в ней. Как правило, для измерения текучести наблюдают за движением спиновых или флуоресцентных зондов, включенных в мембрану. Зондами обычно являются небольшие молекулы, сравнимые по размерам с мембранными фосфолипидами. Некоторые из них представлены в табл. 5.1. Теоретические основы использования спектроскопических методов для изучения молекулярных движений описаны в последующих разделах. Поскольку эти методы позволяют измерять как скорость движения, так и сопротивление этому движению, сведения о динамике и молекулярной упорядоченности даются вместе. Укажем некоторые моменты, существенные для количественной интерпретации данных по движению зондов внутри мембран.
1.Липидный бислой не является простой вязкой трехмерной гомогенной жидкостью, а представляет собой жидкую среду с низкой вязкостью, у которой состав и динамические свойства в центральной области сильно отличаются от состава и свойств периферических полярных участков.
2.Вращение зондов изотропно, как это имеет место в случае сферических частиц, не обладающих выделенной осью вращения. Часто зонды внутри мембраны имеют предпочтительную ориентацию и их движения ограничены определенными рамками. Интерпретация экспериментальных данных зависит от модели, используемой для описания молекулярного движения.
3.Локализация зондов в мембране может различаться. Например, зонд может быть связан с белковой молекулой или белковыми агрегатами, располагаться внутри липидного домена, который может находиться в различных физических состояниях.
Для оценки текучести определяют спектроскопические параметры низкомолекулярных зондов. К таким параметрам относятся: 1) время вращательной корреляции спиновых меток или флуоресцентных зондов; 2) параметр упорядоченности; 3) стационарная анизотропия флуоресцентных зондов; 4) коэффициент распределения зондов между мембранной и водной фазами. Ясно, что текучесть мембраны, оцененная только по одному параметру, не может служить достаточно полной характеристикой физического состояния мембраны. И все же измерение отдельных параметров весьма полезно, особенно для характеристики изменений физического состояния мембраны, обусловленных, например, изменениями температуры, давления, содержания холестерола, фосфолипидного или ионного состава. Обычно текучесть, измеряемая с помощью спиновых меток и флуоресцентных зондов, однозначно связана с упаковкой липидов в мембране. Воздействия, приводящие к уменьшению площади, приходящейся на одну липидную молекулу, такие, как увеличение гидростатического давления, понижение температуры или добавление холестерола к фосфолипидам в жидкокристаллическом состоянии, вызывают уменьшение текучести. Это согласуется с теорией свободного объема, согласно которой текучесть и плотность связаны между собой обратной зависимостью. Чем более плотная упаковка характерна для мембраны, тем более ограниченным будет движение зонда. Такой подход приемлем при рассмотрении текучести большинства неассоциированных жидкостей.
2. Физиологическое значение текучести мембран
Обычно биомембраны находятся в жидкокристаллическом состоянии, и, по-видимому, поддержание такого состояния очень важно для их функционирования. При переходе мембраны из жидкокристаллической фазы в фазу геля текучесть уменьшается примерно на два порядка. Структурные и динамические свойства бислоя, находящегося в фазе геля, совершенно несовместимы с организацией и правильным функционированием белковых компонентов в мембране. Впрочем, из этого правила имеются несколько исключений. Это, например, полукристаллические области пурпурных мембран Н. halobium, содержащие бактериородоп-син.
Возможно, наиболее яркое доказательство того, что текучесть, измеряемая с помощью спиновых меток или флуоресцентных зондов, играет важную физиологическую роль, получено в исследованиях по адаптации различных организмов к внешним экстремальным воздействиям. Подобные явления наблюдаются чаще всего при изучении термического стресса, когда микроорганизмы, растения, пойкилотермные или зимующие животные подвергаются воздействию низких температур. Адаптация заключается в изменении липидного состава мембран, а именно тАФ в увеличении содержания ненасыщенных липидов или уменьшении средней длины ацильной цепи. Подобные изменения ведут к уменьшению плотности упаковки липидов в мембране и, таким образом, поддерживают текучесть мембраны. Текучесть мембран может быть критичной для одной или более мембранных функций, но каков механизм этого феномена на молекулярном уровне тАФ неизвестно.
2.1 Характер и скорость движений, измеряемых с помощью 2Н-ЯМР, ЭПР и флуоресцентных зондов
Необходимо иметь представление о том, что именно измеряется с помощью мембранных зондов; особенно важно знать, каково отношение между временным интервалом, в котором наблюдается изучаемый тип движения, и временной шкалой, характерной для данного метода. Рассмотрим общий случай, который одинаково применим к ЭПР, измерению флуоресценции или 2Н-ЯМР. Все три спектроскопических метода чувствительны к ориентации молекул относительно лабораторной системы координат. Спектр 2Н-ЯМР чувствителен к ориентации связи СтАФD относительно приложенного поля. Это связано с тем, что градиент локального поля, векторно суммируясь с внешним полем, дает результирующую, которая и улавливается дейтерием. Аналогичная ситуация характерна и для ЭПР. Спектр ЭПР зависит от ориентации нитроксидной связи NтАФ О, которую содержат большинство обычно используемых зондов, относительно приложенного магнитного поля. В случае флуоресцентной спектроскопии измеряемая поляризация испускаемого света зависит от ориентации дипольного момента перехода молекулы относительно направления, определяемого используемым поляризатором.
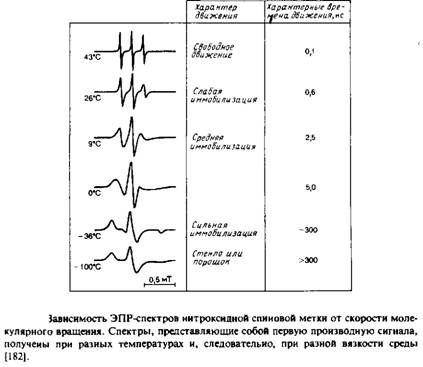
Если молекулы образца ориентированы случайным образом и полностью неподвижны, то каждая субпопуляция, характеризующаяся определенной ориентацией, будет иметь свой уникальный спектр ЭПР или ЯМР, а спектр всего образца будет равен простой сумме этих спектров с учетом их вкладов, определяемых концентрацией соответствующих молекул. Суммарный спектр называется ВлпорошковымВ» или ВлтвердостекольнымВ» и обычно весьма широк. Такой спектр сильно отличается от спектра образца, в котором молекулы также ориентированы случайным образом, но характерное время их движений гораздо меньше времени измерения. В рассматриваемых нами примерах соответствующие частоты составляют 105 с-1 для 2Н-ЯМР и 108 с"1 для ЭПР. Каждая молекула, совершающая быстрое изотропное движение, воспринимает некое среднее магнитное поле, но при этом для всех молекул это среднее поле одинаково, поэтому пики в результирующем спектре очень острые. Примеры ЭПР-спектров приведены на рис. 5.3. Поскольку характерные времена измерения для методов ЭПР и ЯМР различаются, молекула со временем корреляции 106 с будет казаться неподвижной в первом случае и очень быстро движущейся во втором.
Метод измерения деполяризации флуоресценции состоит в том, что образец облучают поляризованным светом и спустя несколько наносекунд регистрируют испускаемый свет. Если молекулы остаются неподвижными в течение времени между процессами поглощения света и его испускания, то поляризация испускаемого света будет определяться в основном поляризацией света возбуждающего. Если же молекула совершает быстрое изотропное вращение, то вектор напряженности электрического поля испускаемого света не будет иметь предпочтительной ориентации, поскольку поляризация будет равна нулю. Значения поляризации, находящиеся между этими двумя крайними величинами, соответствуют или медленным движениям, при которых популяция молекул не успевает достичь полностью разупорядоченного состояния за время 10-8 с, или быстрым движениям, ограниченным в пространстве и, следовательно, не допускающим полную разупорядоченность.
Все три спектроскопических метода используются для нахождения параметра упорядоченности S:
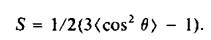
cos20 тАФ это усредненная по времени ориентация молекулы относительно нормали к плоскости мембраны. Время, за которое происходит усреднение, зависит от метода: 10~5 с для 2Н-ЯМР, 10~8 с для ЭПР и деполяризации флуоресценции. В случае 2Н-ЯМР этот параметр чувствителен к медленным движениям, совершающимся за времена порядка 10"5 с. Метод ЭПР или деполяризации флуоресценции регистрирует процессы, совершающиеся за время около 10"8 с, а информация о более медленных движениях утрачивается.
Данные о динамических свойствах мембран можно получить с помощью всех трех методов и более прямым способом. Так, из данных ЯМР можно найти времена релаксации, которые в свою очередь зависят от характера молекулярных движений. Из спектра ЭПР можно при определенных условиях найти время вращательной корреляции зонда. Измеряя зависимость степени деполяризации флуоресценции от времени, можно получить данные о динамическом состоянии зонда, а не только оценить степень ограниченности его движения.
2.2 Спиновые метки, использующиеся при изучении текучести мембран
ЭПР тАФ это очень ценный метод изучения мембран. Обычно в качестве меток используются стабильные парамагнитные соединения, содержащие нитроксидный радикал. Неспаренный электрон при наложении сильного магнитного поля переходит с одного энергетического уровня на другой под действием микроволнового излучения. Метод очень чувствителен: обычно спектр регистрируется при концентрации спиновых меток около 10"*М в 50 мкл образца. Спектр ЭПР, как правило, представляют в виде первой производной от спектра поглощения.
В спектре нитроксидного радикала имеются три пика, отвечающие спин-спиновым взаимодействиям неспаренного электрона и ядра атома азота. И положение спектра, и расщепление, обусловленное спином ядра, зависят от ориентации молекулы относительно внешнего поля. Как мы уже говорили в предыдущем разделе, это означает, что характер спектра зависит от характера вращения молекулы. На рис. 5.3 приведены спектры для самых разных случаев тАФ от свободного вращения до полной неподвижности. Для того чтобы найти тк в предположении, что вращательное движение молекулы изотропно, можно использовать простое уравнение, в которое входит высота пиков. Этот подход наиболее применим для такой метки, как TEMPO.
Спиновые метки тАФ производные жирных кислот или фосфолипидов, тАФ конечно, не вращаются изотропно, и в этом случае для нахождения параметра упорядоченности S из величины расщепления между линиями спектра используется вторая простая формула. Предположив, что такие метки имеют форму жесткого стержня, можно из величины параметра S оценить максимальное отклонение зонда от нормали к поверхности мембраны.
Многие предположения, которые делаются при нахождении из спектров ЭПР времен вращательной корреляции или параметра S, снижают ценность этого метода для определения количественных характеристик молекул. Эти параметры тем не менее позволяют получить качественное представление о поведении мембраны. Результаты измерения степени упорядоченности спиновых меток, фиксированных в мембране на разной глубине, свидетельствуют об увеличении неупорядоченности в направлении от поверхности мембраны к ее центральной области. Качественно такая же картина получена с помощью 2Н-ЯМР. Во многих исследованиях проводилось сравнение текучести мембран, которую определяли по данным о величинах тк и S для спиновых меток, при различных возмущающих воздействиях.
2.3 Флуоресцентные зонды, используемые для измерения текучести мембран
Для измерения вращательной диффузии молекул давно используется метод деполяризации флуоресценции. Вращение некоторых зондов в мембранах часто сравнивают с их вращением в маслах с известной вязкостью, при этом пользуются понятием ВлмикровязкостьВ», которую измеряют в пуазах. Термин ВлмикровязкостьВ» означает, что зонд ВлчувствуетВ» величину вязкости только в своем непосредственном окружении, т. е. этот параметр не является макроскопическим. С точки зрения молекулярного движения подобные измерения не имеют строгого количественного смысла, но, как и в случае со спиновыми метками, полученные результаты позволяют создать ценную качественную картину.
В табл. 1 приведены структурные формулы некоторых зондов, используемых при измерении текучести мембран. Чаще всего применяют ДФГ, поскольку он с легкостью накапливается в мембранах, обладает интенсивной флуоресценцией, по-видимому, не связывается с белками и чувствителен к физическому состоянию мембран. Однако временные измерения свидетельствуют о некой гетерогенности неизвестной природы; кроме того, имеются разногласия по поводу ориентации зонда в бислое и характера его подвижности.
Рис. 4 иллюстрирует принципы, лежащие в основе применения флуоресценции и фосфоресценции для анализа вращения молекул. Молекула, поглотившая фотон, за время 10" 11 с переходит в возбужденное синглетное состояние Si. Термин ВлсинглетноеВ» указывает на то, что спин электрона при поглощении фотона не изменяется. Обычно возвращение в основное, невозбужденное состояние происходит за время - 10"8 с. Причинами такого перехода являются столкновение с соседними молекулами, диссипация энергии в виде тепла или испускание фотона. Характерное время перехода популяции молекул из синглетного возбужденного состояния в основное равно тт. Некоторые молекулы с большой вероятностью переходят из синглетного возбужденного состояния в триплетное, и этот переход сопровождается изменением спина электрона. Испускание фотона при переходе молекулы из этого состояния в основное называется фосфоресценцией. Время жизни молекулы в триплетном состоянии относительно велико, что связано с изменением спинового состояния электрона при испускании фотона.
Рассмотрим принцип метода деполяризации. Свет, поляризованный вдоль оси z, будет предпочтительно возбуждать молекулы, у которых дипольный момент перехода имеет такую же ориентацию. Вероятность возбуждения пропорциональна cos2 в, где в тАФ угол между дипольиым моментом перехода и вектором напряженности электрического поля. Такая же зависимость от cos2 в имеет место и для процесса испускания фотона, поэтому молекула, у которой дипольный момент перехода ориентирован вдоль оси z, будет испускать свет с такой же поляризацией.
Испускаемый свет анализируют с помощью поляризаторов, определяя интенсивность компоненты, параллельной и перпендикулярной направлению поляризации возбуждающего света.

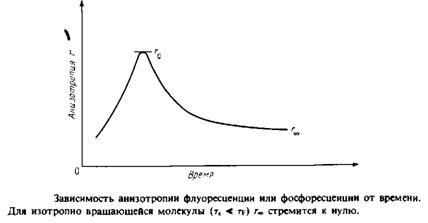
Анизотропия г связана с /, и IL следующим образом:
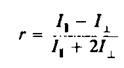
Если между моментами поглощения и испускания света молекула не вращается, то /, будет больше, чем 1В±, и г будет иметь максимальное значение 0.4. Если же молекулы, находясь в возбужденном состоянии, совершают интенсивные изотропные вращательные движения, то г будет равно нулю, поскольку в среднем молекулы к моменту испускания света будут ориентированы беспорядочно. При тк = tf величина г будет зависеть от характера движения. При этом т ~ 1 и ту ' отражают скорости вращения и испускания света.
Для того чтобы разграничить динамические эффекты и эффекты, связанные с ограничениями, налагаемыми на диапазон допустимых движений, определяют временную зависимость анизотропии r света, испускаемого молекулой после возбуждения. Значение г в данный момент времени отражает степень разу-порядочивания молекул относительно вектора поляризации за вре- ■ мя, прошедшее после поглощения возбуждающего импульса света. Спад r от максимального значения го задается выражением
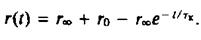
тк тАФ время вращательной корреляции, оно определяется скоростью затухания. Если при / оо все молекулы окажутся беспорядочно ориентированными, то л в пределе будет равно нулю. Однако если движение молекул ограничено, то их ориентация никогда не будет совершенно случайной. В такой ситуации гВ» не будет равно нулю, и с помощью этого параметра можно определить степень ограничения, которое налагается на подвижность зонда его окружением. Параметр упорядоченности определяется из этих величин так же, как в случае ЭПР или ЯМР:
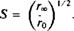
К сожалению, такие кинетические измерения проводятся редко, большинство экспериментов выполнено в стационарном режиме при непрерывном возбуждении и испускании. Значение г, полученное таким способом, носит усредненный характер и определяется как
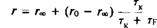
Рассмотрим следующие три случая.
1. Очень быстрое движение: 7"= гтАЮ, предельному значению.
2. Очень медленное движение или его отсутствие: г = го, максимальному значению.
3. Случаи, представляющие практический интерес '- 7 зависит как от скорости движений, так и от ограничений, налагаемых на них.
Без соответствующей корректировки определение микровязкости по результатам измерений 7 не будет сводиться к простым динамическим измерениям.
Вязкость бислоя весьма высока, поэтому время вращательной корреляции небольших флуоресцентных и ЭПР-зондов составляет 10~8тАФ10 с. В воде, имеющей вязкость 0,01 пуаз, молекулы такого размера вращались бы по крайней мере в 100 раз быстрее. Мембранные белки имеют значительно большие размеры, чем упомянутые метки, и поэтому вращаются гораздо медленнее. Чтобы метки, ВлпришитыеВ» к этим белкам, были чувствительны к их вращению, время жизни меток в возбужденном состоянии должно составлять порядка 10~3 с.
3. Вращение мембранных белков
Коэффициент вращательной диффузии мембранного белка, находящегося в плоскости бислоя, D., можно найти, представив белко
вую молекулу в виде цилиндра, который вращается вокрут одной оси. Пусть мембрана имеет вязкость г) и толщину h, а радиус цилиндра равен а. Тогда
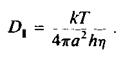
Часто наряду с фу применяется время вращательной релаксации ф, = 1/. Для белковой молекулы радиусом 25 А, находящейся в мембране толщиной 40 А и вязкостью 5 пуаз, величина ф, по оценкам составляет около 35 мкс. С количественной точки зрения это уравнение, описывающее вращение белка в бислое, не вполне строго, но зависимость времени вращательной релаксации от эффективного радиуса вращающейся белковой молекулы сомнений не вызывает. Это оказалось весьма полезным для исследования процессов агрегации белков внутри мембраны. Методы, применяемые для изучения вращения белков в бислое, должны быть способны регистрировать времена вращения от 10"5 до 10 ~3 с. Обычный метод измерения деполяризации флуоресценции в этом случае непригоден, поскольку время жизни молекул в возбужденном состоянии составляет около 10"8 с, и в таком временном масштабе молекулы белков представляются неподвижными. Успешно использовались три метода.
1. К исследуемому белку присоединяют зонд, время жизни которого в возбужденном триплетном состоянии достаточно велико. Если метка жестко связана с белком, то для регистрации вращения белка можно использовать измерение анизотропии фосфоресценции. Для таких измерений оказались пригодными производные эозина, поскольку время жизни эозина в триплетном состоянии составляет примерно 2 мс. В основе этого подхода лежат те же принципы, что и в основе метода деполяризации флуоресценции, но используется другая молекулярная модель движения, вызывающего деполяризацию. Эксперимент состоит в определении характерного времени затухания анизотропии фосфоресценции. Если система гетерогенна, могут возникнуть определенные трудности, связанные с количественным анализом экспоненциальной кривой затухания анизотропии. Проблемы возникают и в тех случаях, если метка может локально вращаться на поверхности мембранного белка или если у белковой молекулы имеются гибкие сегменты.
Те же метки могут использоваться и для анализа вращения белков с использованием временной зависимости дихроизма поглощения. В этом случае изменения в ориентации дипольного момента перехода регистрируются по поглощению света, поляризованного параллельно и перпендикулярно оси поляризации начального импульса, используемого для возбуждения молекул.
2. Известны случаи, когда сами молекулы белка содержат группы, переходящие при флеш-фотолизе в долгоживущее возбужденное состояние, параметры которого можно оценить с помощью дихроизма поглощения. В качестве примера можно привести родопсин и бактериородопсин, где используются возбужденное состояние связанного ретиналя и возбужденные состояния, наблюдающиеся при фотолизе комплексов цитохромтАФСО с использованием цитохром с-оксидазы и цитохрома Р450. Измерения можно проводить in situ или с очищенным белком, встроенным в фосфолипидные везикулы.
3. С помощью обычной ЭПР-спектроскопии не удается регистрировать вращения, характерная частота которых равна частоте вращения мембранных белков. Однако разработан специальный метод тАФ ЭПР с переносом насыщения, диапазон чувствительности которого очень широк тАФ от 10"7 до 10 ~J с. Этот метод применялся при изучении вращения нескольких мембранных белков с ковалентно пришитыми к ним спиновыми метками. Недостаток метода состоит в том, что в случае анизотропного молекулярного движения спектры с трудом поддаются интерпретации.
3.1 Примеры вращения белков
Внутримембранные белки характеризуются широким спектром времен вращательной релаксации. На одном конце временной шкалы находится родопсин, который, по-видимому, свободно вращается в мембране наружного сегмента палочки сетчатки, а на другом тАФ бактериородописин, который образует в пурпурной мембране упорядоченную кристаллическую решетку и неподвижен. Для нескольких очищенных белков, встроенных в фосфолипидные везикулы, зависит от концентрации. Это позволяет предположить, что при уменьшении соотношения липид/белок происходит самоагрегация этих белков. Такая картина характерна для бактериородопсина, цитохром с-оксидазы, белка полосы 3, Са2+ -АТРазы и цитохрома Р450. Возможно, именно с самоагрегацией связана гетерогенность, наблюдаемая, в частности, для белка полосы 3 в тенях эритроцитов и Са2+ -АТРазы из саркоплазматического ретикулума. Вообще говоря, мембранные белки, по-видимому, вращаются в плоскости мембраны и скорость вращения согласуется с величиной, ожидаемой исходя из простой гидродинамической модели.
Дополнение. Вращение белка полосы 3 и цитохрома Р450: выявление межмолекулярных взаимодействий
Из двух указанных белков тАФ белка полосы 3 и цитохрома Р450 тАФ наибольший интерес представляет первый, поскольку по имеющимся биохимическим данным можно предположить, что этот анионный переносчик связан со спектрино-актиновой сетью цитоскелета. Обнаружение того факта, что значительная часть белковых молекул способна к быстрому вращению, послужило основанием для создания моделей, согласно которым белок полосы 3 иммобилизован не полностью или образует со спектрином временную связь. Однако ситуация осложнялась тем, что при лизисе клеток, необходимом для получения теней эритроцитов, комплекс с цитоскелетом может разрушаться. В интактной клетке белок полосы 3 совершает только медленные вращательные движения с характерным временем 0,1 тАФ 1 мс. Это больше согласуется с отсутствием поступательного движения белка полосы 3, хотя физическая причина такого ограничения подвижности не установлена.
Цитохром Р450 акцептирует электроны от цитохром Р450-редук-тазы в электронтранспортной цепи микросом. Многих ученых интересовал вопрос: образуют ли эти молекулы долгоживущий комплекс в мембране или их взаимодействие сводится к простым столкновениям в результате диффузии? При низком соотношении липид/белок цитохром Р450 агрегирует и вращение его замедляется. Однако в присутствии стехиометрических количеств редуктазы цитохром Р450 в сходных условиях остается мобильным. Это свидетельствует о взаимодействии двух указанных белков и образовании комплекса между ними со стехиометрией 1:1, которое препятствует агрегации Р450.
4. Латеральная диффузия липидов и белков в мембранах
Способность мембранных компонентов к латеральной диффузии тАФ это одно из очевидных условий, принятых в жидкостно-мозаичной модели. Для измерения коэффициента латеральной диффузии применялось несколько методов. Рассмотрим три из них.

1.Осуществляют слияние клеток, несущих на своей поверхности различные маркеры, с образованием гетерокарионов. После слияния оценивают скорость перераспределения поверхностных маркеров с помощью флуоресцентной микроскопии и с использованием меченных различными флуоресцентными метками антител против специфических поверхностных антигенов.
2.Осуществляют перераспределение мембранных белков с помощью электрофореза in situ. При внесении клеток в электрическое поле белки концентрируются в одной части мембраны, и коэффициент латеральной диффузии определяют по данным о скорости их перераспределения после отключения электрического поля. За перераспределением белков можно наблюдать с помощью электронной микроскопии или флуоресцентных методов.
3.Чаще всего используется метод, основанный на восстановлении способности белков к флуоресценции после фотообесцвечивания. Суть метода представлена на рис. 5.6. С помощью мощного лазерного луча обесцвечивают пятно диаметром - 1 мкм на равномерно меченной с помощью флуоресцентной метки мембране. Далее исследуют кинетику разгорания флуоресценции этого участка и по скорости восстановления флуоресценции прямо оценивают скорость латеральной диффузии флуоресцентных зондов на обесцвеченный участок из областей мембраны, прилегающих к нему. С помощью этого метода можно исследовать амфифильные флуоресцентные зонды, меченые фосфолипиды и белки, несущие флуоресцентные метки. Структурные формулы некоторых наиболее часто используемых зондов приведены в табл. 5.1. Можно ожидать, что применение видеотехники для изучения перераспределения флуоресцентных молекул в мембране расширит рамки применения этого метода. Использование двух первых методов сопровождается значительными нарушениями клеток или мембран. Метод FRAP является более щадящим. Опасения, связанные с возможностью повреждений клеток лазерным лучом, были сняты. Метод можно также применять для исследования модельных мембранных бислоев и монослоев, а также интактных клеток или фрагментов биомембран. Фокусируя лазерный луч диаметром ~ 1 мкм в разных точках, можно наблюдать за датеральной диффузией мембранных компонентов в различных участках мембраны.
Коэффициенты поступательной диффузии, которые можно определить с помощью этого метода, варьируют от Ю-7 до 10 ~12 см2/с. Коэффициент диффузии 10 "12 см2/с в рамках этого подхода соответствует отсутствию движения. Значение D = 10 "8 см2/с, характерное для липидов в биомембранах, отвечает диффузии на расстояние около 2 мкм за 1 с.
4.1 Модели, описывающие латеральную диффузию
Для описания поступательной диффузии мембранных белков часто применяется гидродинамическая модель Саффмана и Дельбрюка. В этой модели рассматривается диффузия белка в тонком вязком слое; при этом считается, что растворитель является сплошной средой, т. е. молекулы растворителя малы по сравнению с диффундирующими молекулами. В рамках этой модели выполняется следующее соотношение:
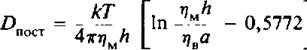
где т)м и 1), тАФ вязкости мембранной и водной фаз соответственно, а тАФ радиус белковой молекулы, имеющей форму цилиндра, h тАФ толщина мембраны. Из модели следует, что скорость поступательной диффузии слабо зависит от размера молекулы, что подтверждается полученными к настоящему времени экспериментальными данными.

Эта гидродинамическая модель не позволяет описывать диффузию липидных зондов, поскольку к ним неприменимо допущение о том, что белок диффундирует в сплошной среде. Для объяснения поведения липидов применялись различные модели, основанные на концепции свободного объема. В рамках этих моделей диффузия рассматривается как процесс движения молекул в полостях, образующихся вследствие спонтанных флуктуации, при этом определяющей характеристикой мембран является отношение площади, приходящейся на одну молекулу липида, к минимальной Удельной площади, соответствующей максимально плотной упаковке липидов, т. е. плотность упаковки липидов. Как мы уже отмечали, скорость вращения флуоресцентных зондов зависит от плотности упаковки липидов в мембране. Применимость этой модели к описанию вращательной или поступательной диффузии липидов строго не доказана, поскольку изначально она была построена для неа
Вместе с этим смотрят:
Анатомическое строение растений
Анатомия и физиология заднего мозга. Строение и механизм кровообращения
Анатомия человека
Анатомо-физологические механизмы безопасности и защиты человека от негативного воздействия
Бiологiчне рiзноманiття людських рас