Генно-инженерная технология
Продовольственная проблема является одной из важнейших проблем человечества. Особенно остро она стоит в развивающихся странах, где происходит стремительный рост населения до 100 млн. человек в год, и очень слабо развито сельское хозяйство. Постоянные поставки гуманитарной помощи со стороны развитых стран и международных организаций являются явно недостаточными для борьбы с голодом.
По прогнозам ЮНЕСКО, к 2050 г. Численность населения в мире приблизится к 10 млрд. человек, что потребует резкого увеличения объемов производства продуктов питания и других товаров широкого потребления. Несмотря на то, что за последние 40 лет производство сельскохозяйственной продукции выросло более, чем в 2 раза, дальнейший его рост представляется маловероятным. В течение последних 20 лет человечество потеряло свыше 15% плодородного почвенного слоя. Большая часть пригодных к возделыванию земель уже вовлечена в сельскохозяйственное производство.
Каждую неделю население нашей планеты увеличивается на 1.2 млн. человек, при этом темпы производства продукции все больше отстают от темпов роста населения. Уже сейчас дефицит пищевых продуктов в мире превышает 60 млн. тонн, а число людей страдающих от недостаточного питания, выросло на 25 млн. лишь за период с 2002 по 2003 гг., а общая цифра голодающих приближается к 1 млрд. человек. Таким образом, современная стратегия производства пищевых продуктов должна быть направлена на поиск выхода из продовольственного кризиса в кратчайшие сроки. Возникла необходимость в применении принципиально новых подходов к созданию высокопродуктивных агросистем обеспечивающих значительное повышение урожайности сельскохозяйственных культур и продуктивности скота.
Одним из способов решения поставленной задачи, как утверждают некоторые ученые, является применение новейших способов селекции. Этому способствуют огромные возможности, появившиеся в результате революционных достижений в области генетики и биотехнологии.
Новейшая биотехнология - это наука о генно-инженерных и клеточных методах и технологиях создания и использования генетически трансформированных биологических объектов для интенсификации производства или получения новых видов продуктов различного назначения.
Основная цель современной биотехнологии тАУ получений трансгенных организмов методами клеточной и генетической инженерии. Отличие генетической инженерии от традиционной селекции состоит в том, что при селекции перенос генов осуществляется только между близкородственными растениями, генная же инженерия позволяет перенести в растение гены из любого организма.
Генетическая инженерия известна довольно давно, ее рождение условно относят к 1972 г., когда в лаборатории Бэрга впервые была синтезированная рекомбинантная молекула ДНК. Существует несколько определений раскрывающих понятие генной инженерии. В федеральном законе Вл О государственном регулировании в области генно-инженерной деятельности В» закреплено, что Влгенная инженерия - совокупность методов и технологий, в том числе технологий получений рекомбинантных рибонуклеиновых и дезоксирибонуклеиновых кислот, по выделению генов из организма, осуществлению манипуляций с генами и введению их в другие организмыВ».
Всего выделяют 4 группы метода генной инженерии:
- методы получения рекомбинантных ДНК и РНК;
- методы выделения генов из организмов;
- методы создания искусственных генетических программ
- методы введения трансгенов в микроорганизмы;
Каждая группа методов в настоящее время активно развивается и совершенствуется. Использования методов генной инженерии приводит к созданию генетически модифицированных организмов. В директиве 2001/18/ЕС Европейского Парламента и Совета определенно что Вл генетически модифицированный микроорганизм означает организм, за исключением людей, генетический материал которого изменен способом, который не может быть достигнут естественным путем скрещивания или рекомбинацииВ»
Можно выделить следующие основные характеристики генетически модифицированного организма:
- это любой биологический организм способный к воспроизводству или передаче генетического материала;
- содержит искусственную генетическую программу;
- получен, с применением методов генной инженерии;
В работе используется понятие Влгенетически модифицированные продукты (организмы)В», под которыми понимаются продукты питания содержащие результаты генно-инженерной деятельности.
1. Технология ГМО
1.1 Технология получение ГМО
Процедура получения ГМО включает в себя несколько основных этапов:
тАв Выделение и идентификация отдельных генов (соответствующих фрагментов ДНК или РНК), которые собираются перенести другим организмам. Для этого из организмов, обладающих такими генами, с помощью специальных химических методов выделяют нуклеиновые кислоты. Их разрезают на отдельные фрагменты, используя наборы ферментов-рестриктаз. Наибольшее значение имеют рестриктазы, способные разрезать нуклеиновые кислоты с образованием, так называемых липких (комплементарных) концов. Образующиеся фрагменты имеют короткие однонитчатые концы, состоящие из нескольких нуклеотидов. Если объединить в одной пробирке фрагменты ДНК любого происхождения (н-р, фрагменты плазмид бактерий и фрагменты животной или растительной ДНК), полученные с помощью одной и той же рестриктазы, дающей липкие концы, и добавить фермент тАУ лигазу, то эти фрагменты соединятся между собой. В результате получится химерная (рекомбинантная) ДНК, которая может содержать фрагменты ДНК, выделенные из различных организмов или синтезированную искусственно. Описанная технология позволяет создавать на основе плазмид (или других типов векторов) сложные генетические конструкции, предназначенные для переноса в клетки других организмов.
тАв Клонирование (размножение) переносимого гена. Чтобы размножить созданные в пробирке немногочисленные химерные молекулы ДНК, векторы со встроенными в них фрагментами необходимо перенести в реципиентные клетки. Плазмидные векторы обычно вводятся в реципиентные клетки методом генетической трансформации. Особенно широкое распространение для клонирования векторных ДНК получила трансформация клеток кишечной палочки (E. сoli), основанная на совместной инкубации ВлкомпетентныхВ» клеток бактерий (клетки способные к трансформации) и ДНК. В результате трансформации ДНК ВлпоглощаетсяВ» бактериальными клетками и автономно размножается в их цитоплазме (внутренняя среда клетки).
На селективной среде ведут отбор трансформированных бактериальных клеток, несущих какой-либо селективный маркер, который уже был на векторе или должен был появиться в процессе образования рекомбинантной молекулы.
Если, например, вектор содержал ген устойчивости к антибиотику ампицилину, то в селективную среду, добавляют этот антибиотик, и все выжившие клетки будут содержать данный вектор. Для того, чтобы выяснить, несут ли трансформированные клетки рекомбинантную ДНК, из клеток выделяют векторную плазмиду и подвергают её электрофорезу. Метод электрофореза основан, на принципе перемещения веществ в электрическом поле от одного полюса к другому со скоростью, зависящей от их размеров. С помощью этой простой техники можно в агарозном геле разделить, идентифицировать и очистить фрагменты векторной ДНК различной молекулярной массы.
тАв Перенос гена (или трансгенной конструкции) внутрь клетки и встраивание его в ДНК реципиентного организма. Основной способ переноса генов (генных конструкций) из клеток организматАУдонора в клетки организматАУреципиента - это процесс трансформации. Трансформация включает в себя несколько основных этапов и требует соблюдения ряда условий: наличия трансформирующей ДНК; ВлкомпетентныхВ» клеток; интеграции донорской (трансформирующей) ДНК в ДНК реципиента и экспрессии (работы) перенесённых генов. Существуют различные методы трансформации: путем гибридизации соматических клеток; инкубации реципиентных клеток с чужеродным генетическим материалом; микроинъекцией генетического материала в ядра клеток животных и др. Их применение, прежде всего, зависит от биологических особенностей организма тАУ реципиента. Например, для трансформации клеток растений используют два основных метода (рис. 1).
1) Метод биологической баллистики. В этом случае, на мельчайшие частицы вольфрама или золота напыляется ДНК, содержащая ВлцелевойВ» ген. Затем эти частички с ДНК помещают в так называемую генную ВлпушкуВ». В результате ВлвыстрелаВ» они с огромной скоростью ВлбомбардируютВ» клетки растений, проникая в их цитоплазму и ядра. Некоторые из этих клеток встраивают ВлцелевойВ» ген в свою ДНК. Из каждой такой клетки может быть регенерировано новое трансгенное растение.
2)Трансформация растения с помощью, так называемой, Ti тАУ плазмиды, несущей ВлцелевойВ» ген, который доставляется в клетки с помощью почвенной бактерии (Agrobacterium tumifaciens). TiтАУплазмида - это кольцевая молекула ДНК содержащаяся в клетках Agrobacterium tumifaciens, вызывающей образование опухолей у растений при их заражении этой бактерией. При заражении бактериями растений, небольшой фрагмент TiтАУплазмиды встраивается в геном растительных клеток, вызывает нарушение гормонального баланса и переход к неконтролируемому делению и росту, что и приводит к образованию опухоли.
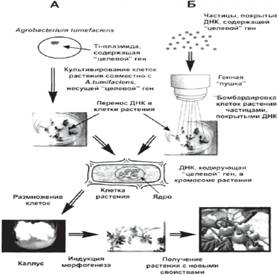
Рис.1 Методы получения ГМО
ВлЦелевойВ» ген, способный изменять то или иное свойство растения, встраивается генно-инженерными методами в TiтАУплазмиду, которая, затем переносится в агробактерию. В процессе совместного культивирования агробактерии и культуры клеток растения тАУ хозяина TiтАУплазмида попадает в клетки растений, а ВлцелевойВ» ген с дополнительными фрагментами ДНК встраивается в растительный геном. Каждая такая клетка может быть, затем регенерирована в целое трансгенное растение, которое будет содержать генетическую информацию из двух или нескольких различных организмов. Это метод применяется для трансформации двудольных растений.
Однако этот метод "работает" не на всех растениях: агробактерия, например, не заражает такие важные пищевые растения, как рис, пшеница, кукуруза. Поэтому разработаны и другие способы. Например, можно ферментами растворить толстую клеточную оболочку растительной клетки, мешающую прямому проникновению чужой ДНК, и поместить такие очищенные клетки в раствор, содержащий ДНК и какое-либо химическое вещество, способствующее ее проникновению в клетку (чаще всего применяется полиэтиленгликоль). Иногда в мембране клеток проделывают микроотверстия короткими импульсами высокого напряжения, а через отверстия в клетку могут пройти отрезки ДНК. Иногда применяют даже впрыскивание ДНК в клетку микрошприцем под контролем микроскопах [5].
тАв Выявление трансгенных клеток (организмов). Процесс переноса и включения в генетический материал клеток растений чужеродной ДНК происходит с достаточно небольшой частотой, в лучшем случае трансформированной оказывается 1 клетка на 1000. Поэтому необходимо каким-то образом отделить такие клетки от остальных создать для их деления и развития наиболее благоприятные условия. В этом случае вместе с ВлцелевымВ» геном (н-р, устойчивости к гербицидам, вирусам и насекомым тАУ вредителям) вводят и второй, так называемый селективный ген. Чаще всего для этого используют гены устойчивости к антибиотикам. Если после введения чужеродной ДНК поместить клетки на питательную среду с антибиотиком, то на ней способны будут расти только трансформированные клетки [6].
1.2 Методы идентификации трансгенов
Увеличение использования ГМО и их компонентов в производстве продуктов питания, сельскохозяйственных кормов и фармацевтических препаратов делает всё более актуальным вопрос разработки эффективных методов идентификации трансгенной ДНК. В настоящее время наиболее разработаны и широко применяются методы обнаружения фрагментов чужеродной ДНК, основанные на использовании различных видов ПЦР (полимеразная цепная реакция).
ПЦР тАУ это метод, который позволяет проверить генетический материал, выделенный из исследуемого образца, на наличие в его составе участка чужеродной или измененной ДНК и используется для получения множества копий непротяженных участков ДНК, специфичных для каждого конкретного белка, а также исследуемого генетически обусловленного признака.
В основе метода ПЦР лежит способность хорошо известных в молекулярной биологии ферментов, ДНК-полимераз, осуществлять направленный синтез второй, т.е. комплементарной (спаренной) цепи ДНК, по имеющейся матрице одноцепочечной ДНК, наращивая небольшую олигонуклеотидную затравку (праймер), комплементарную участку этой матрицы, до размеров в несколько тысяч или даже десятков тысяч звеньев. Повышая температуру, можно добиться остановки реакции и последующей денатурации полученной ДНК, т.е. разделения цепей полученной в ходе реакции двуцепочечной ДНК. Если в реакционной смеси присутствует избыток праймера, то, значительно снизив температуру, чтобы праймер мог вновь связаться с тем же самым комплементарным участком ДНК, и добавив новую порцию фермента, можно вновь установить температуру, необходимую для реакции полимеризации, и, таким образом, проведя реакцию еще раз, увеличить количество ранее полученного продукта. Многократное, или как говорят, циклическое повторение этой процедуры позволяет наработать значительное количество копий участка ДНК, начинающегося с данного праймера. Один цикл ПЦР осуществляется за 1тАУ2 мин, так что в течение нескольких часов можно получить 100 млрд. копий (рис. 2).
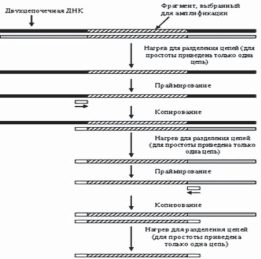
Рисунок 2. Метод ПЦР
Кроме описанного метода ПЦР, для выявления трансгенных фрагментов ДНК используется целый ряд других методов:
тАв Методы обнаружения ГМО, основанные на исследовании трансгенных белков. Процесс создания ГМ растений основан на введении в клетки организма-реципиента чужеродных генных конструкций, обеспечивающих синтез новых белков. Появляющиеся в растении в результате генетической модификации белки могут служить маркерами генетической модификации. К этой группе методов относят различные иммунологические методики, основанные на использовании антител (особые белки, вырабатываемые иммунной системой организма в ответ на проникновение чужеродных организмов или их фрагментов), специфичных к маркерным белкам, используемым при создании ГМО
тАв Хроматографические методы. Используются в том случае, когда генетическая модификация приводит к появлению и/или увеличению содержания специфических жирных кислот или триглицеридов. Использование подобного метода диагностики показана для растительного масла, полученного из ГМ-рапса.
тАв Методы спектроскопии. В ряде случаев генетические модификации могут приводить к изменению структуры растительных волокон при отсутствии видимых изменений
в белковом или жирно кислотном составе. Подобный тип изменений наблюдается, например, у трансгенной сои линии 40-3-2 (Roundup Ready Soy).
тАв Технология ДНК-чипов. ДНК- чипы тАУ это наборы из большого числа олигонуклеотидов на миниатюрных твердых подложках, предназначенные для анализа последовательности ДНК. Метод основан на том, что с помощью фотолитографии на небольшой поверхности размещают огромное число олигонуклеотидов (одноцепочечные фрагменты ДНК). Их число, а следовательно, и количество различных нуклеотидных последовательностей может превышать 1 млн. на 1 см2, их длина варьирует от 9-10 до 1000нуклеотидов. После проведения ПЦР, полученные продукты реакции могут быть автоматически проанализированы методом гибридизации с меченными олигонуклеотидами на ДНК-чипах, что значительно ускоряет процесс идентификации трансгенной ДНК.
2. Экономика ГМО
2.1 Состояние и перспективны развития рынка генетически модифицированных товаров в мире
Генетическая инженерия имеет яркую историю благодаря тому общественному резонансу, который она вызвала с самых первых шагов. Начало этим событиям положило послание участников Гордоновской конференции (1973 г.) президиуму академии наук США, в котором говорилось о возможной опасности технологий рекомбинантных ДНК для здоровья человека. Возможные блага генетической инженерии признавались с самого начала, но разногласия по данной проблеме не затихли и сейчас.
Несмотря на отчаянную оппозицию по отношению к трансгенным организмам, новые сорта продуктов быстро завоевывают популярность в среде производителей. В период с 1996 по 2007 гг. площади, засеянные трансгенными сортами продовольственных культур увеличились в 70 раз (до 114.3 млн. га).
В первые устойчивый перенос чужеродного гена был продемонстрирован на растениях табака в 1983 г. Это было первое генетически модифицированное растение. Первые полевые опыты были проведены в США и Франции в 1987 г. В 1994 году в США было получено первое разрешение на коммерческое производство трансгенного сорта томатов.
В дальнейшем наблюдается интенсивное внедрение генетически модифицированных растений в практику сельскохозяйственного производства (табл.1).
| Год | Объем площадей | Процент приращения к предыдущему году (%) |
| 1997 | 11 | - |
| 1998 | 27.8 | 60 |
| 1999 | 39.9 | 43.5 |
| 2000 | 44.2 | 12 |
| 2001 | 52.6 | 20 |
| 2002 | 58.7 | 12 |
| 2003 | 67.7 | 12 |
| 2004 | 81.0 | 20 |
| 2005 | 90.0 | 11 |
| 2006 | 102.1 | 13 |
Следует отметить, что если с 1996 по 1999 гг. прирост посевных площадей под трансгенным культурам составлял ежегодно более 40%, то после 2000 г. он не превышал 20%.
В 2000 году рынок генетически модифицированных продуктов составлял 3.0 млрд. долл. США, в 2001 г. тАУ 3.8 млрд. долларов. В 2002 он увеличился до 4.25 млрд. долларов, а в 2005г. тАУ 5.25 млрд. долларов.
В 2007 г., число стран, выращивающих генетически модифицированные культуры, увеличилось до 23. Более 90 % всех посевных площадей под трансгенные культуры приходится на пяти странах: США, Аргентина, Канада, Бразилия, Китай (табл. 2)
Площади возделывания трансгенных культур в странах лидерах производство ГМО (млн. га).
| Страна | 2001г. | 2002г. | 2003г. | 2004г. | 2005г. | 2006г. | 2007г. |
| США | 35.7 | 39.0 | 42.8 | 47.6 | 49.8 | 54.6 | 57.7 |
| Аргентина | 10.0 | 13.5 | 13.9 | 16.2 | 17.1 | 18.0 | 19.1 |
| Канада | 3.2 | 3.5 | 4.4 | 5.4 | 5.8 | 6.1 | 7.0 |
| Бразилия | 1.6 | 2.0 | 3.0 | 5.0 | 9.4 | 11.5 | 15.0 |
| Китай | 1.5 | 2.1 | 2.8 | 3.7 | 3.3 | 3.5 | 3.8 |
Основными видами трансгенных культур, возделываемых в промышленных объемах, являются соя, кукуруза, хлопчатник, рапс, а также папайя и тыквенные культуры (таблица 3).
С 1996 г. по 2006г. в ЕС для употребления в пищу человеку одобрены 20 линий ГМ тАУ культур: 1 линия сои ВлМонсантоВ»; 7 линий рапса ВлБайер кропсайнесВ», ВлМонсантоВ», 10 линий кукурузы ВлБайер КропсайнесВ», ВлМонсантоВ», ВлСингентаВ», ВлДюпонВ»; 2 линии хлопчатника ВлМонсантоВ», и 1 микроорганизм от компании F. Hoffman La Roche. На корм скоту в ЕС разрешено использовать 11 линий ГМ тАУ культур: 1 линию сои ВлМонсантоВ»; 3 линии рапса ВлБайер КропсайнесВ», ВлМонсантоВ»; 7 линий кукурузы ВлБайер КропсайнесВ», ВлМонсантоВ», ВлСингентаВ», ВлДюпонВ», ВлДоу АгросайенсисВ».
С 1994 г. по 2006г. в США для употребления в пищу человеку одобрены 114 линий ГМ тАУ культур [4].
Площади возделывания трансгенных культур в мире (млн. га)
| Культура | 2003г | 2004г | 2005г | 2006г |
| Соя | 41.4 | 48.4 | 54.5 | 58.6 |
| Кукуруза | 15.5 | 19.3 | 24.0 | 25.2 |
| Хлопчатник | 7.2 | 9.0 | 11.0 | 13.4 |
| Рапс | 3.6 | 4.3 | 5.0 | 4.8 |
| Кабачки | < 0.1 | < 0.1 | - | - |
| Папайя | <0.1 | <0.1 | - | - |
| Картофель | - | | - | - |
В Китае доминантной трансгенной культурой является хлопчатник; в Канаде тАУ рапс. Сегодня доминирующими производителями трансгенного фуражного и продовольственного зерна являются только США и Аргентина.
По данным на 2007 год все возделыванные трансгенные культуры можно разделить по видам генетических модификаций:
- Устойчивость к гербицидам(69%);
- Устойчивость к насекомым(19%);
-Устойчивость к гербицидам и насекомым(12%);
-Устойчивость к вирусам и др.(<1%);
Самым важным аспектом рынка продуктов трансгенного растениеводства является негативное отношение общественности к генетически модифицированным продуктам. В настоящее время произошло разделение рынка продовольственного сырья на генетически модифицированные культуры и ВлобычныеВ» генетически не модифицированные. Инициатором разделения явились японские импортеры.
Другим серьезным вызовом трансгенным продуктам является рынок натуральных экологически безопасных продуктов питания или, как их принято называть в англоязычных странах, органическая пища (Organic food). В США рынок генетически модифицированных продуктов за последние 10 лет демонстрировал ежегодный прирост 20 тАУ 25% [2].
2.2 Развитие ГМО в России
На Российском рынке ГМ-продукция появилась в 90-е годы. На 01.01.08 г. в Российской Федерации прошли полный цикл всех необходимых исследований и разрешены для использования в пищевой промышленности и реализации населению 16 видов продовольственного сырья (7 линий кукурузы, 3 линии сои, 4 линии картофеля, линия риса и сахарной свеклы) из генетически модифицированных источников, 5 видов генетически модифицированных микроорганизмов. [16]
Вроде бы разрешенных сортов немного, но добавляются они во многие продукты. ГМ-компоненты встречаются и в хлебобулочных изделиях, и в мясных, и в молочных продуктах. Много их и в детском питании, особенно для самых маленьких. Наиболее распространенной добавкой является ГМ-соя, устойчивая к гербициду раундапу (линия 40.3.2).
Комиссия Государственной экологической экспертизы по оценке безопасности ГМ-культур, работающая в рамках закона РФ ВлОб экологической экспертизеВ», не признала ни одну из представленных для утверждения линий безопасной. Членами этой комиссии являются представители трех основных российских академий: РАН, РАМН и РАСХН. Благодаря этому в России выращивание ГМ-культур официально запрещено, а вот импорт ГМ-продуктов почему-то разрешен. Сейчас в стране много продуктов, которые содержат ГМ-компоненты, но все они без соответствующих маркировок, несмотря на подписанное В.В.Путиным в конце 2005г. ВлДополнение тАжВ» к закону о защите прав потребителей об обязательной маркировке ГМ-компонентов. Проводимая проверка Институтом питания РАМН не соответствовала Методическим Указаниям по проверке ГМО, подписанным Г.Г.Онищенко, а в некоторых случаях полученные данные полностью расходились с выводам. Так, при экспериментальной проверке на крысах сортов американского ГМ-картофеля Институтом питания у животных наблюдались серьезные морфологические изменения в печени, почках, толстой кишке; понижение гемоглобина; усиление диуреза; изменение массы сердца и предстательной железы. В научной литературе появились статьи о взаимосвязи ГМО с онкологий. Возможно, что увеличение в последнее время в России числа онкологических заболеваний желудочно-кишечного тракта, особенно прямой кишки (Медицинское информационное агентство, 2003), связано с использованием ГМ-продуктов.
Действие ГМ-продуктов на человека совершенно не изучено, последствия непредсказуемы. В нашей стране по непонятным причинам практически не проводятся научные и клинические исследования влияния ГМО на животных и человека. Попытки провести такие исследования наталкиваются на огромное сопротивление.
Проведенная элементарная проверка влияния ГМ-сои, устойчивой к гербициду раундапу (линия 40.3.2), на потомство лабораторных крыс показала повышенную смертность крысят первого поколения, недоразвитость выживших крысят, патологические изменения в органах и отсутствие второго поколения (Ермакова, 2006, Ermakova, 2006, 2007).
Несмотря на протесты со стороны потребителей Роспотребнадзор в 2008г перерегистрировал четыре ГМ-культуры (три сорта сои и один сорт кукурузы), срок действия сертификатов на которые истек в конце 2007 года.
К счастью есть и позитивные сдвиги. Так, ряд городов России объявил себя зонами, свободных от ГМО. С 1 апреля в стране введена обязательная маркировка продуктов, содержащих более 0,9% ГМО от ингредиента. В Москве и других городах России организованы лаборатории для населения страны по проверке семян и продуктов питания на наличие ГМ-компонентов. [3].
2.3 Возникновение и смысл термина Влзоны свободные от ГМОВ»
Официально Влзона, свободная от ГМОВ» впервые прозвучало в 1998 г. в заявлении британского отделения Партии природного закона. 28 сентября 1998г. партия призвала власти графств Великобритании к созданию ЗСГМО. Это понятие включало в себя запрет на выращивание ГМ тАУ
Вместе с этим смотрят:
Анатомическое строение растений
Анатомия и физиология заднего мозга. Строение и механизм кровообращения
Анатомо-физологические механизмы безопасности и защиты человека от негативного воздействия
Бiологiчне рiзноманiття людських рас
Бiологiя iндивiдуального розвитку