Получение ферментных препаратов выращенных глубинным способом
Производство ферментных препаратов занимает одно из ведущих мест в современной биотехнологии и относится к отраслям, объём продукции которых постоянно растёт, а сфера применения неуклонно расширяется. Такое быстрое развитие связано с тем, что ферменты являются высокоактивными, нетоксичными биокатализаторами белкового происхождения, которые широко распространены в природе, без них невозможны осуществление многих биохимических процессов и жизнь в целом.
Познание роли ферментов для всего живого на Земле послужило основой для становления и развития технологии ферментных препаратов как науки и для создания промышленного производства наиболее широко используемых ферментных препаратов. Применение этих препаратов помогло существенно изменить, интенсифицировать и усовершенствовать многие существующие технологии или даже создать принципиально новые высокоэффективные процессы. Применение ферментных препаратов различной степени очистки позволило не только улучшить показатели и выходы в различных биотехнологических процессах, но позволило усовершенствовать кормопроизводство, повысить усвояемость кормов, сделать более целенаправленным и эффективным действие синтетических моющих средств, улучшить качество косметических препаратов, создать целый арсенал специфических, чувствительных и точных аналитических методов, наладить производство лекарственных и профилактических средств для медицинской промышленности и т. д.
Большим и неоспоримым достоинством ферментов перед химическими катализаторами является то, что они действуют при нормальном давлении, при температурах от 20 до 70 В°С и рН в диапазоне от 4 до 9 и имеют в большинстве случаев исключительно высокую субстратную специфичность, что позволяет в сложной смеси биополимеров направленно воздействовать только на определенные соединения. Все это свидетельствует о том, что производство ферментных препаратов является одним из перспективных направлений в биотехнологии, которое будет и далее интенсивно развиваться и расширяться.
Традиционно ферментативные препараты получают либо при поверхностном, либо при глубинном способе культивирования продуцента. Глубинный способ ведения процесса имеет ряд существенных преимуществ перед поверхностным культивированием, т. к. позволяет существенно автоматизировать процесс, в ряде случаев значительно сократить объёмы отходов, проводить процесс непрерывно, сократить в 2 тАУ 4 раза площади цехов, а также позволяет использовать анаэробных продуцентов.
По современной классификации все ферменты делятся на шесть основных классов по типу катализируемой реакции: 1) оксидоредуктазы; 2) трансферазы; 3) гидролазы; 4) лиазы; 5) изомеразы и 6) лигазы (синтетазы). Большинство промышленно важных ферментов, потребность в которых определяется десятками тысяч тонн, относятся к третьему классу тАУ гидролазам. Подавляющее количество препаратов, выпускаемых различными фирмами мира, является комплексными, содержащими помимо основного фермента еще значительное количество сопутствующих ферментов и белков. Поэтому в технологии ферментов препараты чаще классифицируют по основному компоненту в смеси ферментов, присутствующих в данном препарате: амилолитические, протеолитические, липолитические и т. д.
В нашей стране существует определенная система названия ферментных препаратов, в которой учитываются основной фермент, источник получения и степень очистки. Наименование каждого препарата включает сокращенное название основного фермента, затем добавляется видовое название продуцента и заканчивается название препарата суффиксом ВлинВ». Например, амилолитические препараты, получаемые из культур Aspergillusoryzae и Bacillussubtilis называются соответственно амил-ориз-ин (амилоризин) и амил-о-субтил-ин (амилосубтилин). Далее ставится индекс, в котором обозначены способ производства и степень очистки фермента от балластных веществ. При глубинном способе культивирования после названия ставится буква Г, а при поверхностном тАУ П. Если это неочищенная культура продуцента, то далее следует буква х. Между буквами П, Г и х может стоять цифра, обозначающая степень чистоты препарата. Индекс 2 обозначает жидкий неочищенный концентрат исходной культуры; 3 тАУ сухой ферментный препарат, полученный высушиванием распылением неочищенного раствора фермента (экстракт из поверхностной культуры или культуральной жидкости); 10 тАУ сухие препараты, полученные осаждением ферментов органическими растворителями или методом высаливания. Индексы 15, 18, 20 обозначают препараты, частично освобожденные не только от балластных веществ, но и от сопутствующих ферментов. Номенклатура препаратов с индексом выше 20 не используется, так как в этих случаях речь идет о высокоочищенных и даже гомогенных ферментных препаратах, которые именуются в классификации ферментов.
Характеристика активности ферментных препаратов
Ферменты являются веществами белковой природы, поэтому в смеси с другими белками определить их количество невозможно. Наличие определенного фермента в данном препарате может быть установлено по результатам той реакции, которую катализирует фермент, т. е. по количеству образовавшихся продуктов реакции или уменьшению исходного субстрата. В количественном выражении условно активность фермента определяется по начальной скорости ферментативной реакции. Начальная скорость зависит от многих факторов, наиболее важные из них тАУ температура, концентрация субстрата, рН реакционной смеси и время от начала реакции. Поэтому по предложению Комиссии по ферментам Международного биохимического союза были приняты правила определения активностей препаратов и их выражения в единицах активности.
Стандартная единица активности. Эта величина для любого фермента обозначает то количество его, которое катализирует превращение 1 мкмоль субстрата в 1 мин при заданных регламентированных условиях. На русском и немецком языках эта единица обозначается буквой Е, на английском, французском, итальянском и испанском тАУ U. Часто количество субстрата нельзя выразить числом микромолей, так как точно не известна масса молекулы, например, при действии на белок, крахмал, пектин, целлюлозу. В этих случаях определяют микроэквивалент затронутых реакцией групп. Так, при гидролизе белка учитывают не число прогидролизованных молекул, а число образовавшихся свободных карбоксильных или аминных групп, т. е. число расщепленных пептидных связей; при гидролизе крахмала и полисахаридов тАУ число прогидролизованных глюкозидных связей и т. д.
Комиссия по ферментам рекомендовала придерживаться определенных условий при установлении активности фермента: стараться вести определение при температуре 30 В°С и определять активность по начальной скорости реакции, когда концентрация субстрата достаточна для насыщения фермента и соответствует кинетике реакции нулевого порядка. Концентрации субстрата, фермента и рН выбирают оптимальными для данного фермента.
Если количество прореагировавшего субстрата очень мало или велико, допускается выражение результатов в миллиединицах (мЕ или мU) и килоединицах (кЕ и кU).
Активность ферментных препаратов. Содержание фермента в данном препарате условно выражается в стандартных единицах активности фермента на 1 мл ферментного раствора или 1 г препарата. Активность ферментного препарата выражается в микромолях субстрата, прореагировавшего в присутствии 1 мл ферментного раствора или 1 г препарата в заданных условиях за 1 мин. Число микромолей и будет равно числу стандартных единиц. Если фермент гомогенен, то его удельная активность может быть выражена в стандартных единицах на 1 мг фермента: если же препарат содержит балласт в виде неактивного белка, его удельная активность выражается в стандартных единицах на 1 мг белка в ферментном препарате. Молекулярная активность представляет собой число миллимолей субстрата или эквивалентов затронутой реакцией групп, прореагировавших в течение 1 мин с 1 ммоль фермента при оптимальных концентрациях субстрата, или число стандартных единиц, содержащихся в 1 ммоль фермента.
Если фермент содержит характерную простетическую группу или несколько каталитических центров, которые поддаются измерению, его активность можно выразить в величинах активности каталитического центра. Такая активность будет соответствовать молекулярной активности, если молекула фермента имеет один активный центр; если же число каталитических центров п,то активность одного центра будет в п раз меньше молекулярной.
Активность условного препарата. В технологии ферментов помимо общепринятых понятий об активности ферментных препаратов принято пользоваться понятием активности условного ферментного препарата. Это необходимо для оценки работы предприятия, сравнения его с другими аналогичными заводами, т. е. для сопоставления показателей по всем видам выпускаемой продукции. Для осуществления этого пересчета предполагают, что предприятие выпускает товарную продукцию в виде стандартного препарата с точно определенной активностью, измеряемой по основному ферменту в стандартных единицах в препарате на единицу массы препарата. Активность основного фермента в таком стандартном условном препарате устанавливается нормативами и называется активностью условного препарата.
За 1 усл, т ферментного препарата принимается 1 т препарата со стандартной активностью. Для пересчета выработанной товарной продукции в условные тонны можно пользоваться формулой
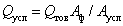
где 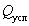 ВатАУ количество условного препарата, т;
ВатАУ количество условного препарата, т; 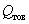 ВатАУ количество товарного препарата, т;
ВатАУ количество товарного препарата, т; 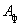 ВатАУ фактическая активность товарного препарата, ед./г;
ВатАУ фактическая активность товарного препарата, ед./г; 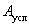 ВатАУ активность условного препарата, ед./г.
ВатАУ активность условного препарата, ед./г.
Стандартизация ферментных препаратов
Очень часто ферментативная активность партии готового препарата заметно отличается от предыдущих. Потребитель же должен получать препарат с определенной стандартной активностью. Поэтому на основе длительного анализа практической работы предприятий по данной технологии для каждого выпускаемого препарата устанавливается средний уровень активности с запасом 20 тАУ 30 %. Активность стандартного препарата определяется в единицах ФА на 1 г.
Для получения постоянной активности в препараты вводится наполнитель в определенном количестве, которое зависит от полученной на данном предприятии активности в культуре и препарате. Желательно, чтобы наполнитель по отношению к ферменту выступал и в роли стабилизатора, а не просто инертного соединения. Важно также учитывать свойство наполнителей сорбировать водяные пары. Так, например, крахмал, добавленный к ферментному препарату, препятствует его увлажнению, а хлористые соли калия и натрия способствуют увлажнению препаратов, поэтому при использовании последних возникает необходимость в герметической упаковке препаратов.
Стандартизацию препарата можно проводить, добавляя наполнитель, например, перед концентрированием, если продукт выпускается в жидком виде, или же перед сушкой распылением с учетом потерь на стадии концентрирования или при распылительной сушке, или в уже готовый сухой препарат. При смешивании готового сухого препарата с наполнителем необходимо, чтобы препарат и наполнитель имели приблизительно одну и ту же степень измельчения и влажность не более 10 тАУ 12 %. При перемешивании наполнителя и препарата, например, в шаровой мельнице за 30 тАУ 40 мин получаются вполне однородные ферментные препараты.
Количество наполнителя можно рассчитать по формуле
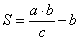 ,
,
где S тАУ количество наполнителя, необходимое для получения стандартного по активности препарата, кг; а тАУ активность исходного препарата, ед. ФА/r; тАУ количество исходного препарата, кг; с тАУ стандартная активность препарата, ед. ФА/г.
Известно, что хорошим стабилизатором амилолитических ферментов является крахмал, пектолитических тАУ крахмал или хлористый натрий. Стандартизировать неполитические препараты можно также диатомитом, желатином, бентонитом. Выбор наполнителя и стабилизатора, определение дозировки, необходимых условий хранения и длительности сохранения активности осуществляются экспериментально.
1. Общие сведения о глубинном способе производства ферментных препаратов
1.1 Принципиальная схема получения ферментных препаратов глубинным способом
Обобщённая схема производства ферментных препаратов при глубинном способе культивирования производственной культуры продуцента. Условно можно выделить три этапа: подготовительный этап (стерилизация оборудования, приготовление среды для культивирования, её стерилизация, подготовка культуры продуцента, инокулирование среды, очистка воздуха), этап получения производственной культуры (ферментация) и получение ферментных препаратов с заданными характеристиками.
При сравнении производств ферментативных препаратов, получаемых глубинным способ культивирования, можно отметить, что схемы отличаются в основном на первом и завершающем этапах. Это связано с использованием различных продуцентов и требуемыми качествами ферментативных препаратов. Также можно отметить различные пути использования нерастворимых остатков после этапа производственного культивирования. Он может использоваться для получения биошрота, поступать на культивирование в качестве инокулята или, после соответствующей обработки, входить в состав среды.
1.2 Глубинное культивирование микроорганизмов
Этот способ имеет ряд очевидных преимуществ перед поверхностным, так как позволяет значительно сократить производственные площади, исключить тяжелый непроизводительный ручной труд, улучшить гигиену труда, упрощает механизацию и автоматизацию производства, делает возможным переход на непрерывный способ культивирования. При глубинном способе культивирования более рационально используются питательные вещества сред, что дает возможность значительно сократить отходы производства в виде нерастворимых осадков твердой питательной среды, получать препараты ферментов с меньшим содержанием примесей и большей удельной активностью.
Глубинное культивирование проводят в вертикальных емкостях различного размера, называемых ферментаторами. Основное требование к ферментатору тАУ возможность проведения процесса культивирования продуцента в асептических условиях при интенсивном аэрировании среды. В процессе культивирования приходится иметь дело со сложной трехфазной системой жидкость тАУ твердая взвесь тАУ газ. В такой системе затруднены массообменные процессы, и поэтому усложняется аппаратурное оформление всей стадии выращивания.
Существующие промышленные ферментаторы по способу подвода энергии на аэрирование и перемешивание можно подразделить на три группы: аппараты с механическим перемешиванием и барботажем (комбинированные); с эжекционной системой аэрирования (подвод энергии к жидкой фазе) и барботажные (подвод энергии к газовой фазе). Для ферментной промышленности наибольший интерес представляет первая группа аппаратов, предназначенная для асептических процессов. Эти аппараты в основном имеют цилиндрическую форму и отличаются по объему, конструкции отбойников, перемешивающих устройств, уплотнений вращающегося вала и теплообменным устройствам. Максимальный объем ферментаторов с механическим перемешиванием и пеногашением составляет 2000 м3. Фирма ВлХемапВ» располагает внедрёнными разработками герметичных ферментаторов вместимостью до 360 тАУ 400 м3. Из отечественных аппаратов наиболее широко используются герметизированные ферментаторы вместимостью 50 м3 и вместимостью 100 м3 с механическим перемешиванием и барботажем воздуха. Кроме этих двух ферментаторов на многих ферментных предприятиях работают аппараты вместимостью 63 м3 производства ГДР.
Аппараты рассчитаны для работы под избыточным давлением 0,25 МПа и стерилизации при температуре 130 тАУ 140 В°С. Во избежание инфицирования культуры предусмотрены торцовые уплотнения вала перемешивающего устройства с паровой защитой. Торцовые уплотнения позволяют практически полностью предотвратить утечку среды или попадание воздуха в полость аппарата в месте выхода из него вала, что очень важно для обеспечения асептических условий процесса.
Важным фактором с точки зрения асептики процесса культивирования продуцента является правильная обвязка ферментатора. Под обвязкой подразумевают подвод всех коммуникаций с учетом возможности стерилизации острым паром участков, которые могут явиться источником заражения.
Анализ монтажных схем показывает, что они обычно состоят из типовых элементов. Рассмотрим одну из монтажных схем с нижним спуском среды, применяемых в самых различных микробиологических производствах. Ее характерной особенностью является установление термических затворов 3 и 5 для предупреждения проникновения посторонней микрофлоры в аппарат по коммуникациям через неплотности в уплотнениях Влседло тАУ клапанВ» запорной арматуры. В материальные трубопроводы, непосредственно соединенные с внутренней полостью аппарата, постоянно подается пар, а образующаяся пароконденсатная смесь отводится в канализацию или специальное устройство (при наличии открытых трубных окончаний). Как показывает опыт микробиологических производств, такие термические затворы обеспечивают весьма эффективную защиту аппаратов и коммуникаций от инфицирования.
В монтажных схемах должен предусматриваться свободный доступ пара во все точки стерилизуемых внутренних полостей аппаратов, трубопроводов и запорной арматуры, что обеспечивает достижение и поддержание требуемой температуры стерилизации. Однако на практике часто одно и то же монтажное оформление коммуникаций и запорной арматуры различного диаметра не обеспечивает равного стерилизующего эффекта. Например, в запорной арматуре и штуцерах малого диаметра требуемой степени стерильности достичь труднее. Ещё большие трудности возникают при термической стерилизации открытых трубных окончаний (пробник 4, штуцер для введения посевного материала 1 трубопровод для удаления отработавшего технологического воздуха 2). Открытые трубные окончания коммуникаций и узлов монтажных схем не позволяют создать в них давление, необходимое для эффективной стерилизации. Использование резиновых шлангов для подключения бутылей и колб с посевным материалом, пробоотборников и ёмкостей с жидкими добавками ещё больше затрудняет процесс стерилизации.
К открытым трубным окончаниям относятся и так называемые штуцеры для продувки коллекторного трубопровода для стерильной питательной среды, соединяющего установку непрерывной стерилизации питательной среды (или аппарат периодического действия) с ферментаторами. Такая схема коммуникации предусматривает подачу острого пара в линию в течение времени, гарантирующего стерилизуемость коллекторов питательной среды.
В процессе культивирования ведётся постоянный контроль за уровнем пены, накоплением ферментов, состоянием биомассы продуцента, рН среды, потреблением некоторых составляющих среды и т. д. По окончании культивирования культуральная жидкость подаётся либо непосредственно в производство, где она используется (спиртовое, пивоваренное, производство глюкозы и т. д.), либо на отделение жидкой фазы от биомассы и твёрдых нерастворимых частиц среды с целью использования фильтрата культуральной жидкости. В некоторых случаях биомасса продуцента поступает на получение ферментных препаратов различной степени очистки.
Последовательность процесса получения культуры микроорганизма является общей как для поверхностного, так и для глубинного способа культивирования. Она включает стадии приготовления посевного материала, приготовления питательной среды, её стерилизации, охлаждения, засева посевным материалом и выращивания. Однако в зависимости от способа культивирования аппаратурное оформление технологической схемы существенно различается.
Технологические схемы глубинного культивирования аэробных и анаэробных микроорганизмов почти не отличаются одна от другой, за исключением того, что в схемах культивирования анаэробных микроорганизмов исключается стадия подготовки воздуха и используются ферментаторы без аэрирующих и перемешивающих устройств.
Из циклона 1 с помощью трубоконвейера 2 они поступают в бункера 3,а из них по трубоконвейеру 4 тАУ на автоматические весы 5. Если требуется ввести в состав среды соли или какие-то иные компоненты в небольшом количестве, то они поступают в шнек 6,транспортирующий сыпучие материалы в норию 7. Из нории компоненты среды поступают в смеситель 8 для приготовления производственной питательной среды. Сюда же поступают вода и жидкие компоненты через соответствующие дозирующие и мерные устройства.
Для растворения солей и клейстеризации крахмала среду подогревают. Подготовленная подогретая среда с помощью насоса 30 поступает в нагреватель 22 системы непрерывной стерилизации питательной среды и затем подается в спиральный теплообменник 23 для выдерживания при температуре 140 В°С. Стерильная питательная среда охлаждается в теплообменнике 24 и направляется в чистый стерильным ферментатор 25,который заполняют на 65 тАУ 75 % в зависимости от степени пенообразования при росте культуры.
Посевной материал получают в посевном отделении. Среду для него готовят в специальной небольшой емкости 9, нагревают, перемешивают и насосом 10 направляют в инокуляторы первой 16 и второй 19 ступеней, где проводятся стерилизация, охлаждение и засев среды. Суспензия исходной культуры пересевается вначале в колбы на качалке, затем подается в инокулятор первой ступени 16,выращивается в нем и полностью передавливается в инокулятор второй ступени 19 со стерильной охлажденной средой. Выращенный посевной материал из инокулятора 19 передается в ферментатор 25. В процессе культивирования проводится пеногашение. Пеногаситель стерилизуют в специальном аппарате периодического действия 12, затем охлаждается и поступает через мерник 14 в ферментатор. В процессе культивирования в инокуляторах и ферментаторе растущая культура аэрируется кондиционированным стерильным воздухом. Сжатый в компрессоре и нагретый от 80 до 220 В°С воздух после удаления конденсационной влаги поступает в головной фильтр 11, заполненный стекловатой. Далее очищенный воздух поступает в индивидуальные фильтры тонкой очистки 13, 15, 17, 20, 26 и подается для охлаждения пеногасителя и аэрирования растущей культуры в инокуляторах 16, 19 и ферментаторе 25. Отходящий воздух из инокуляторов и ферментатора перед выбросом в атмосферу очищается в фильтрах 18, 21 и 27. Готовая культуральная жидкость насосом 30 или самотеком при перемешивании поступает в теплообменник 28 для охлаждения перед поступлением в сборник 29.Необходимость охлаждения вызвана тем, что сразу всю культуральную жидкость обработать невозможно, а при длительном хранении в сборнике может произойти инактивация ферментов. Из сборника 29 охлажденная жидкость по мере необходимости подается на фильтровальную установку.
Культура микроорганизмов, выращенная поверхностным способом, и культуральная жидкость после глубинного культивирования содержат большое количество балластных веществ. Выделение и очистка ферментов тАУ трудоёмкий и дорогостоящий процесс поэтому, если ферментный препарат можно использовать в виде неочищенной культуры микроорганизмов, его очистку не проводят. В таких отраслях, как спиртовая и кожевенная, целесообразнее использовать именно неочищенную культуру микроорганизма; то же самое можно сказать и об использовании культур микроорганизмов в сельском хозяйстве при приготовлении комбикормов и при непосредственной обработке кормов на фермах.
В большинстве отраслей пищевой промышленности (хлебопекарной, пивоварении, виноделии, сыроделии, крахмало-паточном и сокоэкстрактном производствах), а также в текстильной, меховой, микробиологической промышленности и особенно медицине можно использовать только очищенные препараты ферментов, частично или полностью освобожденные от балластных веществ.
Исходным материалом для получения очищенных ферментных препаратов может служить фильтрат культуральной жидкости, реже тАУ биомасса продуцента или водный экстракт из поверхностной культуры продуцента. Ферментные препараты могут быть получены в виде порошков или жидких концентратов. В процессе выделения происходит повышение доли активного белка в общей массе препарата, т. е. увеличивается его удельная активность.
Например, в таблице 1 показаны стадии очистки от сопутствующих ферментов и балластных веществ культуры Endomycopsis sp. 20-9. Анализ таблицы 1 показывает, что чистота глюкоамилазы в препарате возросла в 37 раз, в препарате отсутствует гликозилтрансфераза, а α-амилазная активность может быть отнесена за счёт действия глюкоамилазы, так как использовался колориметрический метод определения активности α-амилазы.
1.3.1 Принципиальная схема получения ферментных препаратов
Схема очистки фермента от балластных веществ сводится к освобождению его от нерастворимых веществ, сопутствующих растворимых веществ и других ферментов. Процессы получения очищенных препаратов из поверхностных и глубинных культур несколько различны. Из поверхностных культур труднее получить высокоочищенные препараты из-за большого количества балластных веществ. Из глубинных культур получить очищенные препараты несколько легче, но при этом приходится вести выделение из разбавленных растворов, если выделение ферментов проводится из жидкой части культуры. Выделение осложняется, если фермент внутриклеточный, и тогда необходимо разрушать клетки микроорганизмов.
Принципиальную схему выделения и очистки ферментов из глубинных и поверхностных культур микроорганизмов можно представить в виде следующей схемы.
Из схемы ясно, что экстракт из поверхностной культуры или фильтрат культуральной жидкости является исходным материалом для получения препаратов ферментов различной степени очистки. На первом этапе выделения отходом процесса является нерастворимая часть культуры тАУ биошрот, содержащий нерастворимые включения среды и биомассу продуцента.
Вместе с этим смотрят:
Анатомическое строение растений
Анатомия и физиология заднего мозга. Строение и механизм кровообращения
Анатомо-физологические механизмы безопасности и защиты человека от негативного воздействия
Бiологiчне рiзноманiття людських рас
Бiологiя iндивiдуального розвитку