Методичне забезпечення вивчення теми "Метали" в 9 класi
МРЖНРЖСТЕРСТВО ОСВРЖТИ РЖ НАУКИ УКРАРЗНИ
Чернiгiвський державний педагогiчний унiверситет iменi Т.Г.Шевченка
Хiмiко-бiологiчний факультет
Кафедра хiмii
Дипломна робота
МЕТОДИЧНЕ ЗАБАЗПЕЧЕННЯ ВИВЧЕННЯ ТЕМИ тАЮМЕТАЛИтАЭ В 9 КЛАСРЖ
МАНЧЕНКО ОЛЕНА СЕРГРЖРЗВНА
Науковий керiвник:
к.т.н., доц. кафедри хiмii
Замай Жанна Василiвна
ЧЕРНРЖГРЖВ тАУ 2007 р.
ЗМРЖСТ
ВСТУП
РОЗДРЖЛ 1. Загальнi властивостi металiв. Сплави
1.1 Загальна характеристика металiв
1.2 Фiзичнi властивостi металiв
1.3 Хiмiчнi властивостi металiв
1.4 Природнi сполуки металiв. Добування металiв
1.5 Сплави
РОЗДРЖЛ 2. Форми органiзацii навчання при вивченнi теми тАЮМеталитАЭ в шкiльному курсi хiмii
2.1 Традицiйна форма органiзацii навчального процесу
2.2 Нетрадицiйнi форми органiзацii навчальноi дiяльностi
РОЗДРЖЛ 3. Методичнi забезпечення проведення урокiв з теми тАЮМеталитАЭ
3.1 Тематичне планування теми тАЮМеталитАЭ
3.2 Методична розробка нетрадицiйного уроку з теми тАЮЗагальнi вiдомостi про металитАЭ
3.3 Методична розробка традицiйного уроку з теми тАЮФерум: його сполуки, властивостi та застосуваннятАЭ
3.4 Методична розробка уроку з використанням лабораторних робiт на тему тАЮХiмiчнi властивостi металiв. Електрохiмiчний ряд напруг металiвтАЭ
3.5 Розробка узагальнюючого уроку
ВИСНОВКИ
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
ВСТУПУрок i основною формою органiзацii навчально-виховноi роботи вчителя з класом тАУ постiйним, однорiдним за вiком та пiдготовкою колективом дiтей тАУ за державною програмою, твердим розкладом i в шкiльному примiщеннi. На уроках учнi пiд керiвництвом учителя систематично i послiдовно вiдповiдно до програми набувають теоретичних знань i практичних вмiнь i навичок, а також елементiв всебiчного розвитку особи. На уроках закладаiться фундамент свiтогляду молодого поколiння. Основний навчальним матерiал вивчаiться пiд час уроку, з ним пов`язанi iншi форми викладання хiмii.
Останнiм часом у практику роботи вчителя впроваджуються нетрадицiйнi форми органiзацii навчально-виховного процесу. Як свiдчать результати дослiджень та практичний досвiд, iх запровадження забезпечуi пiдвищення активностi навчально-пiзнавальноi дiяльностi учнiв, формування самостiйностi мислення, розвиток творчостi.
Метали тАУ основа матерiальноi культури людства, основний конструкцiйний матерiал в машино-, апарато- i приладобудуваннi. Всi вони мають загальнi, так званi металiчнi властивостi, але серед них виокремлюють близькi мiж собою типи (родини) металiв вiдповiдно до подiбностi електричних структур iхнiх атомiв i, отже, iх положення в перiодичнiй системi.
Актуальнiсть. Метали i складовою частиною як живих об`iктiв, так i продуктiв промисловостi. Знання властивостей металiв сприяi розширенню загального свiтогляду школярiв та даi знання щодо використання металевих предметiв за призначенням, тому пiдвищення ефективностi засвоiння знань учнiв з теми тАЮМеталитАЭ за рахунок застосування нетрадицiйних форм органiзацii навчального процесу i актуальним.
Об`iкт дослiдження тАУ навчально-виховний процес в 9 класi при вивченнi теми тАЮМеталитАЭ.
Предмет дослiдження тАУ методичнi пiдходи до вивчення теми.
Мета дослiдження: розробити методичне забезпечення вивчення теми тАЮМеталитАЭ при вивченнi хiмii в 9 класi.
У вiдповiдностi з поставленою метою ставляться такi завдання:
1) проаналiзувати науково-методичну лiтературу з питання щодо властивостей металiв та iх сплавiв;
2) проаналiзувати рiзнi методичнi пiдходи до вивчення теми;
3) розробити плани-конспекти нетрадицiйного, традицiйного урокiв та уроку з використанням лабораторних робiт.
РОЗДРЖЛ 1. ЗАГАЛЬНРЖ ВЛАСТИВОСТРЖ МЕТАЛРЖВ. СПЛАВИ
Метали i досить важливими елементами живоi природи. Бiльшiсть металiв входять до складу клiтин вищих живих органiзмiв. Питанням вивчення властивостей металiв та вiдкриттям нових займаiться багато вчених.
Всi перiоди перiодичноi системи починаються з металiв. Вздовж перiодiв поступово послаблюються металiчнi властивостi елементiв i посилюються неметалiчнi.
Атоми металiв, як правило, мають у зовнiшньому електронному шарi 1, 2 i значно рiдше 3 або 4 електрони. Тут з усiiю очевиднiстю виявляiться вплив зовнiшнього електронного шару на властивостi елементiв. Атоми металiв мають низькi значення потенцiалiв йонiзацii, тому легше вiддають своi електрони, нiж приiднують iх, i перетворюються на позитивно зарядженi йони [1-5].
Це означаi, що тi елементи, атоми яких мають s2p6-конфiгурацiю електронiв передостаннього енергетичного рiвня i мiстять 1тАФ2 електрони на останньому рiвнi, виявляють вищу металiчну активнiсть. У пiдгрупах активнiсть таких металiв зростаi зi збiльшенням протонного числа iхнiх атомiв.
Так, найактивнiшими i метали головноi пiдгрупи РЖ групи, особливо Fr. Активними металами i також елементи головноi пiдгрупи II групи, i серед них найактивнiший метал тАФ радiй.
Атоми металiв побiчних пiдгруп мають, як правило, у зовнiшньому електронному шарi 1тАФ2 електрони, а в передостанньому тАФ бiльше восьми. Значення потенцiалiв йонiзацii атомiв цих металiв вищi, а iх активнiсть iз збiльшенням протонного числа зменшуiться. Так, найактивнiшим металом побiчноi пiдгрупи РЖ групи i мiдь, найменш активним тАФ золото.
В атомах перехiдних металiв електрони заповнюють внутрiшнi енергетичнi рiвнi, тому утримуються ядром сильнiше, нiж електрони, розмiщенi на останньому енергетичному рiвнi. Цим i пояснюiться той факт, що радiуси атомiв елементiв побiчних пiдгруп меншi, нiж передбачалися за аналогiiю з атомами металiв головних пiдгруп за нормального заповнення електронних шарiв. Тому й виникаi рiзка змiна активностей металiв головних i побiчних пiдгруп.
До фiзичних властивостей металiв належать електропровiднiсть, теплопровiднiсть, здатнiсть деформуватися без руйнування. Завдяки пластичностi метали можна кувати, вальцювати, витягувати, штампувати. Ця властивiсть металiв маi велике практичне значення.
Усi метали за винятком ртутi за звичайних умов тАФ твердi речовини. Найтвердiшими i манган та хром, найм'якшим тАФ цезiй.
Для металiв характерне утворення кристалiчних ТСраток, у вузлах яких розмiщуються переважно йонiзованi атоми. Внутрiшню будову кристалiв визначають за допомогою рентгеноструктурного аналiзу.
Кристалiчнi ТСратки металiв можуть бути рiзних типiв. Найхарактернiшими i три типи: кубiчна об'iмноцентрована (лужнi метали, хром, ванадiй, α-залiзо, β-титан, свинець, вольфрам тощо), кубiчна гранецентрована (алюмiнiй, мiдь, срiбло, золото, γ-залiзо, нiкель, платина, паладiй тощо), щiльна гексагональна (магнiй, берилiй, цинк, кадмiй, а-титан). На рис. 1 подано елементарнi комiрки основних типiв кристалiчних ТСраток металiв.
Багатьом металам, особливо перехiдним, властивий полiморфiзм. Так, титан, цирконiй, скандiй, лантан, уран iснують у двох алотропних видозмiнах, стiйких за рiзних температур, олово, кальцiй, хром тАФ у трьох, манган тАФ у чотирьох, плутонiй тАФ у шести алотропних видозмiнах тощо.
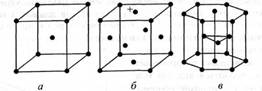
Рис. 1. Основнi типи кристалiчних ТСраток металiв (елементарнi комiрки): а тАФ кубiчна об'iмноцентрована; б тАФ кубiчна гранецентрована;в тАФ гексагональна
Метали, йони яких мають iнертногазову або псевдоiнертногазову електронну оболонку, а також йони з конфiгурацiiю зовнiшнього шару електронiв s2p6d10s2, дiамагнiтнi. Винятком i лужнi i лужноземельнi метали, якi внаслiдок сильноi делокалiзацii валентних електронiв виявляють парамагнiтнi властивостi.
Атоми перехiдних металiв, що мають незавершенi d- або f-рiвнi, парамагнiтнi. Чотири метали (залiзо, кобальт, нiкель, гадолiнiй) тАФ феромагнiтнi, тобто коефiцiiнт iх магнiтноi сприйнятливостi >> 1.
Майже всi метали мають високi температури плавлення. За найвищоi температури плавляться вольфрам, ренiй, тантал, за найнижчоiтАФ ртуть, галiй, цезiй.
За густиною всi метали подiляються на важкi та легкi. До легких належать метали, густина яких менша 6 г/см3 (лужнi, лужноземельнi, магнiй, берилiй, скандiй, титан, алюмiнiй, iтрiй тощо), до важких,тАФ густина яких перевищуi 6 г/см3. Найлегшим металом i лiтiй (0,53 г/см3), найважчим тАФ осмiй (22,5 г/cм3).
Механiчнi властивостi металiв визначаються будовою iхнiх кристалiчних ТСраток. Висока мiцнiсть металiв забезпечуiться створенням умов для досягнення iдеально впорядкованих структур кристалiв.
Загальнi фiзичнi i хiмiчнi властивостi металiв зумовленi подiбнiстю будови iхнiх атомiв i природи iхнiх кристалiчних ТСраток.
Атоми металiв виявляють спорiдненiсть до електрона близьку до нуля або негативну. Саме тому метали i вiдновниками, оскiльки вони легко вiддають електрони.
Для пояснення загальних властивостей металiв ученi А. Зоммерфельд, Е. Фермi, Ф. Блох, Л. Брiлюен [6] та iншi розробили теорiю металiчного стану. Згiдно з цiiю теорiiю [6] у кристалi металу валентнi електрони перебувають в iншому станi, нiж у вiльних атомах. Пiд час взаiмодii однакових атомiв замiсть енергетично рiвноцiнних вихiдних атомних орбiталей утворюються молекулярнi орбiталi, що вiдповiдають рiзним рiвням енергii. Цi молекулярнi орбiталi делокалiзованi, вони однаковою мiрою належать усiм атомам, що взаiмодiють. У мiру збiльшення числа таких атомiв додавання кожного з них приводить до утворення ще одного енергетичного рiвня; число енергетичних рiвнiв дорiвнюi числу атомiв, що взаiмодiють.
РЖз зростанням числа атомiв зростаi число дозволених енергетичних станiв i зменшуються вiдстанi мiж сусiднiми енергетичними рiвнями. У разi великого числа атомiв N сусiднi рiвнi вiдрiзняються настiльки мало, що утворюiться практично суцiльна енергетична зона. Електрон, що перебуваi на даному рiвнi, може поводити себе як вiльний, якщо найближчий енергетичний рiвень не зайнятий електронами. Внаслiдок делокалiзацii орбiталей цей ВлвiльнийВ» електрон може перемiщуватися у кристалi пiд впливом яких завгодно малих енергiй. Молекулярнi орбiталi, що становлять енергетичну зону, заповнюються електронами в мiру зростання енергii, i, згiдно з принципом Паулi, на кожнiй молекулярнiй орбiталi можуть розмiщуватися два електрони. Для прикладу зiставимо значення енергетичних рiвнiв електронiв в iзольованому атомi та в компактному кристалi якого-небудь лужного металу, наприклад натрiю. Для iзольованого атома порiвняно з кристалом металу вiдмiннiсть окремих рiвнiв i пiдрiвнiв енергii зовнiшнiх електронiв виявляiться рiзкiше.
Електропровiднiсть металiв залежить вiд кiлькостi електронiв, яким вiдповiдають незаповненi енергетичнi рiвнi з низькою енергiiю. Так, мiдь, золото, срiбло мають високу електропровiднiсть тому, що для них у кристалi, що мiстить N атомiв, енергетична зона може вмiстити 2N електронiв, а iх всього N.
Якщо в кристалi всi рiвнi енергетичноi зони заповненi електронами, то через нього струм проходити не може (наприклад, у речовинах з атомними кристалiчними ТСратками).
Отже, i електро-, i теплопровiднiсть металiв зумовленi здатнiстю валентних електронiв вiльно перемiшуватися по кристалу з верхнiх рiвнiв валентноi зони на нижнi рiвнi зони провiдностi.
З пiдвищенням температури електропровiднiсть типових металiв падаi. Це пояснюiться тим, що пiд час нагрiвання атоми металу починають iнтенсивнiше коливатись бiля положень iх рiвноваги, що утруднюi перемiщення електронiв. Електропровiднiсть напiвпровiдникiв пiд час нагрiвання зростаi, оскiльки iнтенсивнiше вiдбуваiться перехiд електронiв з валентноi зони у юну провiдностi.
Крiм електропровiдностi i теплопровiдностi всi iншi властивостi металiв i напiвпровiдникiв зумовленi наявнiстю делокалiзованих валентних електронiв [12].
Характерною властивiстю металiв i iхня здатнiсть лише вiддавати електрони й утворювати вiльнi позитивно зарядженi йони. Для металiв не характерне утворення сполук, в яких вони мають негативний ступiнь окиснення. Метали здатнi замiщувати Гiдроген у кислотах i утворювати солi. Отже, метали можуть бути тiльки вiдновниками.
Найактивнiшi метали мають малi значення потенцiалiв йонiзацii. Атоми активних металiв мають великi радiуси i незначну кiлькiсть електронiв на зовнiшньому енергетичному рiвнi. За величиною потенцiала йонiзацii можна порiвняти активнiсть металiв у розрiдженому газовому середовищi. На повiтрi, й особливо у водi, активнiсть металiв об'iктивнiше характеризуiться стандартним електродним потенцiалом, який визначаi, наскiльки легко утворюються позитивно зарядженi йони з нейтральних атомiв за наявностi води. Стандартний потенцiал тАФ це напруга, що виникаi мiж металом i розчином його солi за активностi йонiв цього металу, що дорiвнюi одиницi. Величини стандартних потенцiалiв вiдноснi. Здатнiсть металiв легко утворювати вiльнi позитивно зарядженi йони виявляiться в реакцiях взаiмного витiснення металiв або пiд час взаiмодii деяких iз них з кислотами-неокисниками [17].
Ряд електрохiмiчних потенцiалiв ТСрунтуiться на кiлькiсних значеннях стандартних потенцiалiв. Всi активнi метали, якi здатнi витiсняти Гiдроген з кислот-неокисникiв, стоять у ряду електрохiмiчних потенцiалiв до водню. Благороднi метали мають позитивнi значення стандартних потенцiалiв i розмiщуються за воднем. Зiставивши величини стандартних потенцiалiв, можна зробити висновок, який з металiв витiснятиме iнший метал iз розчину його солi.
Положення металу в ряду електрохiмiчних потенцiалiв характеризуi його здатнiсть до окисно-вiдновних перетворень за стандартних умов. Чим ближче метал розмiщений до початку ряду електрохiмiчних потенцiалiв, тим сильнiшi вiдновнi властивостi його атомiв i тим слабкiшi окиснювальнi властивостi його йонiв у водному розчинi.
Бiльшiсть металiв у земнiй корi перебуваi у виглядi сполук з iншими елементами. У самородному станi трапляються тiльки благороднi метали, якi характеризуються високими потенцiалами йонiзацii (золото, платина, платиновi метали, частково срiбло, мiдь i ртуть).
Мiнерали або iх сумiшi, придатнi для промислового добування металiв, називаються рудами. Рудами i сумiшi благородного металу або його сполуки з рiзними силiкатами. Пустою породою називаються домiшки, що супроводжують метал або його сполуку в рудi.
Найчастiше в земнiй корi трапляються малорозчиннi у водi та стiйкi проти окиснення мiнерали.
Досить стiйкими i малорозчинними i сульфiди багатьох металiв. РЖнодi сульфiди трапляються разом з арсенiдами (руди Co та Ni). Сульфiднi руди, що мiстять цинк, свинець, срiбло, мiдь, бiсмут з домiшками рiдкiсних металiв (германiй, ренiй, iндiй), називаються полiметалiчнимирудами.
Сульфiдiв активних металiв у земнiй корi не виявлено, оскiльки вони нестiйкi [12].
Лужноземельнi метали i рiдкiсноземельнi елементи в природi трапляються у виглядi не розчинних у водi карбонатiв, фторидiв, фосфатiв. Кальцiй, стронцiй i барiй входять до складу сульфатних мiнералiв, лужнi метали тАФ до складу подвiйних силiкатiв. Для натрiю i калiю поширеними i хлориднi мiнерали, якi утворилися в результатi кристалiзацii розчинiв пiд час висихання озер i морiв.
Добуванням металiв з руд займаiться галузь промисловостi тАФ металургiя.
Для збагачення руд застосовують методи магнiтноi та гравiтацiйноi сепарацii, пiнноi флотацii. Магнiтну сепарацiю можна застосовувати лише тодi, коли потрiбний компонент руди виявляi магнiтнi властивостi, i руди, притягуючись до магнiта, переносяться ним у збiрник руди. Методом гравiтацiйноi сепарацii здiйснюiться вiдокремлення мiнералу, який потрiбно вилучити з руди, вiд домiшок за допомогою важких розчинiв, що мають промiжну густину (мiж густиною мiнералу i домiшок). Часточки легкого компонента спливають на поверхню.
Флотацiя ТСрунтуiться на рiзнiй змочуваностi водою пустоi породи i мiнералу. Часточки компонента, який змочуiться водою, поглинаються, а часточки, що не змочуються, спливають на поверхню.
Для добування металу з його сполуки, що мiститься у рудi, потрiбно його вiдновити.
Найважливiшим методом добування металiв iз руд i вiдновлення iхнiх оксидiв вуглецем або оксидом карбону (РЖРЖ).
Вiдновлення металiв iз руд вуглецем i оксидом карбону (II) вiдбуваiться за високих температур, тому цей метод добування металiв належить до пiрометалургiйних.
Для металiв, якi не вiдновлюються вуглецем i оксидом карбону(РЖРЖ) (активнi метали), застосовують сильнiшi вiдновники: водень, магнiй, алюмiнiй, силiцiй. Метод вiдновлення оксиду одного металу iншим металом називаiться металотермiiю (якщо вiдновником i алюмiнiй тАФ алюмотермiiю). Метало-термiчним методом виплавляють титан, цирконiй, рiдкiсноземельнi метали, уран, хром тощо.
Для добування металiв застосовують також гiдрометалургiйний метод, тобто електролiз водних розчинiв солей та витiснення металiв з iхнiх розчинiв iншими металами. Гiдрометалургiйним методом добувають золото (витiснення його з цiанiдних розчинiв за допомогою цинку) [17].
Електропiрометалургiйним методом добувають лужнi, лужноземельнi метали, алюмiнiй, титан, торiй, нiобiй, тантал. Суть цього методу полягаi в електролiзi розплавлених солей. За цим методом добувають дуже активнi метали, якi не можна добути, використовуючи звичайнi вiдновники.
У рiдкому станi бiльшiсть металiв розчиняiться один в одному, утворюючи рiдкий сплав. Сплавами називаються гомогеннi сумiшi металiв у розплавленому i затвердiлому станах. Затвердiлi сплави мають рiзну природу: вони можуть виявляти характер твердих розчинiв, хiмiчних сполук, бути гетерогенними.
Щоб визначити природу сплаву, поверхню дослiджують мiкроскопiчним методом, а також пiддають його рентгеноструктурному аналiзу. Проте найчастiше сплави дослiджують, проводячи фiзико-хiмiчний аналiз [17].
Про взаiмодiю мiж металами можна судити на пiдставi вимiрювання питомоi електропровiдностi систем (електропровiднiсть окремих металiв вища за електропровiднiсть утворених ними iнтерметалiдiв). Внаслiдок взаiмодii металiв змiнюiться iхня твердiсть, магнiтна сприйнятливiсть. Склад утвореного металiду можна визначити, не видiляючи його в чистому виглядi, якщо вивчати змiну однiii з названих властивостей.
Нинi фiзико-хiмiчний аналiз i основним методом вивчення природи рiзних сплавiв. Роздiл фiзико-хiмiчного аналiзу, що дослiджуi перетворення в системi за змiною температури ii плавлення або тверднення залежно вiд складу, називаiться термiчним аналiзом. Дiаграми температура плавлення тАФ склад називаються дiаграмами стану, або дiаграмами плавлення системи. Термiчний аналiз до вивчення сплавiв вперше застосував у 1868 р. Д. К. Чернов, а в 1900 р. видатний росiйський вчений М. С. Курнаков розробив метод встановлення складу сполук у сплавах за допомогою термiчного аналiзу.
Для того щоб побудувати дiаграму стану, дослiджують експериментально кривi охолодження. Розплавлений чистий метал поступово охолоджують, вимiрюючи змiну температури сплаву з часом. На дiаграмi температура тАФ час дiстають горизонтальну лiнiю, що вiдповiдаi температурi плавлення металу (затримка в охолодженнi металу зумовлена видiленням прихованоi теплоти кристалiзацii). Якщо до металу А додати метал В, то в разi поступового охолодження рiдкого сплаву кристали металу А осiдатимуть за нижчоi температури, нiж коли б це був чистий метал. Якщо ж до чистого металу В додати метал А, спостерiгатиметься аналогiчна картина. Щоб побудувати дiаграму стану для двохкомпонентноi системи, виготовляють сумiшi двох чистих металiв iз рiзним iх кiлькiсним складом, розплавляють iх i визначають температури початку кристалiзацii як зупинки на дiаграмах температура тАФ час (рис. 2).
Дiаграми плавлення мають рiзну форму залежно вiд характеру взаiмодii компонентiв сумiшi мiж собою.
Якщо два метали мiж собою не утворюють сполуку, а в твердому станi не утворюють розчин, то дiаграма стану для такоi системи маi так звану евтектичну точку, яка вказуi на iснування сплаву з найнижчою температурою плавлення. Сплав, який маi таку низьку температуру плавлення, у твердому станi i сумiшшю дрiбних кристалiв i називаiться евтектикою.
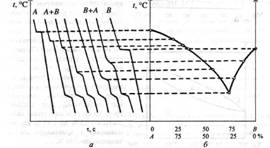
Рис. 2. Кривi охолодження (а) та дiаграма стану двохкомпонентноi системи (б)
Термiчний аналiз даi змогу виявити велику кiлькiсть сполук одних металiв з iншими (iнтерметалiдних сполук). Такi сполуки утворюють лужнi, лужноземельнi метали з металами, що мають слабкi металiчнi властивостi. Склад iнтерметалiдних сполук виражаiться формулами, в яких валентностi металiв не збiгаються з валентностями цих металiв у сполуках з неметалами. Наприклад, натрiй з оловом утворюi такi сполуки: NaSn4, NaSn6, NaSn3, NaSn2, NaSn, Na4Sn2, Na2Sn, Na4Sn.
Властивостi сплавiв вiдрiзняються вiд властивостей компонентiв сплаву. Температура плавлення сплаву, як правило, нижча за температуру плавлення найбiльш легкоплавкого його компонента, а твердiсть вища, нiж твердiсть складових частин сплаву. Особливо сильно зростаi твердiсть сплаву, якщо пiд час сплавляння утворюються хiмiчнi сполуки металiв. Високою твердiстю характеризуються сплави, що мiстять твердi розчини. Низькi температури плавлення, висока твердiсть надають сплавам бiльшоi цiнностi для сучасноi технiки, нiж цiннiсть металiв, з яких iх виготовляють [17].
РОЗДРЖЛ 2. ФОРМИ ОРГАНРЖЗАЦРЖРЗ НАВЧАННЯ ПРИ ВИВЧЕННРЖ ТЕМИ тАЮМЕТАЛИтАЭ В ШКРЖЛЬНОМУ КУРСРЖ ХРЖМРЖРЗВ системi форм навчання i виховання учнiв головна роль належить уроку. Це пояснюiться тим, що тiльки на уроцi реалiзуiться навчальна програма.
В методицi навчання хiмii за основу розподiлу урокiв на типи i види в рiзнi часи обиралися рiзнi ознаки. Так, у першi роки викладання хiмii в радянськiй школi, коли на перший план висувався формально-логiчний, або ВлдослiдницькийВ», метод викладання, основною формою навчання був так званий лабораторний урок. У розробцi методики проведення таких урокiв велика заслуга належить В. Н. Верховському [23].
Коли на перший план стали висувати не методи, а характер навчально-виховного процесу, типи урокiв почали розрiзняти за дидактичними цiлями. Так, С. Г. Шаповаленко, П. О. Глорiозов, Д. М. Кирюшкiн [22] розподiляли уроки хiмii на п'ять типiв: вивчення нових знань, iх закрiплення, узагальнення, облiк i особливий тип уроку тАФ змiшаний, або комбiнований. С. В. Дьякович [23] за дидактичною метою розрiзняi такi типи урокiв: а) засвоiння нових знань i умiнь (вивчення нового матерiалу); б) удосконалення i застосування теоретичних знань i умiнь; в) узагальнення й систематизацiя знань; г) контрольно-облiковi; д) змiшанi (комбiнованi).
За останнi роки на розробку проблеми уроку хiмii великий вплив справило вчення про логiку навчального процесу, розроблене дидактами. У свiтлi цього вчення кожний урок хiмii розглядаiться як завершена частина навчання, в якiй виявляються властивi йому закономiрностi. На кожному уроцi розв'язуiться ряд взаiмозв'язаних дидактичних завдань, одне з яких i провiдним, наприклад засвоiння учнями нового матерiалу, а iншi тАФ повторення знань, закрiплення i узагальнення вивченого, перевiрка досягнень учнiв тАФ пiдпорядковуються провiдному завданню. Вiдповiдно до цього будь-який урок можна розглядати як комбiнований. Тому багато методистiв беруть пiд сумнiв необхiднiсть вiдокремлення комбiнованих урокiв як особливого iх типу. Р. Г. РЖванова [11], наприклад, враховуючи те, що для вчителя важливiше знати, чому пiдпорядковувати весь процес навчання на уроцi, а не сам факт ВлкомбiнуванняВ» етанiв уроку, його навчальних завдань, класифiкуi уроки хiмii на три типи вiдповiдно до головноi дидактичноi мети, а саме:
1) уроки вивчення учнями нового матерiалу i набування нових умiнь;
2) уроки вдосконалення знань i умiнь учнiв;
3) уроки перевiрки знань i умiнь учнiв.
Така класифiкацiя найбiльш поширена сьогоднi в методицi навчання хiмii, проте i ii слiд розглядати як вiдносну. Адже навчальний характер уроку передбачаi, щоб поряд з викладанням учням нових знань забезпечувалися закрiплення iх i зворотний зв'язок, який сигналiзував би про засвоiння знань учнями. На уроках, присвячених повторенню вивчених питань, можуть передаватися учня i деякi новiзнання, здiйснюватися перевiрка засвоiного тощо. Реальнi уроки i хiмii настiльки рiзноманiтнi, що неможливо врахувати всi iх варiанти, якi створюються на практицi за допомогою комплексного використання прийомiв, форм i методiв навчання для розв'язання головних i супровiдних завдань, котрi до того ж розв'язуються на рiзних рiвнях залежно вiд етапу навчання.
Уроки кожного типу подiляються на види, якi вiдрiзняються мiж собою загальними методами розв'язання головноi дидактичноi мети: уроки з використанням пояснювально-iлюстративного, частково-пошукового i дослiдницького методiв (за Р. Г. РЖвановою) [11]. Уроки кожного виду ще мають рiзновиди, залежно вiд окремих конкретних методiв, якi переважно застосовуються для досягнення головноi мети. Вiдповiдно розрiзняють урок-бесiду, урок-лекцiю, урок-екскурсiю, урок-практичне заняття, урок-контрольну роботу, кiноурок тощо.
Такий пiдхiд до класифiкацii урокiв робить ii вкрай вiдносною, позбавляi чiткостi. Адже при одному i тому самому провiдному методi вчитель використовуi звичайно ще багато допомiжних методiв i прийомiв, якi вiдiграють пiд час уроку не менш важливу роль. РЖнколи буваi, що рiзноманiтнiсть застосованих на уроцi прийомiв взагалi не даi можливостi точно визначити його вид. Отже, немаi необхiдностi в тому, щоб формально дотримуватися типiзацii урокiв, штучно визначати iх вид.
Крiм основноi форми проведення уроку iснують альтернативнi форми проведення урокiв, тобто нетрадицiйнi форми урокiв. Цi форми урокiв користуються значною популярнiстю в старшiй школi. РЗх використання сприяi залученню школярiв до самостiйноi та творчоi роботи, розвитку аналiтичного мислення.
Лекцiя тАФ одна iз форм органiзацii навчання в загальноосвiтньому навчальному закладi. РЗi основою i системне усне викладення вчителем навчального матерiалу протягом одного уроку (чи пари урокiв), головний змiст якого становлять аналiз та узагальнення фактiв, а провiдними прийомами i пояснення й мiркування. Залежно вiд теми лекцii в нiй можуть превалювати характеристика, опис, розповiдь про певнi факти, процеси, явища. Структура традицiйноi лекцii така: органiзацiя дiяльностi вчителя й учнiв; формулювання теми, постановка мети i завдань; актуалiзацiя опорних знань учнiв; викладення змiсту дидактичного матерiалу вчителем, забезпечення умов сприйняття та засвоiння Його учнями; узагальнення та систематизацiя знань учнiв, здобутих у процесi читання лекцii.
У процесi пiдготовки, до лекцii вчителевi необхiдно: визначити оптимальний обсяг новоi iнформацii; забезпечити вiдповiднiсть iнформацii теоретичним положенням тiii науки, до якоi належить навчальний предмет; акцентувати увагу учнiв на основному, iстотному; забезпечити повноту та глибину реалiзацii змiсту навчального матерiалу. Важливо також вибрати та рацiонально використати методи i засоби викладу змiсту лекцii, визначити метод-домiнанту викладання навчального матерiалу (репродуктивний, проблемний, творчий). Специфiчним, як стверджуi РЖ.М.Чередов [3], у лекцii вiдносно до уроку i етап визначення домашнього завдання. Тут важливо уникати перевантаження учнiв. З цiiю метою доцiльно давати диференцiйованi завдання, план семiнарського заняття з теми лекцii, розраховуючи на те, то учнi заздалегiдь почнуть готуватися до обговорення конкретних питань за змiстом лекцii [20].
Залежно вiл дидактичноi мети та мiсця в логiчнiй структурi навчального матерiалу розрiзняють такi типи лекцiй: вступна, оглядова, узагальнююча, лекцiя-iнструктаж.
Специфiка вступноi лекцii полягаi в тому, що ii головною метою i розкриття провiдних iдей i аспектiв курсу навчального предмета, перспективи навчальноi роботи з учнями щодо оволодiння змiстом курсу предмета. При цьому важливо використовувати внутрiшньокурсовi та мiжкурсовi зв'язки. iх реалiзацiя забезпечуi цiлiсне сприйняття та уявлення про предмети, якi вивчаються, iхню практичну значущiсть. Для вступноi лекцii найтиповiшими прийомами викладання навчального матерiалу i порiвняння, спiвставлення, спирання на знання учнiв, здобутi у практичнiй дiяльностi та спiлкуваннi, доведення, висновки, оцiночнi судження.
Оглядова лекцiя проводиться, як правило, з метою висвiтлення широкого кола питань з того чи iншого курсу навчального предмета, ознайомлення з новою iнформацiiю з цих питань, розширення свiтогляду учнiв. Важливим моментом оглядовоi лекцii i вiдбiр i структурування навчального матерiалу, що забезпечуi пiдготовку учнiв до логiчного сприйняття систематизованоi iнформацii та засвоiння системних знань. Превалюючими прийомами оглядовоi лекцii i розповiдь, опис та аналiз фактiв, явищ, процесiв. Засобами реалiзацii змiсту оглядовоi лекцii i рацiональне поiднання слова вчителя та наочностi (таблиць, кодокарт, кодофiльмiв, рiзних видiв ТЗН, зокрема комп'ютера та iн.)
Узагальнююча лекцiя зазвичай проводиться пiсля вивчення повного курсу навчального предмета або великого його роздiлу метою систематизацii та поглиблення знань учнiв. Вона i пiдсумком системи проведених ранiше урокiв i включаi провiднi аспекти курсу даного навчального предмета. У процесi узагальнюючоi лекцii доцiльним i використання узагальнюючих таблиць, схем, ТЗН тощо.
Лекцiя-iнструктаж проводиться з метою пiдготовки учнiв до семiнару, лабораторноi роботи, практичного заняття. Розкриваючи теоретичний i прикладний аспекти теми лекцii, вчитель акцентуi увагу на можливих та доцiльних шляхах використання теоретичних знань, навичок i вмiнь у процесi самостiйноi роботи; даi розгорнуте трактування того кола питань, якi передбачено розглянути на наступному заняттi. На лекцii-iнструктажi можуть бути поставленi завдання репродуктивного, реконструктивного, варiативно-тренувального, пошукового та творчого характеру; зосереджуiться увага учнiв на джерелах додатковоi iнформацii.
Таким чином, з метою пiдвищення якостi лекцii вчителевi необхiдно чiтко визначити мiсце теми лекцii в логiчнiй структурi курсу навчального предмета, оптимальний обсяг навчального матерiалу, форми, методи та засоби ефективноi його реалiзацii. Залежно вiд форми органiзацii i керування навчально-пiзнавальною дiяльнiстю учнiв лекцiя може бути монологiчною, дiалогiчною, полемiчною.
Характерними ознаками монологiчноi лекцii i превалююче викладання ii змiсту самим учителем, який розкриваi тi чи iншi положення у виглядi готових висновкiв. У ньому випадку учнi сприймають на слух iнформацiю, фiксують основнi положення, запам'ятовують. Монологiчна лекцiя маi своi переваги та недолiки. Переваги полягають у тому, що вчитель може чiтко визначити обсяг змiсту лекцii та забезпечити ii реалiзацiю, регламентувати дiяльнiсть вчителя i дiяльнiсть учнiв, подiлити матерiал на блоки й фрагменти, варiювати ними залежно вiд сприйняття учнями iнформацii.
Дiалогiчна лекцiя розрахована на пасивний ступiнь участi учнiв у розкриттi ii змiсту при керiвнiй та спрямовуючiй ролi вчителя. Лекцiя, яка проводиться в дiалогiчнiй формi, досягаi успiху тодi, коли вчителем добре продуманi та сформульованi запитання для дiалогу з учнями, передбаченi можливi варiанти вiдповiдей на них, визначенi серед них найбiльш суттiвi [2].
Полемiчна лекцiя передбачаi викладання змiсту матерiалу у виглядi постановки дискусiйних проблем, iдей, положень, що вимагають розв'язання в ходi дискусii. При цьому не виключенi рiзнi думки з того чи iншого питання. Роль учителя у проведеннi полемiчноi лекцii дуже складна. Йому необхiдно бути ерудитом, володiти мистецтвом полемiки, орiiнтуватися в рiзних поглядах та спрямовувати учнiв на правильнi висновки. Крiм того, вiн маi: бути демократичним, справедливим, винахiдливим, в мiру гнучким. Полемiка тАФ один зi способiв ефективного емоцiйного виливу на учня збудження його iнтересу, щиростi, бажання шукати iстину [3].
Незалежно вiд типу лекцii у процесi ii спостереження та аналiзу слiд звернути увагу на такi параметри:
- пiдготовка вчителя до лекцii (доцiльний вибiр теми лекцii);
- постановка триiдиноi мети та завдань лекцii; розробка систем питань (плану), що розкривають змiст лекцii; знання основноi та допомiжноi лiтератури з теми лекцii; засобiв ii реалiзацii, визначення провiдних iдей, вибiр оптимальноi структури лекцii логiчнiсть викладання матерiалу;
- прийоми викладання вчителем навчального матерiалу (пояснення, мiркування, використання наочностi, у тому числi ТЗН, комп'ютерноi технiки, додаткового дидактичного матерiалу);
- прийоми органiзацii навчально-пiзнавальноi дiяльностi учнiв у процесi читання лекцii складання розгорнутого або тезисного плану;
- конспектування лекцii; фiксацiя фактiв, якi необхiднi для наступного проведення практичного заняття чи лабораторноi роботи, розв'язання задач тощо; вибiр прийомiв запису матерiалу лекцii);
- способи активiзацii навчально-пiзнавальноi дiяльностi учнiв (постановка запитань i завдань для аналiзу, зiставлення i порiвняння рiзних фактiв, явищ, самостiйних висновкiв та пропозицiй);
- привертання уваги учнiв до змiсту лекцii за допомогою вiдомих прийомiв спiлкування пiд час ii читання: ВлЦе особливо важливо!.В», ВлВдумайтесь..В», ВлЗвернiть увагу..В» тощо; за допомогою таких висловiв: ВлЗробимо висновкиВ», Отже ми бачимо..; риторичних запитань, на якi ii пiзнiше дасть вiдповiдь сам учитель: ВлЧим пояснити цей факт?, ВлЯк пов'язанi мiж собою цi подii?В», пауз, якi дають змогу учням вдуматися у викладене;
- тип лекцii залежно вiд дидактичноi мети i ii мiсця в логiчнiй структурi навчального матерiалу i (вступна, оглядова, узагальнююча, i лекцiя-iнструктаж); залежно вiд форми органiзацii i керування навчально-пiзнавальною дiяльнiстю учнiв (монологiчна, дiалогiчна, полемiчна);
- ефективнiсть лекцii: стан дисциплiни учнiв; iнтерес до iнформацii, викладеноi вчителем; якiсть виконання навчальних завдань; вмiння учнiв робити висновки, вносити пропозицii; мiцнiсть, повнота та глибина знань учнiв з висвiтленоi теми.
Семiнарське заняття
Семiнарське заняття i формою навчання, що даi змогу ефективно i органiзувати самостiйну роботу учнiв. Семiнарськi заняття найчастiше проводяться у старших класах. При цьому учням надаiться можливiсть активно оперувати знаннями, здобутими на уроках, а також у процесi самостiйноi роботи з рекомендованою лiтературою. На семiнарському заняттi допустимi дискусii, заперечення, обговорення, аргументацiя тощо, що даi змогу учням бiльш осмислено i мiцно засвоювати тему. Семiнар тАФ це живий творчий процес, який не може бути запрограмований в усiх деталях [20].
Основними завданнями семiнарського заняття i: закрiплення, розширення та поглиблення знань учнiв, здобутих ранiше на уроках; формування i розвиток навичок самостiйноi роботи учнiв; реалiзацiя диференцiйованого пiдходу до навчання з урахуванням iндивiдуальних особливостей учнiв; створення умов для формування й розвитку iхнiх пошуково творчих знань та навичок.
За характером семiнарськi заняття подiляються на
Вместе с этим смотрят:
WEB-дизайн: Flash технологии
РЖiрархiчна структура управлiння фiзичною культурою i спортом в Хмельницькiй областi у м. КамтАЩянець-Подiльському
РЖгрова дiяльнiсть в групi продовженого дня
РЖнновацiйнi методи навчання на уроках зарубiжноi лiтератури
РЖнтенсифiкацiя навчального процесу у вищiй школi