Тесты как инструмент измерения уровня знаний по теме: "Кислородсодержащие органические соединения с элементами экологии"
В современную эпоху научно-технической революции необычайную сложность и важность приобрели вопросы взаимодействия природы и человека. Бурный рост населения Земного шара, интенсивное развитие техники во много раз увеличили степень воздействия человека на природу, потребление различных природных ресурсов. Серьезной проблемой стали вопросы возможного и к тому же быстрого истощения запасов полезных ископаемых, пресной воды, ресурсов растительного и животного мира, загрязнения природной среды.
Экологические проблемы имеют глобальный характер и затрагивают все человечество.
К числу самых волнующих, несомненно, относятся проблемы, связанные с загрязнением окружающей среды: воздуха, почвы, воды. Чтобы курс химии приобрел Влэкологическое звучаниеВ», нужно признать, что одной из главных его целей будет формирование у учащихся нового, ответственного отношения к природе.
ГЛАВА 1. ТЕСТИРОВАНИЕ КАК ОДНА ИЗ ФОРМ КОНТРОЛЯ ЗНАНИЙ
Одна из важных задач квалиметрии - быстрая и надежная оценка знаний человека. Теория педагогических тестов рассматривается как часть педагогической квалиметрии. Исследовалось состояние контроля знаний учащихся школ с применением тестовых измерителей и выявлялись основные проблемы при использовании тестов: качество и валидность содержания тестовых заданий, надежность результатов тестирования, недостатки обработки результатов по классической теории тестов, отсутствие использования современной теории обработки тестовых материалов с применением вычислительной техники. Высокая погрешность измерения тестовых результатов не позволяет говорить о высокой надежности результатов измерения.
Тестирование является одной из наиболее технологичных форм проведения автоматизированного контроля с управляемыми параметрами качества. В этом смысле ни одна из известных форм контроля знаний учащихся с тестированием сравниться не может. Но и абсолютизировать возможности тестовой формы нет никаких оснований.
Применение диагностических тестов в зарубежных школах имеет давнюю историю. Признанный авторитет в области педагогического тестирования Э. Торндайк (1874-1949) выделяет три этапа внедрения тестирования в практику американской школы:
1. Период поисков (1900-1915 гг.). На этом этапе происходило осознание и первоначальное внедрение тестов памяти, внимания, восприятия и других, предложенных французским психологом А. Бинэ. Разрабатываются и проверяются тесты интеллекта, позволяющие определять коэффициент умственного развития.
2. Последующие 15 лет - годы "бума" в развитии школьного тестирования, когда было разработано и внедрено множество тестов. Это привело к окончательному осмыслению роли и места тестирования, возможностей и ограничений.
3. С 1931 г. начинается современный этап развития школьного тестирования. Поиски специалистов направляются на повышение объективности тестов, создание непоерывной (сквозной) системы школьной тестовой диагностики, подчиненной единой идее и общим принципам, созданию нооых более совершенных средств предъявления и обработки тестов, накопления и эффективного использования диагностической информации. Напомним в связи с этим, что педология, развившаяся в России в начале века, безоговорочно приняла тестовую основу объективного школьного контроля.
После известного постановления ЦК ВКП(б) "О педологических извращениях в системе Наркомпроса" (1936 г.) были ликвидированы не только интеллектуальные, но и безобидные тесты успеваемости. Попытки возродить их в 70-х годах ни к чему не привели. В этой области наша наука и практика значительно отстали от зарубежной.
В школах развитых стран внедрение и совершенствование тестов шло быстрыми темпами. Широкое распространение получили диагностические тесты школьной успеваемости, использующие форму альтернативного выбора правильного ответа из нескольких правдоподобных, написания очень краткого ответа (заполнения пропусков), дописывания букв, цифр, слов, частей формул и т.п. С помощью этих несложных заданий удается накапливать значительный статистический материал, подвергать его математической обработке, получать объективные выводы в пределах тех задач, которые предъявляются к тестовой проверке. Тесты печатаются в виде сборников, прилагаются к учебникам, распространяются на компьютерных дискетах.
Виды тестового контроля знаний
При подготовке материалов для тестового контроля необходимо придерживаться следующих основных правил:
- Нельзя включать ответы, неправильность которых на момент тестирования не может быть обоснована учащимися. - Неправильные ответы должны конструироваться на основе типичных ошибок и должны быть правдоподобными. - Правильные ответы среди всех предлагаемых ответов должны размещаться в случайном порядке. - Вопросы не должны повторять формулировок учебника. - Ответы на одни вопросы не должны быть подсказками для ответов на другие. - Вопросы не должны содержать "ловушек".
Тесты обученности применяются на всех этапах дидактического процесса. С их помощью эффективно обеспечивается предварительный, текущий, тематический и итоговый контроль знаний, умений, учет успеваемости, академических достижений.
Тесты обученности все больше проникают в массовую практику. Ныне кратковременный опрос всех учащихся на каждом уроке с помощью тестов используют почти все педагоги. Преимущество такой проверки в том, что одновременно занят и продуктивно работает весь класс и за несколько минут можно получить срез обученности всех учащихся. Это вынуждает их готовиться к каждому уроку, работать систематически, чем и решается проблема эффективности и необходимой прочности знаний. При проверке определяются прежде всего пробелы в знаниях, что очень важно для продуктивного самообучения. Индивидуальная и дифференцированная работа с обучаемыми по предупреждению неуспеваемости также основывается на текущем тестировании.
Естественно, не все необходимые характеристики усвоения можно получить средствами тестирования. Такие, например, показатели, как умение конкретизировать свой ответ примерами, знание фактов, умение связно, логически и доказательно выражать свои мысли, некоторые другие характеристики знаний, умений, навыков диагностировать тестированием невозможно. Это значит, что тестирование должно обязательно сочетаться с другими (традиционными) формами и методами проверки. Правильно действуют те педагоги, которые, используя письменные тесты, дают возможность обучаемым устно обосновывать свои ответы. В рамках классической теории тестов уровень знаний испытуемых оценивается с помощью их индивидуальных баллов, преобразованных в те или иные производные показатели. Это позволяет определить относительное положение каждого испытуемого в нормативной выборке.
К наиболее значимым преимуществам IRT относят измерение значений параметров испытуемых и заданий теста в одной и той же шкале, что позволяет соотнести уровень знаний любого испытуемого с мерой трудности каждого задания теста. Критики тестов интуитивно осознавали невозможность точного измерения знаний испытуемых различного уровня подготовки с помощью одного и того же теста. Это одна из причин того, что в практике стремились обычно создавать тесты, рассчитанные на измерение знаний испытуемых самого многочисленного, среднего уровня подготовленности. Естественно, что при такой ориентации теста знания у сильных и слабых испытуемых измерялись с меньшей точностью.
В зарубежных странах в практике контроля нередко используются так называемые тесты успешности, которые включают несколько десятков заданий. Естественно, что это позволяет более полно охватить все основные разделы курса. Предъявляемые задания обычно выполняются в письменном виде. При этом используются два вида заданий:
а) требующие от учащихся самостоятельного составления ответа (задания с конструктивным типом ответа);
б) задания с выборочным типом ответа. В последнем случае учащийся выбирает из числа предъявленных ответ, который он считает правильным.
Важно отметить, что эти типы заданий подвергаются серьезной критике. Отмечается, что задания с конструктивным типом ответа приводят к необъективности оценок. Так, разные экзаменаторы и нередко даже один и тот же экзаменатор ставят разные оценки за один и тот же ответ. Кроме того, чем больше свободы в ответе у учащихся, тем больше и вариантов оценки преподавателей [1].
ГЛАВА 2. СОСТОЯНИЕ ИЗУЧАЕМОГО ВОПРОСА В СОВРЕМЕННОЙ РОССИЙСКОЙ ШКОЛЕ
План изучения темы
Тема ВлСпирты и фенолыВ» (6тАУ7 ч)
1. Спирты: строение, номенклатура, изомерия. 2. Физические и химические свойства спиртов. 3. Получение и применение метанола и этанола. 4. Многоатомные спирты. 5. Фенол: строение и свойства. 6. Генетическая связь между углеводородами и спиртами.
Тема ВлАльдегиды и карбоновые кислотыВ» (9 ч)
1. Альдегиды: строение и свойства.
2. Получение и применение альдегидов.
3. Предельные одноосновные карбоновые кислоты.
4. Отдельные представители карбоновых кислот (муравьиная, пальмитиновая, стеариновая, олеиновая кислоты).
5. Мыла как соли высших карбоновых кислот. Применение кислот.
6. Практическая работа № 3 ВлПолучение и свойства карбоновых кислотВ».
7. Практическая работа № 4 ВлЭкспериментальное решение задач на распознавание органических соединенийВ».
Преподавание темы начинается с 10 класса, первого полугодия. При изучении этой темы пользуются учебником химии под редакцией Г.Е. Рудзитис, Ф.Г. Фельдман, также учебником за 10 класс под редакцией Н.С. Ахметова. Дидактическим материалом служит книга по химии для 10классов под редакцией А.М. Радецкого, В.П. Горшкова; используются задания для самостоятельной работы по химии за 10 класс под редакцией Р.П. Суровцева, С.В. Софронова; используется сборник задач по химии для средней школы и для поступающих в вузы под редакцией Г.П. Хомченко, И.Г. Хомченко. [2,3, 4]
2.1 Одноатомные предельные спирты СnН2n+1OH
Строение молекул
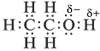
Из электронной формулы спирта видно, что в его молекуле химическая связь между атомом кислорода и атомом водорода весьма полярна. Поэтому водород имеет частичный положительный заряд, а кислород тАУ отрицательный. И как следствие: 1) атом водорода, связанный с атомом кислорода, подвижен и реакционноспособен; 2) возможно образование водородных связей между отдельными молекулами спирта и между молекулами спирта и воды:
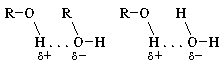
Получение
В промышленности:
а) гидратацией алкенов:
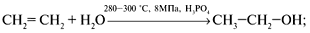
б) сбраживанием сахаристых веществ:
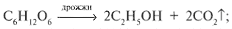
в) путем гидролиза крахмалосодержащих продуктов и целлюлозы с последующим сбраживанием образовавшейся глюкозы;
г) из синтез-газа получают метанол:
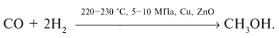
В лаборатории:
а) из галогенопроизводных алканов, действуя на них AgOH или КОН:
С4Н9Вr + AgОН 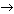 С4Н9OН + AgBr
С4Н9OН + AgBr ;
;
б) гидратацией алкенов:
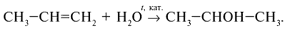
Химические свойства
1. Взаимодействие со щелочными металлами:
2C2H5 тАУ OH + 2Na  2C2H5 тАУ ONa + H2
2C2H5 тАУ ONa + H2 .
.
2. Взаимодействие с кислотами:
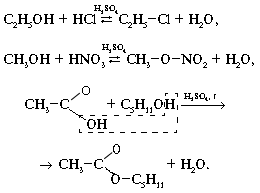
3. Реакции окисления:
а) спирты горят:
2С3Н7ОН + 9O2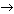 6СО2 + 8Н2О;
6СО2 + 8Н2О;
б) в присутствии окислителей спирты окисляются:
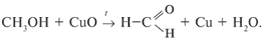
4. Спирты подвергаются дегидрированию и дегидратации:
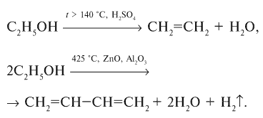
2.2 Многоатомные предельные спирты
Строение молекул
По строению молекул многоатомные спирты сходны с одноатомными. Отличие заключается в том, что в их молекулах имеется несколько гидроксильных групп. Содержащийся в них кислород смещает электронную плотность от атомов водорода. Это и приводит к увеличению подвижности водородных атомов и усилению кислотных свойств.
Получение
В промышленности:
а) гидратацией этиленоксида:
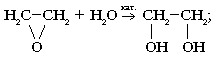
б) глицерин получают синтетическим путем из пропилена и путем гидролиза жиров.
В лаборатории: как и одноатомные спирты, путем гидролиза галогенопроизводных алканов водными растворами щелочей:
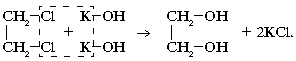
Химические свойства
Многоатомные спирты имеют сходное строение с одноатомными спиртами. В связи с этим их свойства тоже сходные.
1. Взаимодействие со щелочными металлами:
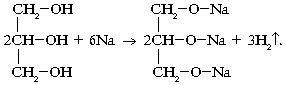
2. Взаимодействие с кислотами:
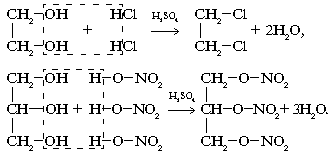
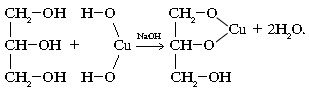
3. В связи с усилением кислотных свойств многоатомные спирты в отличие от однотомных реагируют с основаниями (при избытке щелочи):
2.3 Фенолы
RтАУOH или R(OH)n
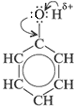
Строение молекул
В отличие от радикалов алканов (СН3тАУ, С2Н5 тАУ и т. д.) бензольное кольцо обладает свойством притягивать к себе электронную плотность кислородного атома гидроксильной группы. Вследствие этого атом кислорода сильнее, чем в молекулах спиртов, притягивает к себе электронную плотность от атома водорода. Поэтому в молекуле фенола химическая связь между атомом кислорода и атомом водорода становится более полярной, а водородный атом более подвижен и реакционноспособен.
Получение
В промышленности:
а) выделяют из продуктов пиролиза каменного угля; б) из бензола и пропилена:
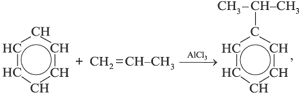
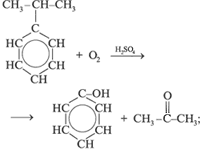
в) из бензола:
С6Н6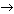 С6Н5Сl
С6Н5Сl 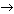 С6Н5 тАУ OH.
С6Н5 тАУ OH.
Химические свойства
В молекуле фенола наиболее ярко проявляется взаимное влияние атомов и атомных групп. Это выявляется при сравнении химических свойств фенола и бензола и химических свойств фенола и одноатомных спиртов.
1. Свойства, связанные с наличием группы тАУOH:
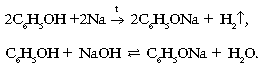
2. Свойства, связанные с наличием бензольного кольца:
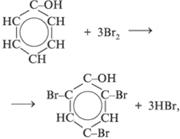
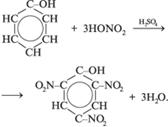
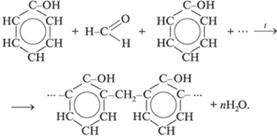
3. Реакции поликонденсации:
2.4 Альдегиды
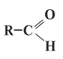
Строение молекул
Электронная и структурная формулы альдегидов следующие:
У альдегидов в альдегидной группе между атомами углерода и водорода существует  -связь, а между атомами углерода и кислорода тАУ одна
-связь, а между атомами углерода и кислорода тАУ одна  -связь и одна
-связь и одна  -связь, которая легко разрывается.
-связь, которая легко разрывается.
Получение
В промышленности:
а) окислением алканов:
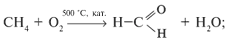
б) окислением алкенов:
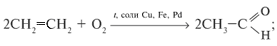
в) гидратацией алкинов:
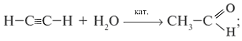
г) окислением первичных спиртов:
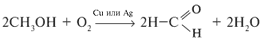
(этот метод используется и в лаборатории).
Химические свойства
1. Из-за наличия в альдегидной группе  -связи наиболее характерны реакции присоединения:
-связи наиболее характерны реакции присоединения:
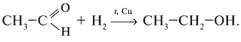
2. Реакции окисления (протекают легко):
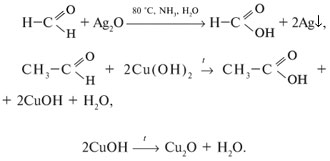
3. Реакции полимеризации и поликонденсации:
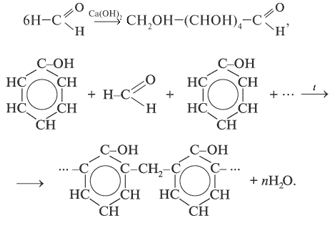
2.5 Одноосновные предельные карбоновые кислоты
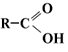
Строение молекул
Электронная и структурная формулы одноосновных карбоновых кислот следующие:
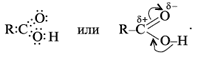
Из-за сдвига электронной плотности к атому кислорода в карбонильной группе атом углерода приобретает частичный положительный заряд. Вследствие этого углерод притягивает электронную плотность от гидроксильной группы, и атом водорода становится более подвижным, чем в молекулах спиртов.
Получение
В промышленности:
а) окислением алканов:
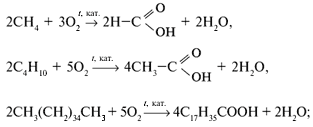
б) окислением спиртов:
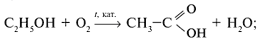
в) окислением альдегидов:
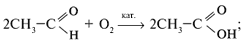
г) специфическими методами:
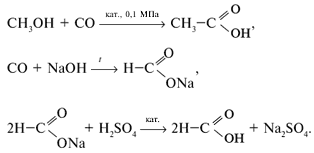
Химические свойства
1. Простейшие карбоновые кислоты в водном растворе диссоциируют:
СН3СООН 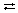 Н+ +СН3СООтАУ.
Н+ +СН3СООтАУ.
2. Реагируют с металлами:
2HCOOH + Mg 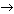 (HCOO)2Mg + H2
(HCOO)2Mg + H2 .
.
3. Реагируют с основными оксидами и гидроксидами:
HCOOH + КОН  НСООК+ Н2О.
НСООК+ Н2О.
4. Реагируют с солями более слабых и летучих кислот:
2СН3СООН + К2СО3 2СН3СООК + СО2
2СН3СООК + СО2 + Н2О.
+ Н2О.
5. Некоторые кислоты образуют ангидриды:
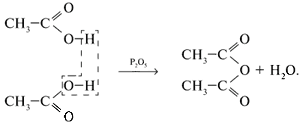
6. Реагируют со спиртами:
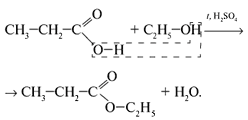
2.6 Сложные эфиры
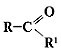
Получение
Сложные эфиры главным образом получают при взаимодействии карбоновых и минеральных кислот со спиртами:
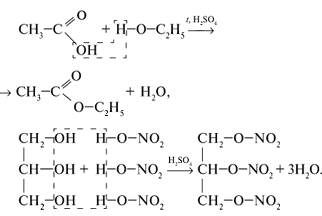
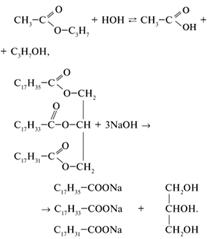
Химические свойства
Характерное свойство сложных эфиров тАУ способность подвергаться гидролизу [3,4]:
ГЛАВА 3. ЭКОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ИЗУЧЕНИЯ ТЕМЫ: ВлКИСЛОРОДСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯВ»
Фенолы являются одними из наиболее распространенных загрязняющих веществ, поступающих в водную среду со сточными водами нефтеперерабатывающих, лесохимических, коксохимических, анилинокрасочных и других предприятий.
Фенолы представляют собой оксизамещенные ароматических углеводородов (бензола, его гомологов, нафталина и др.). Обычно их принято разделять на летучие с водяным паром (фенол, креозолы, ксиленолы и др.) и нелетучие фенолы (ди- и триоксисоединения). По числу гидроксильных групп различают одноатомные, двухатомные и многоатомные фенолы. Фенолы в естественных речных условиях образуются при процессах метаболизма водных организмов, при биохимическом окислении и трансформации органических веществ.
Фенолы используются для дезинфекции, изготовления клеев и фенолформальдегидных пластмасс. Они входят в состав выхлопных газов бензиновых и дизельных двигателей, присутствуют в больших количествах в сточных водах нефтеперерабатывающих, лесохимических, анилинокрасочных и ряда других предприятий. Высокими концентрациями этих соединений отличаются сточные воды коксохимических производств, в которых уровни содержания летучих фенолов достигают 250-350 мг/л, многоатомных фенолов тАФ 100-140 мг/л.
В природных водах фенолы обычно находятся в растворенном состоянии в виде фенолятов, фенолятных ионов и свободных фенолов. Они могут вступать в реакции конденсации и полимеризации, образуя сложные гумусоподобные и другие довольно устойчивые соединения. В природных условиях сорбция фенолов взвесью и донными отложениями обычно несущественна. В зонах техногенного загрязнения этот процесс более значим. Типичные содержания фенолов в незагрязненных и слабозагрязненных водах не превышают 20 мкг/л. В загрязненных водах их содержания достигают десятков и сотен микрограммов в 1 л.
Хорошая растворимость фенолов и наличие соответствующих источников обусловливают высокую интенсивность загрязнения ими речных вод в условиях городских агломераций, где их содержания достигают десятков и даже сотен микрограмм в 1 л воды. Например, в водах рек Рейн и Майн в начале 1980-х гг. стабильно наблюдались повышенные концентрации многих представителей фенолов, поступающих со сточными водами. Надежным показателем степени загрязнения воды фонолами является численность фенолразрушающих бактерий. Сапрофитные анаэробы обычно присутствуют в местах интенсивного разрушения фенола, причем в условиях загрязнения количество собственно фенола (карболовой кислоты, оксибензола) и сапрофитных бактерий в донном иле и в придонном слое воды намного больше, чем в толще воды. Фенолы относительно интенсивно подвергаются биохимическому и химическому окислению, зависящему от температуры воды, величины рН, содержания кислорода и ряда других факторов. В речном потоке наблюдается тесная обратная зависимость между температурой воды и переносом фенолов, которая объясняется микробным окислением этих соединений.
Фенолы обладают токсическим действием и ухудшают органолептические показатели воды. Токсическое воздействие фенолов на рыб заметно возрастает с увеличением температуры воды. Известно, что фенолы играют важную роль в процессах аккумуляции тяжелых металлов высшими водными растениями, изменяют режим биогенных элементов и растворенных в речной воде газов. В процессе биохимической деструкции фенола происходит изменение всех элементов гидрохимического режима: снижение концентраций кислорода, увеличение цветности, окисляемости, БПК, щелочности и агрессивности (по отношению, например, к бетону) воды. Образующиеся в процессах деструкции и трансформации фенола продукты по своим свойствам могут быть более токсичными (например, пирокатехин, который, к тому же, способен образовывать со многими металлами хелаты).
Одноатомные фенолы тАФ сильные нервные яды, вызывающие общее отравление организма также и через кожу, на которую действуют прижигающе. Отравление человека фенолом происходит При вдыхании его паров и аэрозоля, образующегося при конденсации паров, попадании вещества в желудочно-кишечный тракт и при всасывании через кожу.
Острые отравления человека наблюдали в основном при попадании фенола на кожу. Действие фенола на кожу зависит в меньшей степени от концентрации раствора и в большей от длительности воздействия.
Гигиеническое регламентирование фенола: тАФ в воздухе рабочей зоны ПДК 0,3 мг/м3, пары, II класс опасности, вещество опасно при поступлении через неповрежденную кожу; тАФ в атмосферном воздухе ПДК максимально разовая 0,01 мг/м3, среднесуточная 0,01 мг/м3, II класс опасности; в почве ПДК не установлена.
Химическое загрязнение окружающей среды является наиболее ощутимым и заметным. В воздухе жилых помещений присутствуют оксиды азота, серы, углерода, летучие органические соединения, взвешенные вещества, микроорганизмы.
Существует несколько типов источников загрязнения атмосферы помещения: источники высокой температуры, строительные материалы и продукты жизнедеятельности человека и живых организмов. Продукты жизнедеятельности человека представлены главным образом оксидом углерода, углеводородами, аммиаком, альдегидами, кетонами, спиртами, фенолами. В малых количествах в результате жизнедеятельности человека выделяются ацетон, ацетальдегид, изопрен, этанол, этилмеркаптан, сероводород, сероуглерод, а также нитротолуол, кумарин, нафталин. Пыль также является источником загрязнения воздуха помещений как механическая взвешенная примесь (до 250 тыс. пылинок в литре воздуха) и как место жительства пылевых клещей, число которых в грамме пыли может достигать 2-3 тысяч. Продуктами жизнедеятельности клещей является ряд химических веществ, отрицательно сказывающихся на дыхательной системе человека и способных вызывать аллергические реакции.
Полимеры, лаки, краски
Значительная часть загрязняющих веществ в воздухе помещений вызвана применением полимерных и лакокрасочных материалов. При повышении температуры в помещении, отделанном с применением полимерных материалов, появляется специфический запах пластмасс, возникающий вследствие выделения изопрена, стирола, бензола и других веществ.
Полистирольные пластики являются источником выделения формальдегида, стирола, этилбензола, изопентана, бутанола. При 20 градусах по Цельсию в продуктах, выделяющихся из суспензионного полистирола, были обнаружены стирол в количестве 26,2 мкг/кг, этилбензол тАУ 12,3 мкг/кг, бутанол тАУ 21,5 мкг/кг. Вспененный полистирол является источником выделения изопентана тАУ 10,7 мг/кг, этилбензола тАУ 0,5 мг/кг, бутена, фенола и др. веществ. При исследовании состава продуктов, выделяющихся из поливинилхлорида при 20 градусах, методом газовой хроматографии в следовых количествах были идентифицированы бензол и этилен. Пластифицированный поливинилхлорид является источником выделения пластификаторов группы фталатов.
Шведские учёные оценили количество фталатов, поступающих в водоёмы Швеции только в результате мойки полов, покрытых линолеумом, в 60 тонн в год. Ковровые покрытия, гардины, мебель, изготовленные с применением синтетических волокон являются источником выделения ацетонитрила, аммиака, хлористого и цианистого водорода. Лакокрасочные материалы загрязняют воздух веществами, содержащимися в растворителях: бензолом, толуолом, уайт-спиритом, ксилолом и др. Древесно-стружечные плиты и некоторые части мебельной фурнитуры могут являться источником выделения в окружающую среду фенола, формальдегида. Большинство альдегидов и кеталей способны вызывать первичное раздражение кожи, глаз и дыхания. Это свойство в большей степени проявляется у низших членов ряда, у тех, которые являются ненасыщенными в алифатической цепи, и у галогензамещенных членов. Альдегиды могут оказывать обезболивающий эффект, но их раздражающее действие может заставить персонал ограничить воздействие еще до его появления. Раздражение слизистых оболочек может быть связано с цилиостатическим эффектом, когда повреждаются похожие на волосы реснички, которые выстилают дыхательные пути и обеспечивают очистку воздуха. Степень токсичности в семействе альдегидов изменяется в широких пределах. Некоторые из ароматических и алифатических альдегидов быстро расщепляются в процессе обмена веществ и не оказывают вредного воздействия; они считаются безопасными для использования в пищевых продуктах в качестве ароматизаторов. Тем не менее, другие члены семейства известны (или подозреваются) как канцерогенные вещества, и при возможном контакте с ними должны соблюдаться соответствующие меры предосторожности. Некоторые альдегиды являются химическими мутагенами, а некоторые - аллергенами. Еще одно токсическое воздействие альдегидов связано с их снотворным действием. Более подробная информация относительно некоторых членов семейства альдегидов приведена ниже, а также содержится в прилагаемых таблицах. Уксусный альдегид является раздражителем слизистой оболочки, а также оказывает общее наркотическое действие на центральную нервную систему. Низкие концентрации вызывают раздражение слизистой оболочки глаз, носа и верхних дыхательных путей, а также катар бронхов. Обширный контакт может привести к повреждению роговидного эпителия. Высокие концентрации вызывают головную боль, ступор, бронхит и отек легких. Глотание вызывает тошноту, рвоту, диарею, наркотическое состояние и остановку дыхания; смерть может наступить из-за повреждения почек, жировой дегенерации печени и сердечной мышцы. Уксусный альдегид поступает в кровь как метаболит этилового спирта, и вызовет покраснение лица, дрожание рук и другие неприятные симптомы. Этот эффект усиливается лекарственным средством тетурам (антабус), а также воздействием промышленных химикалий, таких как цианамид и диметилформамид.
В дополнение к его непосредственному воздействию уксусный альдегид относится к группе 2B канцерогенных веществ, то есть по классификации Международного агентства по исследованию рака (IARC) считается возможно канцерогенным для людей и канцерогенным для животных. В различных экспериментах уксусный альдегид стимулировал аберрацию хромосом. Повторяющееся воздействие паров уксусного альдегида вызывает дерматит и конъюнктивит. При хронической интоксикации симптомы похожи на симптомы хронического алкоголизма: потеря веса, анемия, бред, зрительные и слуховые галлюцинации, ослабление интеллекта и нарушения психики. Акролеин является распространенным загрязнителем атмосферы и содержится в отработанных газах двигателей внутреннего сгорания, в состав которых входит большое количество различных альдегидов. Концентрация акролеина увеличивается при использовании дизельного топлива или мазута. Кроме того, акролеин в больших количествах обнаружен в табачном дыме не только в виде макрочастиц но и - преимущественно - в газообразной форме. В сочетании с другими альдегидами (уксусный альдегид, пропиональдегид, формальдегид, и т.д.) его концентрация достигает 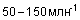 , что, по всей видимости, делает его одним из наиболее опасных альдегидов в табачном дыме. Таким образом, акролеин представляет собой возможную опасность для производственных помещений и окружающей среды. Акролеин токсичен и обладает сильным раздражающим действием, а высокое давление его насыщенного пара может привести к быстрому образованию опасных концентраций в атмосфере. Пары акролеина могут вызывать поражения дыхательных путей, а для глаз опасны как пары, так и сама жидкость. Контакт с кожей может привести к серьезным ожогам. Акролеин очень легко обнаруживается, поскольку сильное раздражение имеет место при концентрациях значительно ниже опасного для здоровья порога (его мощный слезоточивый эффект при очень низком содержании в атмосфере (
, что, по всей видимости, делает его одним из наиболее опасных альдегидов в табачном дыме. Таким образом, акролеин представляет собой возможную опасность для производственных помещений и окружающей среды. Акролеин токсичен и обладает сильным раздражающим действием, а высокое давление его насыщенного пара может привести к быстрому образованию опасных концентраций в атмосфере. Пары акролеина могут вызывать поражения дыхательных путей, а для глаз опасны как пары, так и сама жидкость. Контакт с кожей может привести к серьезным ожогам. Акролеин очень легко обнаруживается, поскольку сильное раздражение имеет место при концентрациях значительно ниже опасного для здоровья порога (его мощный слезоточивый эффект при очень низком содержании в атмосфере (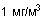 ) заставляет людей убегать с загрязненного места в поисках защитных средств). Следовательно, воздействие акролеина, по большей части, является результатом утечки из трубопроводов или емкостей. Нельзя полностью исключить и серьезных хронических последствий, например, рака. Наибольшую опасность представляет собой вдыхание паров акролеина. Результатом может быть раздражение носоглотки, ощущение стеснения в груди, одышка, тошнота и рвота. Бронхолегочные последствия поражения акролеином весьма серьезны; даже после выздоровления остаются неисчезающие радиологические и функциональные нарушения. Эксперименты на животных показали, что акролеин представляет собой отравляющее вещество нарывного действия; он повреждает слизистую оболочку дыхательных путей до такой степени, что дыхательная функция за время от 2 до 8 дней полностью блокируется. Неоднократное попадание на кожу может привести к дерматиту и аллергическим реакциям. Не так давно были открыты его мутагенные свойства. На примере дрозофилы Rapaport показал это еще 1948. Цель исследования заключалась в том, чтобы выяснить, не вызывается ли рак легкого, связь которого со злоупотреблением табаком неоспорима, присутствующим в дыме акролеином, а также не является ли содержащийся в горелом масле акролеин причиной некоторых форм рака пищеварительного тракта, которые, как было установлено, связаны с употреблением в пищу горелого масла. Недавние исследования показали, что акролеин для некоторых клеток является мутагенным (морские водоросли типа Dunaliella bioculata), а для других нет (дрожжи типа Saccharomices cerevisiae). Если акролеин является мутагенным для клетки, то в ее ядре обнаруживаются ультраструктурные изменения, подобные тем, что возникают при облучении морских водорослей рентгеновскими лучами. Акролеин также оказывает разнообразное влияние на синтез ДНК , действуя на некоторые ферменты. Акролеин очень эффективно блокирует работу ресничек бронхиальных клеток, которые помогают очищать бронхи. В сочетании с его воспалительным действием это дает высокую вероятность хронических заболеваний бронхов. Хлорацетальдегид обладает способностью сильно раздражать не только слизистые оболочки (он опасен для глаз даже в виде пара и может вызвать необратимые повреждения), но и кожу. Он вызывает подобные ожогам повреждения при контакте с 40% раствором и заметное раздражение при длительном или неоднократном воздействии 0,1% раствора. Меры предосторожности должны заключаться в предотвращении любого контакта с хлорацетальдегидом и контроле его содержания в атмосфере. Хлоралгидрат главным образом выделяется людьми сначала в виде трихлорэтанола и затем, по прошествии определенного времени, как трихлоруксусная кислота, которая при повторном воздействии может достигать половины дозы. В больших дозах хлоралгидрат действует подобно наркотику и угнетает дыхательный центр. Кретоновый альдегид является сильным раздражителем и может вызвать ожог роговицы; по токсичности он подобен акролеину. Были отмечены случаи аллергических реакций у контактирующих с ним рабочих, а некоторые тесты на мутагенность дали положительные результаты. Кроме того, что П-диоксан в значительной степени пожароопасен, он также относится IARC к канцерогенам группы 2B, то есть установленным канцерогеном для животных и возможным канцерогеном для человека. Изучение последствий вдыхания П-диоксана на животных показало, что его пары могут вызывать наркотическое состояние, поражение легких, печени и почек, раздражение слизистых оболочек, застой и отек легких, изменение в поведении и повышение количества клеток крови. Большие дозы П-диоксана, содержащегося в питьевой воде, вели к развитию опухолей у крыс и морских свинок. Эксперименты с животными также показали, что П-диоксан быстро впитывается через кожу, вызывая нарушение координации, наркотическое состояние, эритему, а также поражая почки и печень.
) заставляет людей убегать с загрязненного места в поисках защитных средств). Следовательно, воздействие акролеина, по большей части, является результатом утечки из трубопроводов или емкостей. Нельзя полностью исключить и серьезных хронических последствий, например, рака. Наибольшую опасность представляет собой вдыхание паров акролеина. Результатом может быть раздражение носоглотки, ощущение стеснения в груди, одышка, тошнота и рвота. Бронхолегочные последствия поражения акролеином весьма серьезны; даже после выздоровления остаются неисчезающие радиологические и функциональные нарушения. Эксперименты на животных показали, что акролеин представляет собой отравляющее вещество нарывного действия; он повреждает слизистую оболочку дыхательных путей до такой степени, что дыхательная функция за время от 2 до 8 дней полностью блокируется. Неоднократное попадание на кожу может привести к дерматиту и аллергическим реакциям. Не так давно были открыты его мутагенные свойства. На примере дрозофилы Rapaport показал это еще 1948. Цель исследования заключалась в том, чтобы выяснить, не вызывается ли рак легкого, связь которого со злоупотреблением табаком неоспорима, присутствующим в дыме акролеином, а также не является ли содержащийся в горелом масле акролеин причиной некоторых форм рака пищеварительного тракта, которые, как было установлено, связаны с употреблением в пищу горелого масла. Недавние исследования показали, что акролеин для некоторых клеток является мутагенным (морские водоросли типа Dunaliella bioculata), а для других нет (дрожжи типа Saccharomices cerevisiae). Если акролеин является мутагенным для клетки, то в ее ядре обнаруживаются ультраструктурные изменения, подобные тем, что возникают при облучении морских водорослей рентгеновскими лучами. Акролеин также оказывает разнообразное влияние на синтез ДНК , действуя на некоторые ферменты. Акролеин очень эффективно блокирует работу ресничек бронхиальных клеток, которые помогают очищать бронхи. В сочетании с его воспалительным действием это дает высокую вероятность хронических заболеваний бронхов. Хлорацетальдегид обладает способностью сильно раздражать не только слизистые оболочки (он опасен для глаз даже в виде пара и может вызвать необратимые повреждения), но и кожу. Он вызывает подобные ожогам повреждения при контакте с 40% раствором и заметное раздражение при длительном или неоднократном воздействии 0,1% раствора. Меры предосторожности должны заключаться в предотвращении любого контакта с хлорацетальдегидом и контроле его содержания в атмосфере. Хлоралгидрат главным образом выделяется людьми сначала в виде трихлорэтанола и затем, по прошествии определенного времени, как трихлоруксусная кислота, которая при повторном воздействии может достигать половины дозы. В больших дозах хлоралгидрат действует подобно наркотику и угнетает дыхательный центр. Кретоновый альдегид является сильным раздражителем и может вызвать ожог роговицы; по токсичности он подобен акролеину. Были отмечены случаи аллергических реакций у контактирующих с ним рабочих, а некоторые тесты на мутагенность дали положительные результаты. Кроме того, что П-диоксан в значительной степени пожароопасен, он также относится IARC к канцерогенам группы 2B, то есть установленным канцерогеном для животных и возможным канцерогеном для человека. Изучение последствий вдыхания П-диоксана на животных показало, что его пары могут вызывать наркотическое состояние, поражение легких, печени и почек, раздражение слизистых оболочек, застой и отек легких, изменение в поведении и повышение количества клеток крови. Большие дозы П-диоксана, содержащегося в питьевой воде, вели к развитию опухолей у крыс и морских свинок. Эксперименты с животными также показали, что П-диоксан быстро впитывается через кожу, вызывая нарушение координации, наркотическое состояние, эритему, а также поражая почки и печень.
Формальдегид и его полимерная производная параформальдегид. Формальдегид легко полимеризуется как в жидком, так и в твердом состоянии, в результате чего образуется смесь химических соединений, известная как параформальдегид. Этот процесс полимеризации замедляется присутствием воды, и поэтому применяемый в промышленности формальдегид (известный как формалин или формол) представляет собой водный раствор, содержащий от 37 до 50 весовых процентов формальдегида; к этим водным растворам в качестве ингибитора полимеризации добавляют от 10 до 15 % метилового спирта. Формальдегид токсичен при глотании и вдыхании паров, а также может вызывать повреждения кожи. При обмене веществ он превращается в муравьиную кислоту. Токсичность полимеризованного формальдегида потенциально подобна токсичности мономера, поскольку при нагревании происходит деполимеризация. Воздействие формальдегида вызывает острые и хронические реакции. Доказано, что формальдегид является канцерогеном для животных; по классификации IARC он относится к группе 1B, как возможный канцероген для человека. Следовательно, при работе с формальдегидом должны приниматься такие же меры предосторожности, как и для всех канцерогенных веществ. Низкие концентрации паров формальдегида вызывают раздражение, особенно глаз и дыхательных путей. Из-за растворимости формальдегида в воде его раздражающий эффект ограничен верхними дыхательными путями. Концентрации порядка  Вавызывают легкую формикацию глаз и носоглотки; при
Вавызывают легкую формикацию глаз и носоглотки; при 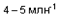 ощущение дискомфорта быстро нарастает; при
ощущение дискомфорта быстро нарастает; при 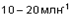 Ванаблюдается серьезное затруднение дыхания, жжение в глазах, носу и трахее, сильное слезотечение и кашель. Концентрации от 50 до
Ванаблюдается серьезное затруднение дыхания, жжение в глазах, носу и трахее, сильное слезотечение и кашель. Концентрации от 50 до  вызывают чувство стеснения в груди, головную боль, сильное сердцебиение, а в тяжелых случаях приводят к смерти из-за отека или спазма гортани. Также могут наблюдаться ожоги.
вызывают чувство стеснения в груди, головную боль, сильное сердцебиение, а в тяжелых случаях приводят к смерти из-за отека или спазма гортани. Также могут наблюдаться ожоги.
Формальдегид реагирует с хлористым водородом, и сообщалось, что в результате такой реакции во влажном воздухе может образовываться незначительное количество вторичного хлорметилового эфира, который является опасным канцерогенным веществом. Дальнейшие исследования показали, что при нормальной температуре и влажности окружающей среды даже при очень высоких концентрациях формальдег
Вместе с этим смотрят:
WEB-дизайн: Flash технологии
РЖiрархiчна структура управлiння фiзичною культурою i спортом в Хмельницькiй областi у м. КамтАЩянець-Подiльському
РЖгрова дiяльнiсть в групi продовженого дня
РЖнновацiйнi методи навчання на уроках зарубiжноi лiтератури
РЖнтенсифiкацiя навчального процесу у вищiй школi